Учитывая особенности интерфероногенеза детей раннего возраста, можно предположить, что при тяжелых вариантах заболевания инфекционный агент размножается быстрее, чем происходит усиление продукции интерферона зараженной клеткой, что существенно ограничивает защитные возможности организма. На фоне снижения продукции ИФН может происходить избыточный синтез провоспалительных цитокинов (ИЛ-1, ИЛ-6, ФНО), которые провоцируют возникновение опасных для ребенка системных реакций в виде гипертермии, тахикардии, общей слабости, анорексии, артериальной гипотензии [6, 7, 13, 15]. Таким образом, физиологический дефицит и возрастная функциональная недостаточность системы интерферона и специфических факторов защиты у детей раннего возраста, которая усугубляется при острых респираторных вирусных заболеваниях (ОРВИ), обусловливают целесообразность применения препаратов интерферона в терапии инфекционных заболеваний. Перспективным является использование Виферона – препарата на основе рекомбинантного ИФН-α2b в сочетании с мембраностабилизирующими веществами (антиоксидантами), выпускаемого в различных лекарственных формах (суппозитории ректальные по 150 000 МЕ, 500 000 МЕ, 1000 000 МЕ, 3000 000 МЕ, мазь и гель) [4, 10].
Известно, что противовирусный эффект Виферона реализуется уже спустя один час после введения препарата через прямую кишку или нанесения его местно на слизистые оболочки носо- и ротоглотки. В зависимости от используемой дозы интерферона и длительности применения препаратов на его основе по отношению к времени воздействия вируса на организм развивается доминирующий вируцидный (максимальный элиминирующий) или иммуномодулирующий эффект. Введение повышенных доз интерферона (детям до 6 лет вместо 150 000 МЕ – 500 000 МЕ) на начальных этапах развития инфекции позволяет обеспечить элиминацию инфекционного агента задолго до того, как собственные клетки начнут синтезировать эндогенный интерферон в достаточном количестве. Кроме того, введение интерферона позволяет «разгрузить» пораженные клетки и компенсировать их неспособность к продукции собственного интерферона в необходимых количествах.
Наконец, ускоренная элиминация инфекционного агента, достигнутая путем применения повышенных доз экзогенного интерферона, позволяет сократить сроки течения инфекционного процесса, препятствуя достижению критических концентраций провоспалительных цитокинов и, как следствие, развитию системных реакций. Обычные терапевтические дозы Виферона оказывают положительное иммуномодулирующее влияние: если функции иммунитета снижены (в том числе интерферонопродукция), происходит их активация, если повышены – уменьшение активности иммунной системы [1, 5, 14, 16, 17]. Проведенные ранее исследования применения Виферона при различных инфекционных заболеваниях продемонстрировали его высокую клинико-иммунологическую эффективность и отсутствие побочных эффектов [2, 8, 9, 12]. Однако до настоящего времени предметом научных дискуссий остается тактика выбора различных лекарственных форм Виферона при терапии острых респираторных инфекций (ОРИ) у детей. По-прежнему не изучена противовирусная и иммуномодулирующая активность комбинированной виферонотерапии у детей раннего возраста с ОРИ, нет данных о клинико-иммунологической эффективности. Необходимость оптимизации схемы и режима дозирования Виферона при лечении детей с ОРИ определила актуальность данного исследования.
Материалы и методы
При оценке эффективности различных схем применения исследуемых препаратов мы обращали внимание на выраженность и продолжительность основных клинических симптомов заболевания: температурная реакция, признаки интоксикации, катаральные явления со стороны носоглотки. Для этого нами проводился ежедневный осмотр пациентов с оценкой и регистрацией в карте всех жалоб и клинических симптомов, результатов осмотров врачей-специалистов, а также лабораторных и инструментальных исследований. Кроме того, изучалось влияние терапии на динамику показателей иммунного и интерферонового статуса, а также на продолжительность выделения вирусов из носоглотки. Состояние иммунологической резистентности оценивали по динамике показателей клеточного и гуморального иммунитета в сыворотке, а также секреторного IgA в носоглоточных смывах. Определение основных субпопуляций лимфоцитов с маркерами CD3+, CD3+4+, CD3+8+, CD3-16+, CD3-19+ в крови с подсчетом иммунорегуляторного индекса (ИРИ) проводили на проточном цитофлуориметре FACS Calibur (компания Becton Dickinson, США) путем двойного окрашивания после их специфического связывания с моноклональными антителами (МКАТ) Multi TEST IMK Kit. Содержание ИФН-α и ИФН-γ, циркулирующих в сыворотке крови, а также концентрации сывороточных IgG, IgM, IgA и секреторного IgA в носоглоточных смывах определяли методом, основанным на твердофазном «сэндвич»-варианте иммуноферментного анализа (ELISA). При этом использовали стандартные тест-системы «ИФА-БЕСТ» (производство ЗАО «Вектор-БЕСТ», г. Новосибирск) с пероксидазой хрена в качестве индикаторного фермента.
Для определения индуцированной продукции интерферона in vitro использовались супернатанты. Индукцию ИНФ-α осуществляли с помощью вируса болезни Ньюкасла (ВБН), штамм Канзас (концентрация – 1 ЦПЕ/мл), индукцию ИНФ-γ – с помощью фитогемагглютинина (концентрация 5 пкг/мл). Количественная оценка результатов проводилась с помощью построения калибровочной кривой, отражающей зависимость оптической плотности от концентрации исследуемого вещества. Учет результатов проводился на спектрофотометре StatFax-2100 с микропроцессором при длине волны для ИФН-α – 450 нм, а для ИНФ-γ – 492 нм. Статистическая обработка полученных данных проводилась на персональном компьютере с использованием пакета прикладных программ Miсrosoft Exel 200 и Biostatics v.4.03. Из элементов описательной статистики вычислялись: среднее арифметическое значение (M), стандартная ошибка среднего (m), число наблюдений (n) – для количественных признаков; количество пациентов (доли и проценты), имеющих те или иные показатели, – для качественных признаков. Статистическая значимость различий количественных признаков была оценена с использованием непараметрических (серийный критерий (S), критерии Манна – Уитни и Вилкоксона) и параметрических (t-критерий Стьюдента для зависимых и независимых групп) методов. При этом статистически значимыми считались отличия при p < 0,05. Связь между изучаемыми показателями оценивалась по результатам корреляционного анализа с вычислением коэффициента корреляции Пирсона (r).
Проведенный анализ клинической эффективности показал, что включение в комплексную терапию Виферона способствовало сокращению основных проявлений респираторной инфекции. Так, в I и II группах отмечалась более выраженная тенденция к сокращению периода лихорадки: 1,0 ± 0,2 суток (р < 0,05) и 1,3 ± 0,3 суток (р = 0,06) соответственно в I и II группах против 2,1 ± 0,4 суток в III группе, синдрома интоксикации: в I группе – 2,7 ± 0,3 суток (р < 0,05) и во II группе – 2,5 ± 0,2 суток (р < 0,05) против 3,8 ± 0,4 суток в III группе. Назначение Виферона (мазь и суппозитории) приводило к сокращению длительности заложенности носа (в I группе – 4,2 ± 0,3 (р < 0,05) и во II группе – 4,6 ± 0,3 дня (р = 0,06) против 5,4 ± 0,4 суток в III группе) и ринореи (в I группе – 3,1 ± 0,3 (р > 0,05) и во II группе – 2,9 ± 0,4 суток (р > 0,05) против 3,9 ± 0,4 суток в III группе). Наблюдалось также достоверное снижение продолжительности гиперемии зева: в I группе – 3,3 ± 0,2 (р < 0,05) и II группе – 3,4 ± 0,1 суток (р < 0,05) против 4,9 ± 0,4 суток в III группе. Кроме того, среди детей I и II групп, получавших Виферон®, не было зарегистрировано ни одного случая затяжного или осложненного течения ОРИ, в то время как у трех пациентов из III группы в связи с сочетанной бактериальной инфекцией потребовалось назначение антибиотикотерапии. Оценка протективной активности различных способов лечения показала, что на фоне модифицированного режима интерферонотерапии не было ни одного случая суперинфицирования, в то время как на фоне стандартной интерферонотерапии и базисного лечения было зарегистрировано по 11,5% и 10,7% случаев соответственно (р > 0,05).
Необходимо отметить, что если спектр элиминированных вирусов во II и III группах был представлен только вирусами гриппа (Н1N1, H3N2 и В) и парагриппа, то у пациентов I группы в состав элиминированных вирусов, наряду с вирусами гриппа и парагриппа, входили РС-, рино- и аденовирусы. Наиболее резистентными к проводимой терапии оказались бока- и метапневмовирусы. За время пребывания в стационаре у 46 детей отмечалось ухудшение состояния, проявляющееся повторной лихорадкой, интоксикацией и диарейным синдромом, что было расценено как развитие суперинфекции. При этом у детей I группы ухудшение состояния регистрировалось в 1,5 раза реже (23,9 ± 6,3%), чем во II группе (37,1 ± 7,1%, р > 0,05) и 1,7 раз – чем в III группе (39,1 ± 7,2%, р > 0,05), протекало в легкой форме и непродолжительно (1,7 ± 0,2 дня против 2,3 ± 0,2 и 2,3 ± 0,4 суток соответственно) (р < 0,05). Таким образом, полученные результаты свидетельствуют о том, что включение препарата Виферон® (суппозитории ректальные, мазь для наружного и местного применения) в базисную терапию ОРИ у детей раннего возраста положительно сказывается на эффективности лечения, выражаемой в достоверном снижении продолжительности основных клинических симптомов ОРИ, что позволяет снизить сроки пребывания пациентов в стационаре. Модифицированная виферонотерапия снижает вероятность внутрибольничного суперинфицирования, способствует элиминации более широкого спектра респираторных вирусов.
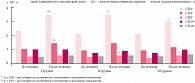
Наряду с оценкой клинической эффективности терапии 20 детям из I группы и по 21 ребенку II и III групп (всего 62 пациента) проводилось изучение состояния иммунной системы на фоне проводимой терапии. Анализ показателей клеточного звена иммунитета у детей до и после лечения представлен в таблице 2. Достоверное повышение исходно низких значений СD3+-, CD3+8+- и CD3-19+-популяций лимфоцитов зарегистрировано во всех трех группах наблюдения независимо от лечения, но с разной степенью достоверности. Следует отметить, что в III группе имелась лишь тенденция к нормализации низких показателей Т-хелперов (СD3+4+) (р > 0,05), в то время как в I и II группах повышение было достоверно значимым (р < 0,01). При сравнительном анализе средних значений субпопуляционного состава лимфоцитов было отмечено более значимое повышение (до возрастной нормы) CD3+- и CD4+-Т-лимфоцитов у детей I группы (р < 0,01) по сравнению с больными II и III групп (р < 0,05). Повышение остальных показателей субпопуляций лимфоцитов в исследуемых группах не было статистически значимым (рис. 1).
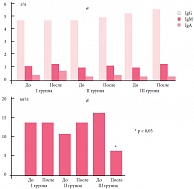
Динамика показателей гуморального звена иммунитета на фоне терапии в I группе характеризовалась повышением IgM и IgA в сыворотке крови, а во II и III группах – только IgM. Уровень сывороточного IgG существенно не менялся и был на нижней границе возрастной нормы. Относительно низкое содержание IgG, вероятно, связано с возрастными особенностями (низким активным синтезом у детей раннего возраста). Динамика sIgA в носоглоточных смывах характеризовалась достоверным снижением на фоне терапии в III группе (рис. 2). Таким образом, проведенная модифицированная интерферонотерапия значительно усиливала процессы дифференцировки и пролиферации лимфоцитов, проявляющиеся в достоверном повышении субпопуляций лимфоцитов с маркерами CD3+ и CD3+4+, а также способствовала активации антителообразования, что позволило добиться повышения уровня сывороточного IgA и IgM у пациентов I группы и предупредить дальнейшее понижение исходно низкого значения sIgA в носоглоточных смывах в I и II группах. Имевшее место снижение sIgA у детей III группы, получавших только препараты базисной терапии, свидетельствует о недостаточности защитной функции местного иммунитета слизистой оболочки респираторного тракта и может быть одной из причин вирусной суперинфекции у детей.
Для оценки влияния проводимой терапии на процессы интерфероногенеза нами был проведен анализ динамики показателей интерферонового статуса детей раннего возраста при ОРИ. При исследовании изменений показателей интерферона в сыворотке крови были установлены следующие особенности: во всех группах была отмечена тенденция к повышению уровня ИФН-α независимо от способа терапии (р > 0,05). В то время как уровень ИФН-γ в сыворотке повышался в I и II группах (р > 0,05) и понижался в III группе (р < 0,05) (табл. 3). Низкая интерферонопродуцирующая способность клеток, наблюдаемая нами в остром периоде заболевания, имела тенденцию к нормализации. Наибольшее влияние на индуцированную продукцию ИФН-α оказывала модифицированная интерферонотерапия в сравнении со стандартной интерферонотерапией и базисным лечением, несмотря на отсутствие значимых различий (р > 0,05). При анализе уровня спонтанной продукции ИФН-α клетками крови не было отмечено существенных изменений и ее значения были ниже порога чувствительности тест-систем. Тенденция к снижению уровня спонтанной продукции ИФН-γ по сравнению с исходными значениями наблюдалась у всех детей (р > 0,05). В связи с отсутствием достоверных различий по указанным показателям и малой информативностью полученных данных изучение спонтанной продукции интерферона нами не проводилось. При более детальном сравнительном анализе значений сывороточного интерферона в зависимости от уровня показателей и способов проводимой терапии были получены следующие данные. В I группе установлено, что число детей с низкими значениями сывороточного ИФН-α уменьшилось почти в 1,5 раза (75,0 ± 9,7% против 55,0 ± 11,1%, р > 0,05), в III группе – в 1,2 раза (71,4 ± 9,9% против 61,9 ± 10,6%, р > 0,05), во II группе количество детей с уровнем сывороточного ИФН-α ниже 2,0 пг/мл не изменилось (61,9 ± 10,6%).
Кроме того, увеличение числа детей со значениями ИФН-α > 6,0 пг/мл отмечено в I группе в 3,5 раза (с 10,0 ± 6,7% до 35,0 ± 10,7%, р < 0,05), во II группе – в 1,4 раза (с 23,8 ± 9,3% до 33,3 ± 10,3%, р > 0,05) и в III группе – в 1,7 раза (с 14,3 ± 7,6% до 23,8 ± 9,3%, р > 0,05). При оценке динамики сывороточного ИФН-γ у детей были получены следующие результаты. На фоне проведенной терапии в I группе число детей с низкими показателями сывороточного ИФН-γ (ниже 2,0 пг/мл) сократилось в 1,2 раза (с 80,0 ± 8,9% до 70,0 ± 10,3%, р > 0,05), в то время как в III группе отмечено повышение (с 61,9 ± 10,6% до 95,2 ± 4,7%, р < 0,01). Во II группе число детей с низким уровнем сывороточного ИФН-γ незначительно возросло (с 76,2 ± 9,3% до 80,9 ± 8,6%, р > 0,05). Кроме того, в I группе отмечено повышение частоты случаев с уровнем ИФН-γ в сыворотке выше 10,0 пг/мл (с 5,0 ± 4,8% до 20,0 ± 8,9%, р > 0,05), в III группе – снижение (с 23,8 ± 9,2% до 4,8 ± 4,6%, р > 0,05), во II группе – без изменений (14,3 ± 7,6%). По аналогии с оценкой показателей сывороточных ИФН нами был проведен подробный анализ показателей индуцированной продукции ИФН-α и ИФН-γ у обследованных детей в зависимости от терапии. Усиление продукции ИФН-α отмечалось чаще на фоне модифицированной схемы интерферонотерапии – 60,0 ± 10,9%, чем при стандартной интерферонотерапии – 38,0 ± 10,6% (р > 0,05) и базисной – 28,5 ± 9,9% (р < 0,05). Снижение уровня продукции определялось реже – 25,0 ± 9,7% против 28,6 ± 9,9% (р > 0,05) и 61,9 ± 10,6% (р < 0,05) соответственно. Показатели оставались на прежнем уровне в 15,0 ± 7,9% случаев – в I группе, в 33,4 ± 10,3% – во II группе и 9,6 ± 6,4% – в III группе. Повышение способности к индуцированной продукции ИФН-γ отмечалось чаще на фоне модифицированной схемы ИФН-терапии – 55,0 ± 11,1%, чем при стандартной ИФН-терапии – 39,1 ± 10,6% (р > 0,05) и базисной – 33,3 ± 10,3% (р > 0,05). Снижение уровня продукции ИФН-γ определялось реже в I группе – 35,0 ± 10,6% и II группе – 28,6 ± 9,9%, чем в III группе 47,6 ± 10,9% (р > 0,05).
При анализе зависимости продолжительности основных клинических симптомов ОРИ от характера изменений показателей индуцированной продукции ИФН нами было установлено, что повышение исходно сниженной способности к индуцированной продукции как ИФН-α, так и ИФН-γ сопровождалось более значимым сокращением продолжительности симптомов ОРИ в I группе, в отличие от II и III групп. Кроме того, в случае понижения показателей индуцированной продукции ИФН-α и ИФН-γ сроки течения заболевания были меньше при использовании модифицированной схемы интерферонотерапии, чем при стандартной интерферонотерапии или базисной терапии (табл. 4). Проведенный корреляционный анализ выявил наличие обратной зависимости основных симптомов заболевания от уровня индуцированной продукции ИФН при повторном обследовании. Так, коэффициент корреляции между уровнем индуцированного ИФН-γ и продолжительностью лихорадки составлял r = -0,32, интоксикации – r = -0,44 и выраженностью ринореи – r = -0,42. Полученные данные подтверждают, что повышение значений индуцированной продукции ИФН-γ в более поздние сроки болезни ассоциируется с эффективным иммунным ответом против инфекционных патогенов и является признаком благоприятного течения и исхода ОРИ.
Заключение
Таким образом, установлено, что модифицированная интерферонотерапия значительно усиливала процессы дифференцировки и пролиферации лимфоцитов, что проявлялось в достоверном повышении субпопуляций лимфоцитов CD3+ и CD3+4+, уровня ИФН-α в сыворотке и способности к продукции ИФН-α и/или ИФН-γ. Кроме того, усиление процессов антителообразования позволило повысить содержание сывороточного IgA на фоне модифицированной терапии Вифероном и предупредить дальнейшее снижение исходно низкого значения sIgA в носоглоточных смывах в I и II группах наблюдения. Высокий уровень иммунологической эффективности у детей I группы наблюдения способствовал достоверному снижению продолжительности основных клинических проявлений ОРИ у детей раннего возраста, суперинфицирования и сроков пребывания их в стационаре. Нами доказано, что усовершенствованный способ лечения ОРИ у детей раннего возраста, основанный на применении стартовых доз рекомбинантного ИФН-α2b 500 000 МЕ (ректально) в течение первых 5 дней с переходом на 150 000 МЕ в течение последующих 5 дней в комбинации с мазью Виферон® (интраназально), характеризуется хорошей переносимостью и высокой клинико-иммунологической эффективностью, а также снижает вероятность суперинфицирования.