количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Эффективность и переносимость интраназального применения препарата Виферон® при ОРВИ у детей
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Педиатрия" №5
- Аннотация
- Статья
- Ссылки
Проведено рандомизированное двойное слепое, плацебоконтролируемое исследование эффективности интраназального применения противовирусного и иммуномодулирующего препарата интерферона альфа-2b (Виферон®) в комплексной терапии детей раннего и дошкольного возраста, больных респираторными вирусными инфекциями. В исследовании участвовало 100 пациентов в возрасте от 1 года до 6 лет с различными проявлениями ОРВИ.
Показано, что мазь Виферон® является высокоэффективным средством в составе комплексной терапии у детей с ОРВИ, что выразилось в более значимом сокращении продолжительности клинических симптомов заболевания (интоксикации, катаральных и респираторных симптомов) начиная с 3–4-го дня лечения, по сравнению с плацебо.
Интраназальное применение мази Виферон® препятствовало внутрибольничному суперинфицированию (особенно аденовирусами). Клиническая эффективность местной виферонотерапии сопровождалась положительными изменениями цитокинового статуса в назальном секрете. При использовании препарата Виферон® (мазь) установлены его хорошая переносимость и отсутствие побочных явлений.
Проведено рандомизированное двойное слепое, плацебоконтролируемое исследование эффективности интраназального применения противовирусного и иммуномодулирующего препарата интерферона альфа-2b (Виферон®) в комплексной терапии детей раннего и дошкольного возраста, больных респираторными вирусными инфекциями. В исследовании участвовало 100 пациентов в возрасте от 1 года до 6 лет с различными проявлениями ОРВИ.
Показано, что мазь Виферон® является высокоэффективным средством в составе комплексной терапии у детей с ОРВИ, что выразилось в более значимом сокращении продолжительности клинических симптомов заболевания (интоксикации, катаральных и респираторных симптомов) начиная с 3–4-го дня лечения, по сравнению с плацебо.
Интраназальное применение мази Виферон® препятствовало внутрибольничному суперинфицированию (особенно аденовирусами). Клиническая эффективность местной виферонотерапии сопровождалась положительными изменениями цитокинового статуса в назальном секрете. При использовании препарата Виферон® (мазь) установлены его хорошая переносимость и отсутствие побочных явлений.
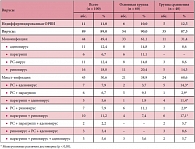
Рис. 1. Средняя продолжительность клинических симптомов у больных ОРВИ в динамике лечения
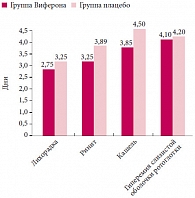
Таблица 1. Этиологическая структура ОРВИ у больных детей
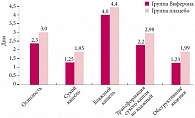
Рис. 2. Средняя продолжительность респираторных симптомов у больных ОРВИ в динамике лечения
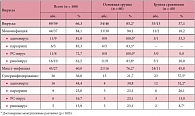
Рис. 3. Показатели местного иммунитета у больных ОРВИ в зависимости от тяжести заболевания
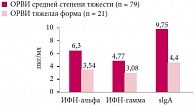
Рис. 4. Показатели местного иммунитета у больных ОРВИ в зависимости от этиологии возбудителя
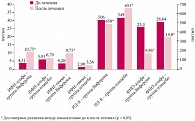
Рис. 5. Динамика показателей местного иммунитета у больных ОРВИ в наблюдаемых группах
Рис. 6. Структура нежелательных явлений у больных ОРВИ, получавших:
Профилактика и лечение острых респираторных вирусных инфекций (ОРВИ) являются актуальной проблемой педиатрии [1]. Наиболее высокая заболеваемость острыми респираторными инфекциями наблюдается в детском возрасте, причем 95% всех случаев острых поражений дыхательных путей приходится на их долю [2]. Частое применение антибиотиков, химиотерапевтических препаратов может сопровождаться селекцией новых устойчивых штаммов микроорганизмов [3]. В связи с этим важной задачей является повышение эффективности этиотропной терапии и снижение побочных эффектов. В настоящее время в терапии ОРВИ все чаще применяются препараты интерферонов. Показано, что противовирусные и антибактериальные свойства интерферонов в полной мере проявляются как при системном, так и при местном их применении [4, 5, 6, 7].
Материалы и методы исследования
Нами проведено рандомизированное двойное слепое, плацебоконтролируемое исследование по изучению эффективности интраназального применения противовирусного и иммуномодулирующего препарата интерферона альфа-2b (Виферон®) в комплексной терапии детей раннего и дошкольного возраста, больных респираторными вирусными инфекциями. Под наблюдением находилось 100 больных в возрасте от 1 года до 6 лет (57 мальчиков и 43 девочки). Все дети были госпитализированы в специализированное отделение для ОРВИ в первые 48 часов от начала заболевания. Пациенты были разделены на две группы: основная – 60 больных, которые помимо базисной терапии по поводу ОРВИ получали препарат Виферон® (мазь), и сравнения – 40 детей, получавших плацебо. Для обследования пациентов c ОРВИ, наряду с общепринятыми клинико-лабораторными методами, использовались специальные методы исследования. Вирусологическое обследование проводилось с целью этиологической расшифровки болезни. Иммунологическое исследование предусматривало определение показателей интерферонового и цитокинового статуса и исследование факторов мукоцилиарной защиты носоглотки (секреторный иммуноглобулин класса A (IgA) в назальном секрете).
Показатели иммунного и интерферонового статусов исследовали дважды: в острый период заболевания (1–2-й день болезни) и в период реконвалесценции (6–7-й день болезни).
Результаты исследования
При оценке тяжести ОРВИ нами установлено преобладание среднетяжелых форм заболевания у 79% больных. В наблюдаемых группах распределение детей по тяжести заболевания было аналогичным: в основной группе – 80% больных, в группе сравнения – 77,5% (р > 0,05). Тяжелые формы ОРВИ были диагностированы в 20% и 22,5% случаев соответственно. Наиболее часто у детей отмечался ларинготрахеит, который у части из них переходил в круп. Явления ларинготрахеита имели место у 40%, а крупа – у 39% больных. Круп был диагностирован у 41,7% детей основной группы и у 35% детей группы сравнения (р > 0,05). У одной трети (30%) больных ОРВИ выявлялись признаки фарингита: в основной группе – у 33,3% и в группе сравнения – у 25% детей. Различия не были статистически достоверными (р > 0,05). Бронхообструктивный синдром развился у 10% больных. Ларингит и трахеобронхит отмечались у 2% и 3% детей соответственно.
ОРВИ протекала без осложнений у 29% больных. Неосложненное течение заболевания наблюдалось у 25% детей в основной группе и у 35% (р > 0,05) больных в группе сравнения. Тяжелые осложнения в виде пневмонии, бронхита и отита имели место в 13% случаев. В основной группе на долю этих больных приходилось 13,3%, а в группе сравнения – 12,5%. Следует отметить, что в основной группе преобладали пневмония (5% против 2,5%) и бронхит (6,7% против 5%), а в группе сравнения – отит (5% против 1,7%). Однако различия достигли уровня статистической значимости только в отношении отита (р < 0,05). Таким образом, наблюдаемые группы были равноценными по своей клинической характеристике, что является важным условием для получения достоверных результатов исследования.
При наблюдении в клинике оценивались выраженность и длительность симптомов интоксикации и респираторного синдрома. Основные симптомы ОРВИ были связаны с общей интоксикацией организма (повышение температуры, снижение аппетита, вялость, бледность, снижение двигательной активности) и поражением дыхательных путей (ринит, кашель, осиплость голоса, одышка, дыхательная недостаточность). Интоксикация у большинства пациентов проявлялась снижением аппетита – у 90% детей, вялостью – у 89%, бледностью – у 89% больных и снижением двигательной активности – у 84%. Лихорадка отмечалась в 93% случаев. Респираторный синдром с разной выраженностью его компонентов был зарегистрирован при поступлении в стационар у всех больных (100%). Воспаление слизистой носа проявлялось в виде отека (5%), слизистого ринита в большинстве случаев (94%), ринита с гнойным отделяемым (1%). Гиперемия зева имела место также во всех случаях (100%). У значительной части больных ОРВИ (88%) наблюдался кашель: сухой – у 68%, малопродуктивный – у 12% и лающий – у 1 больного. У 7% детей кашель сопровождался отхождением мокроты, и у 2 из них выслушивались влажные хрипы в легких. Одышка (чаще экспираторного характера) отмечалась у 22% больных.
Диагноз ОРВИ устанавливался на основании характерных клинических проявлений и эпидемиологических данных, а у 89% детей удалось уточнить этиологию заболевания. Аденовирусная инфекция наблюдалась у 12,4%, парагриппозная инфекция – у 6,7%, респираторно-синцитиальная (РС-инфекция) – у 12,4%, риновирусная инфекция – 18%, смешанная инфекция – у 50,6% больных в различных сочетаниях. У 10% больных удалось доказать участие более 3 возбудителей (Табл. 1).
Вирусную природу заболевания в наблюдаемых группах детей удалось подтвердить с одинаковой частотой: в основной группе – в 90%, в группе сравнения – в 87,5% случаев. Значимые различия наблюдались при сочетании различных вирусов (р < 0,05).
В группе больных, получавших мазь Виферон®, средняя продолжительность большинства симптомов интоксикации (вялость, бледность, двигательная активность) была меньше, чем у больных, получавших плацебо, – 2,46 ± 1,1 против 2,97 ± 0,9; 3,14 ± 0,5 против 3,73 ± 1,05 и 2,65 ± 1,0 против 3,22 ± 1,15 суток соответственно. Менее различалась средняя продолжительность снижения аппетита.
Изменение других клинических симптомов ОРВИ (лихорадка, ринит, кашель, гиперемия зева) также происходило по-разному в группах наблюдения. Длительность лихорадки при течении ОРВИ составляла в основной группе 2,75 ± 0,4 суток, сравнения – 3,25 ± 0,6 суток (р > 0,05) (рис. 1). Признаки ринита сохранялись продолжительнее, чем лихорадка. Средняя продолжительность ринита также была меньше у больных ОРВИ, в лечение которых был включен Виферон®, – 3,25 ± 0,98 против 3,89 ± 1,0 суток при использовании плацебо, хотя различия были недостоверными (р > 0,05).
Более продолжительное время сохранялся кашель. Вместе с этим при использовании мази Виферон® его продолжительность составляла в среднем 3,85 ± 1,1 суток, а при плацебо – 4,5 ± 1,0 суток (р > 0,05) (рис. 1). Менее всего препарат Виферон® оказывал влияние на среднюю продолжительность гиперемии в зеве. В основной группе детей продолжительность данного клинического симптома составляла 4,1 ± 0,7 суток, в группе сравнения – 4,2 ± 0,8 суток (р > 0,05) (рис. 1).
Влияние терапии мазью Виферон® на среднюю продолжительность респираторного синдрома выражалось в достоверном сокращении длительности сухого кашля – 1,25 ± 0,14 суток в основной группе против 1,95 ± 0,22 суток в группе сравнения (р < 0,05). Кроме этого, достоверно быстрее отмечалась трансформация сухого кашля во влажный – 2,2 ± 0,1 против 2,98 ± 0,15 суток соответственно (р < 0,05), что в целом облегчало общее состояние детей, купировался обструктивный синдром – 1,23 ± 0,3 против 1,99 ± 0,3 суток (р < 0,05) (рис. 2).
Особо следует отметить тенденцию положительного влияния препарата Виферон® на продолжительность осиплости голоса. Купирование данного симптома происходило на 15 часов быстрее, чем в группе сравнения. По средним показателям в основной группе больных продолжительность осиплости голоса составила 2,3 ± 0,23 суток, а в группе сравнения – 3,0 ± 0,24 суток (p > 0,05). Хотя различия не носят достоверного характера, все же полученные данные имеют большое практическое значение, так как осиплость голоса является одним из первых предвестников развития такого угрожающего для жизни детей раннего возраста состояния, как круп.
Влияние мази Виферон® на элиминацию этиологически значимых вирусов из носоглотки оценивалось на основании их исчезновения после терапии (табл. 2). В основной группе элиминация вирусов была зарегистрирована в 85,2% случаев, в группе сравнения – в 37,1% случаев. Нами получены достоверные различия в элиминации этиологически значимых вирусов при моно- (90,1% против 18,2%) и при микст-инфекции (76,2% против 45,8%). В основной группе больных отмечалась полная (100%) элиминация адено- и РС-вирусов, в 83,3% случаев – вирусов парагриппа и в 81,8% случаев – риновирусов.
У части детей обеих групп при исследовании смывов из носоглотки после проведенной терапии отмечено суперинфицирование. Значительно реже суперинфицирование отмечалось после терапии мазью Виферон® – у 13 (21,7%) из 60 больных, чем у детей, получавших плацебо, – у 23 (57,5%) из 49 больных (р < 0,05). Выраженный протективный эффект препарата Виферон® (мазь) выявлен против аденовируса. Контаминация данным вирусом происходила в 1,7 раза реже, чем в группе сравнения.
При исследовании уровней цитокинов в смывах со слизистой оболочки носа до начала лечения у подавляющего большинства больных ОРВИ (90%) установлены низкие средние значения интерферона-альфа (ИФН-альфа) (4,46 ± 0,6 пкг/мл), ИФН-гамма (4,26 ± 1,16 пкг/мл) и повышенные уровни интерлейкина-8 (ИЛ-8) (528,0 ± 158,4 пкг/мл) и фактора некроза опухоли альфа (ФНО-альфа) (26,97 ± 5,5 пкг/мл). Уровень секреторного иммуноглобулина А (sIgA) был снижен незначительно – 8,84 ± 3,1 пкг/мл в общей группе, 8,04 ± 2,8 и 9,64 ± 3,4 пкг/мл по группам наблюдения.
Нами установлено, что при тяжелых формах заболевания отмечалось значительное угнетение выработки ИФН-альфа (3,54 ± 2,89 пкг/мл), ИФН-гамма (3,08 ± 2,1 пкг/мл) и sIgA (4,4 ± 3,6 пкг/мл). Указанные нарушения регистрировались и при среднетяжелых формах ОРВИ, но они не были столь выраженными и достоверно отличались от таковых у тяжелых больных: ИФН-альфа – 6,3 ± 4,33 пкг/мл, ИФН-гамма – 4,77 ± 2,6 пкг/мл и sIgA – 9,75 ± 5,9 пкг/мл (p < 0,05) (рис. 3).
Нами обнаружено, что явления крупа различной степени тяжести, а также обструктивный синдром развивались на фоне значительного подавления продукции ИФН-альфа и ИФН-гамма. При крупе показатели интерферонового статуса составляли 3,54 ± 2,8 и 3,0 ± 2,11 пкг/мл соответственно, при обструктивном синдроме – 3,14 ± 2,12 и 2,79 ± 1,55 пкг/мл соответственно. При указанных клинических формах ОРВИ значительно нарушалась выработка sIgA.
В назальных смывах у больных крупом I–III степени концентрация sIgA составляла 6,2 ± 2,0 пкг/мл, у больных с проявлениями обструктивного синдрома – 6,6 ± 3,2 пкг/мл. Подавление местного иммунитета при данных формах заболевания сопровождалось подъемом уровня ИЛ-8 – 656,3 ± 172,2 и 690,47 ± 95,2 пкг/мл соответственно. Можно предположить, что на недостаточную продукцию ИФН при данных формах респираторного синдрома оказывает влияние тяжесть состояния.
Средние значения иммунологических показателей у детей при остром фарингите составили: ИФН-альфа – 6,45 ± 1,5 пкг/мл, ИФН-гамма – 3,64 ± 0,8 пкг/мл, ИЛ-8 – 528,7 ± 156,3 пкг/мл, ФНО-альфа – 26,66 ± 15,3 пкг/мл и sIgA – 9,8 ± 5,5 пкг/мл; при ларинготрахеите: ИФН-альфа – 5,4 ± 4,34 пкг/мл, ИФН-гамма – 4,76 ± 2,7 пкг/мл, ИЛ-8 – 492,19 ± 144,3 пкг/мл, ФНО-альфа – 24,55 ± 15,3 пкг/мл и sIgA – 8,7 ± 5,0 пкг/мл. Проведенные исследования показали, что на местный интерфероновый статус оказывает влияние присоединение бактериальных осложнений (пневмония, бронхит, отит и др.). В первую очередь, это сказывается на выработке ИФН-альфа, ИФН-гамма и sIgA. Возможно, одновременное воздействие вирусов и микробов приводит к более глубоким нарушениям продукции интерферонов и иммуноглобулинов у больных с осложненным течением ОРВИ. При последних отмечались достоверно более низкие, по сравнению с пациентами с неосложненными ОРВИ, уровни ИФН-альфа (3,5 ± 1,7 против 5,66 ± 3,0 пкг/мл), ИФН-гамма (2,3 ± 0,2 против 4,66 ± 3,3 пкг/мл) и sIgA (4,1 ± 1,2 против 11,9 ± 9,3 пкг/мл) (p < 0,05). Более выраженное угнетение продукции интерферонов регистрировалось при ОРВИ с установленной вирусной этиологией, чем при недифференцированном остром респираторном заболевании: уровень ИФН-альфа составил 4,4 ± 1,3 против 7,43 ± 5,4 пкг/мл, ИФН-гамма – 3,7 ± 2,4 против 4,65 ± 3,6 пкг/мл и sIgA – 8,8 ± 6,3 против 10,6 ± 9,6 пкг/мл (p < 0,05).
Показатели местного иммунитета у больных ОРВИ зависели от этиологии заболевания. Выявлена значительная недостаточность системы интерферона при аденовирусной и риновирусной инфекциях (при воздействии аденовируса продукция ИФН-альфа составляла 4,60 ± 0,5 пкг/мл, ИФН-гамма – 3,3 ± 1,05 пкг/мл и sIgA – 4,7 ± 0,5 пкг/мл, при риновирусной инфекции – 4,45 ± 1,1, 3,63 ± 1,0 и 5,1 ± 1,1 пкг/мл соответственно). При сравнении интерферонового статуса при парагриппе и РС-вирусе также были выявлены различия. Показано, что РС-вирус оказывает более выраженное воздействие, по сравнению с вирусом парагриппа, на уровень индуцируемой продукции альфа- и гамма-интерферонов, а также sIgА: показатель ИФН-альфа составил 6,43 ± 2,0 против 7,4 ± 2,1 пкг/мл, ИФН-гамма – 3,6 ± 0,5 против 4,5 ± 1,3 пкг/мл и sIgA – 6,5 ± 1,1 против 10,8 ± 3,1 пкг/мл (p < 0,05) (рис. 4).
На основании вышеуказанных данных можно констатировать, что показатели местного иммунитета у больных ОРВИ зависят от тяжести и этиологии заболевания. Нами проводилось изучение влияния лечения препаратом Виферон® больных ОРВИ на показатели местного иммунитета. Выявленная клиническая эффективность местной виферонотерапии коррелировала с изменениями местного иммунитета, определяемого в назальных смывах у больных ОРВИ. Уровни ИФН-альфа у пациентов, получавших мазь Виферон®, повышались в динамике в 2,5 раза (с 4,31 ± 0,47 до 10,75 ± 2,34 пкг/мл) и достоверно отличались в периоде реконвалесценции по сравнению с детьми, получавшими плацебо (5,91 ± 1,8 и 6,79 ± 2,58 пкг/мл соответственно) (p < 0,05). Аналогичная ситуация отмечалась в отношении ИФН-гамма. Его динамика была статистически достоверной только в основной группе – показатель изменился с 4,26 ± 1,16 до 9,75 ± 3,78 пкг/мл (p < 0,05). В группе сравнения, хотя и отмечено повышение уровня ИФН-гамма с 2,98 ± 0,2 до 3,56 ± 0,86 пкг/мл в назальных смывах, указанные изменения не достигли уровня статистической значимости (p > 0,05).
В динамике ОРВИ у детей, получавших мазь Виферон®, концентрация ИЛ-8 в назальных смывах изменялась незначительно (с 506,13 ± 165,7 до 458,13 ± 161,8 пкг/мл, p > 0,05), тогда как на фоне плацебо она достоверно увеличивалась (с 549,9 ± 150,3 до 651,48 ± 170,3 пкг/мл, p < 0,05). Кроме этого, у детей, получавших мазь Виферон®, в динамике болезни значимо увеличивалась концентрация sIgА (с 8,04 ± 2,8 до 13,2 ± 4,17 пкг/мл, p < 0,05), которая оказалась достоверно более высокой в периоде реконвалесценции по сравнению с детьми, получавшими плацебо (с 9,64 ± 3,4 до 10,29 ± 3,79 пкг/мл, p > 0,05).
Влияние местной виферонотерапии на концентрацию ФНО-альфа в назальных смывах проявлялось в ее снижении с уровня 25,30 ± 6,4 до 9,86 ± 3,84 пкг/мл (p < 0,05). У больных ОРВИ, получавших плацебо, этот процесс был менее интенсивным (с 28,64 ± 7,9 до 19,8 ± 8,95 пкг/мл, p > 0,05). У больных ОРВИ основной группы увеличение средних показателей ИФН-альфа, ИФН-гамма и sIgA в назальных смывах было достоверно значимым по сравнению с таковыми в группе больных, получавших плацебо (рис. 5). Так, средние значения ИФН-альфа к 5-му дню лечения мазью Виферон® увеличились на 6,44 пкг/мл, в группе сравнения – на 0,88 пкг/мл (p < 0,05).
Средние показатели ИФН-гамма выросли на 5,49 и 0,58 пкг/мл, sIgA – на 5,16 и 0,65 пкг/мл (p < 0,05). Изменения показателей ИЛ-8 и ФНО-альфа характеризовались снижением на 48,0 и 15,44 пкг/мл, причем эта разница достоверно отличалась от таковой в группе сравнения – 101,58 и 8,84 пкг/мл (p < 0,05). При использовании мази Виферон® у больных ОРВИ установлена хорошая переносимость препарата, побочных явлений, связанных с его применением, отмечено не было. Наблюдаемые нежелательные явления (сыпь, диарея, рвота, ринорея и др.) были обусловлены различными причинами – приемом других лекарственных препаратов, обострением атопического дерматита, присоединением суперинфекции и др. (рис. 6).
Заключение
Препарат Виферон® является высокоэффективным средством для лечения ОРВИ у детей. Интраназальное введение мази Виферон® в составе комплексной терапии у детей с различными проявлениями ОРВИ приводит к более значимому сокращению продолжительности клинических симптомов заболевания (интоксикации, катаральных и респираторных симптомов) начиная с 3–4-го дня лечения, по сравнению с плацебо. Получены достоверные различия в элиминации вирусов как при моно-, так и при микст-инфекции. Интраназальное применение мази Виферон® препятствовало внутрибольничному суперинфицированию (особенно аденовирусами). Клиническая эффективность местной виферонотерапии сопровождалась изменениями цитокинового статуса в назальном секрете: продукция ИФН-альфа, ИФН-гамма и sIgA у больных ОРВИ в процессе лечения увеличивалась в 2 раза, что совпадало с элиминацией этиологически значимого вируса со слизистой носа. Увеличение концентрации sIgА оказалось достоверно более высоким в периоде реконвалесценции по сравнению с детьми, получавшими плацебо. При использовании препарата Виферон® (мазь) установлены его хорошая переносимость и отсутствие побочных явлений.
1. Острые респираторные заболевания у детей: лечение и профилактика (руководство для врачей) / Под ред. А.А. Баранова, Б.С. Каганова, А.В. Горелова. М.: Династия, 2004. 128 с.
2. Распространение гриппа и ОРВИ в мире и РФ в эпидсезон 2007–2008 гг. // Вакцинация. 2008. № 5. С. 3–5.
3. Малиновская В.В. Новый отечественный комплексный препарат Виферон и его применение в перинатологии и педиатрии при инфекционной патологии // Российский вестник перинатологии и педиатрии. 1999. № 3. С. 36–43.
4. Гатич Р.З., Колобухина Л.В., Исаева Е.И. и др. Эффективность Виферона при гриппе у взрослых больных // Русский медицинский журнал. 2004. № 14. С. 898–902.
5. Ершов Ф.И., Григорян С.С., Орлова Т.Г. и др. Противовирусная терапия ОРВИ у детей // Детские инфекции. 2006. № 3. С. 56–61.
6. Chen Q., Zhang L.L., Yu D.X. et al. A field trial for evaluating the safety of recombinant human interferon alpha-2b for nasal spray // Zhonghua Shi Yan He Lin Chuang Bing Du Xue Za Zhi. 2005. Vol. 19. № 3. P. 211–215.
7. Chon T.W., Bixler S. Interferon-tau: current applications and potential in antiviral therapy // J. Interferon Cytokine Res. 2010. Vol. 30. № 7. P. 477–485.
Новости на тему
22.02.2024
24.03.2022 16:00:00
05.07.2021
04.03.2021
Отправить статью по электронной почте
Ваш адрес электронной почты:
Проведено рандомизированное двойное слепое, плацебоконтролируемое исследование эффективности интраназального применения противовирусного и иммуномодулирующего препарата интерферона альфа-2b (Виферон®) в комплексной терапии детей раннего и дошкольного возраста, больных респираторными вирусными инфекциями. В исследовании участвовало 100 пациентов в возрасте от 1 года до 6 лет с различными проявлениями ОРВИ.
Показано, что мазь Виферон® является высокоэффективным средством в составе комплексной терапии у детей с ОРВИ, что выразилось в более значимом сокращении продолжительности клинических симптомов заболевания (интоксикации, катаральных и респираторных симптомов) начиная с 3–4-го дня лечения, по сравнению с плацебо.
Интраназальное применение мази Виферон® препятствовало внутрибольничному суперинфицированию (особенно аденовирусами). Клиническая эффективность местной виферонотерапии сопровождалась положительными изменениями цитокинового статуса в назальном секрете. При использовании препарата Виферон® (мазь) установлены его хорошая переносимость и отсутствие побочных явлений.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
