Клинико-лабораторные особенности вакцинации беременных против гриппа
- Аннотация
- Статья
- Ссылки
В сообщениях стратегической консультативной группы экспертов по иммунизации (SAGE) от 30 октября 2009 г. дается информация о том, что во всем мире большинство случаев заболевания гриппом A/H1N1 Калифорния/07/2009 по-прежнему приходится на подростков, молодых взрослых и беременных. От 1% до 10% пациентов с клиническим проявлением болезни требуется госпитализация. Из числа госпитализированных людей от 10% до 25% нуждаются в проведении интенсивной терапии, у 2–9% регистрируется летальный исход. В целом от 7% до 10% всех госпитализированных пациентов составляют беременные женщины на втором или третьем триместре беременности (4). По сравнению со всем населением вероятность того, что беременным потребуется медицинский уход в палате интенсивной терапии, в десять раз выше (3).
В настоящее время в России хорошо отработана и эффективно проводится прививочная кампания против пандемического и сезонного гриппа. Используются зарубежные и отечественные высокотехнологичные препараты, созданные по субъединичной технологии. Накопленный предшествующий опыт и данные клинических испытаний вакцин, проведенных в США, Великобритании и России, показывают их безопасность и иммунологическую эффективность.
Глобальный консультативный комитет ВОЗ по безопасности вакцин при анализе безопасности вакцинации беременных от сезонного гриппа сделал вывод, что высокий риск заболевания гриппом для будущей матери и плода с учетом минимального риска нарушений состояния их здоровья после вакцинации позволяет, на усмотрение врача, проводить вакцинацию от пандемического и сезонного гриппа (4). Вакцинация беременных против гриппа уже планово выполняется в некоторых странах Европы и Америки. В специальных предварительных исследованиях было показано, что современные субъединичные инактивированные вакцины не опасны для плода и не вызывают каких-либо нежелательных побочных эффектов. Помимо этого, при вакцинации беременных у 63% детей первых месяцев жизни сохраняется протективный иммунитет против гриппа, полученный трансплацентарно от матери (5).
В соответствии с рекомендациями ВОЗ и Минздравсоцразвития РФ (информационное письмо № 15-4/3108-07 от 11.12.2009) вакцинацию против гриппа беременным женщинам рекомендуется проводить во втором и третьем триместрах беременности в осенне-зимний период. Особого внимания заслуживают женщины, относящиеся к группе риска по развитию тяжелых форм заболеваний и летальности, вызванных осложнениями гриппа (6).
В настоящее время в мире наступил постпандемический период. В ближайшие годы вирус А/H1N1 Калифорния продолжит циркулировать в качестве сезонного вируса. Несмотря на значительное снижение уровня эпидемической опасности, по-прежнему важно, чтобы национальные органы здравоохранения сохраняли бдительность, поскольку поведение вируса А/Калифорния/07/2009 в качестве сезонного нельзя прогнозировать. Существует большая вероятность того, что вирус по-прежнему будет несоразмерно поражать беременных и молодую возрастную группу людей. В последних сообщениях ВОЗ призывает национальные органы здравоохранения помнить о том, что будут возникать отдельные случаи заболевания и местные вспышки инфекции, и что в некоторых регионах такие вспышки могут оказывать значительное влияние на эпидемическую ситуацию (7).
Иммунизация против гриппа беременных в нашей стране имеет много неизученных аспектов, недостаточно информации по клинической и иммунологической безопасности отечественных вакцин. В данной работе приводятся первые результаты клинико-лабораторных особенностей вакцинации беременных отечественными препаратами против гриппа.
Материалы и методы
Под наблюдением находились 28 женщин в возрасте 19–35 лет на втором триместре физиологически протекающей беременности. 1-я группа наблюдения – 16 женщин, которые вакцинированы современной отечественной субъединичной адъювантной вакциной МоноГриппол плюс (ООО ФК «Петровакс»); 2-ю группу наблюдения составили 12 непривитых беременных такого же срока с аналогичным состоянием здоровья. Вакцина вводилась однократно в верхнюю треть плеча, подкожно, в дозе 0,5 мл.
Особенностью вакцины является технология получения очищенных протективных антигенов (H и N) из инактивированного вируса гриппа А/H1N1/Калифорния/07/2009, связанных с водорастворимым высокомолекулярным иммуноадъювантом Полиоксидоний. Антигенный состав вакцины соответствует рекомендациям ВОЗ и ЕС для пандемической вакцины. Благодаря наличию в вакцине иммуноадъюванта, содержание вирусных антигенов пандемического штамма снижено в 3 раза (до 5 мкг), что уменьшает потенциально возможные риски развития побочных реакций. Полиоксидоний обладает широким спектром иммунофармакологического действия, повышая иммуногенность и стабильность вакцинных антигенов, модулирует иммунологическую память.
Все женщины привиты с учётом добровольного принятия условий наблюдения и подписания информированного согласия. После вакцинации в дневнике самонаблюдения на протяжении 30 суток производилась оценка возможных местных и системных реакций организма и последующий анализ субъективных и объективных изменений полученных результатов.
В комплексной оценке соматического здоровья использовались данные физикального обследования и лабораторного анализа. Для изучения возможного влияния вакцины на системы метаболического и иммунологического гомеостаза в определённые сроки поствакцинального периода проводилось изучение основных биохимических маркеров крови и уровень ключевых цитокинов в спонтанном и стимулированном тестах. Кратность осмотров: до вакцинации, на 7 и 30-е сутки после вакцинации.
Статистический анализ достоверности полученных данных проводился с помощью непараметрического критерия Уайта (U).
Результаты и обсуждения
Следует отметить, что 2/3 беременных имели риски течения беременности (угрозы прерывания, токсикозов, септических осложнений и внутриутробных инфекций). У 19 (из 28) выявлялись ДНК-маркеры хронических урогенитальных инфекций, что в целом характеризует низкий уровень исходного состояния здоровья женщин.
Анализ раннего и позднего пост-вакцинального периода показал, что ни у одной из наблюдаемых женщин не отмечены местные реакции, что характеризует низкую аллергенность и высокую диффузионную способность препарата. Из системных реакций у вакцинированных беременных регистрировались: слабость, головокружение, головные боли (у 7 женщин в первые 5–7 дней после вакцинации). Аналогичная частота симптомов недомогания фиксировалась и во 2-й группе наблюдения (у 5 невакцинированных женщин).
В более отдаленные сроки (с 10 по 30 дни) отмечались боли в животе, неустойчивость стула, слабость и недомогание у половины наблюдаемых с одинаковой частотой в обеих группах сравнения. На 35–44 дни после вакцинации 6 беременных были госпитализированы в специализированные отделения по причине угрозы невынашивания с последующим сохранением беременности и дальнейшим наблюдением. Очевидно, что такое течение беременности невозможно связать с проведенной вакцинацией, поскольку при их предыдущей беременности также отмечалась угроза невынашивания.
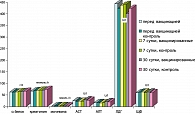
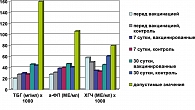
Анализ лабораторных данных показал, что уровень основных биохимических маркеров (ЛДГ, ЩФ, АСТ, АЛТ, креатинин, мочевина, общий белок) не имел каких-либо отличий от исходных значений в динамике на 7 и 30-е сутки после вакцинации (р>0,5). Здесь хорошо просматривается высокая идентичность основных показателей метаболического гомеостаза (рисунок 1). Аналогично выглядели и значения лейкоформулы, без значимых различий у вакцинированных и невакцинированных беременных.
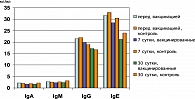
Содержание сывороточных иммуноглобулинов основных классов у вакцинированных беременных не отличалось от аналогичных показателей в группе непривитых беременных (рисунок 2), что характеризует отсутствие влияния вакцинации на напряженность общего гуморального иммунитета.
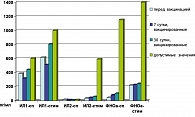
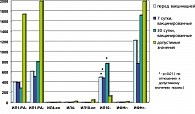
Изучение уровня цитокинов как в спонтанном, так и в стимулированном тестах также не показало существенных изменений у вакцинированных женщин по отношению к допустимым физиологическим параметрам. Не отмечено достоверных изменений в регуляции иммунного ответа, которые способны были бы вывести систему из стабильного состояния в провоспалительное или иммунодепрессивное направления (рисунки 3, 4).
Повышенный потенциал лейкоцитов к продукции ИЛ-10 в условиях митогенстимуляции (p<0,01) оценивается как один из факторов физиологического ограничения иммунной активности на фоне нормально протекающей беременности.
Скрининг-мониторинг развития плода показал отсутствие прямого тератогенного влияния вакцины в поствакцинальном периоде на физиологическое течение беременности (рисунок 5).
Таким образом, предварительный анализ клинической переносимости вакцины против пандемического гриппа штамма A/Калифорния/07/2009(H1N1)v МоноГриппол плюс у беременных по выраженности воздействия на общий метаболический и иммунологический гомеостаз женщин показывает сопоставимую с контрольной группой реактивность и демонстрирует высокую степень биологической и физиологической безопасности.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.