Результаты многоцентрового двойного слепого рандомизированного плацебо-контролируемого клинического исследования эффективности, безопасности и переносимости препарата Церетон при лечении когнитивных нарушений у детей
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Было рандомизировано 222 пациента. Все они были стратифицированы по возрасту (6–10 лет, 11–15 лет, 16–17 лет) по 74 пациента в страте. Внутри каждой страты проводилась рандомизация в соотношении 1:1 в группу исследуемого препарата Церетон и плацебо (по 37 пациентов в группе). Пациенты в возрасте 6–10 лет принимали препарат в виде раствора по 200 мг один раз в сутки до приема пищи, запивая водой, пациенты 11–15 лет – по одной капсуле (400 мг) утром и днем после еды в течение 60 дней, а пациенты в возрасте 16–17 лет – по две капсулы (800 мг) утром и одной капсуле (400 мг) днем после еды.
Результаты. Продемонстрирована более высокая эффективность Церетона по сравнению с плацебо в улучшении когнитивных функций (памяти и интеллекта), а также клинического состояния в целом у детей с последствиями ЧМТ и геморрагического инсульта. При этом в группе пациентов, получавших Церетон, не зарегистрировано нежелательных явлений, что свидетельствует о высокой безопасности препарата.
Заключение. Препарат Церетон высокоэффективен у пациентов в возрасте 6–17 лет с когнитивными нарушениями, а также в лечении клинико-неврологических проявлений в восстановительном периоде ЧМТ и геморрагического инсульта.
Материал и методы. Было рандомизировано 222 пациента. Все они были стратифицированы по возрасту (6–10 лет, 11–15 лет, 16–17 лет) по 74 пациента в страте. Внутри каждой страты проводилась рандомизация в соотношении 1:1 в группу исследуемого препарата Церетон и плацебо (по 37 пациентов в группе). Пациенты в возрасте 6–10 лет принимали препарат в виде раствора по 200 мг один раз в сутки до приема пищи, запивая водой, пациенты 11–15 лет – по одной капсуле (400 мг) утром и днем после еды в течение 60 дней, а пациенты в возрасте 16–17 лет – по две капсулы (800 мг) утром и одной капсуле (400 мг) днем после еды.
Результаты. Продемонстрирована более высокая эффективность Церетона по сравнению с плацебо в улучшении когнитивных функций (памяти и интеллекта), а также клинического состояния в целом у детей с последствиями ЧМТ и геморрагического инсульта. При этом в группе пациентов, получавших Церетон, не зарегистрировано нежелательных явлений, что свидетельствует о высокой безопасности препарата.
Заключение. Препарат Церетон высокоэффективен у пациентов в возрасте 6–17 лет с когнитивными нарушениями, а также в лечении клинико-неврологических проявлений в восстановительном периоде ЧМТ и геморрагического инсульта.




По данным Росстата (2021), в России зарегистрировано свыше 900 тыс. пациентов детского и подросткового возраста с заболеваниями нервной системы и психическими расстройствами, в том числе около 170 тыс. детей-инвалидов по нарушениям когнитивных функций, что составляет треть от общего количества детей-инвалидов, обусловливает актуальность и социальную значимость проблемы [1–3]. Особое значение приобретают комплексная диагностика, фармакотерапия и реабилитация когнитивных нарушений у детей после черепно-мозговой травмы (ЧМТ) и инсульта ввиду неуклонного увеличения заболеваемости и тяжести функциональных ограничений [4–6]. Например, травмы головы ежегодно отмечаются более чем у 1,2 млн детей, а рост количества впервые зарегистрированных случаев травмы в детском возрасте за последние 15 лет превысил 50% [1, 7].
Важную роль в комплексной терапии последствий ЧМТ и инсульта у детей играет использование нейропротективных препаратов с ноотропной, нейротрофической и нейромедиаторной активностью [2, 3, 5–9]. Национальные клинические рекомендации по диагностике и лечению ЧМТ предусматривают применение у детей в отдаленном периоде ЧМТ препаратов с ноотропным действием (уровень доказательности С): холина альфосцерата, кортексина, производных гопантеновой и аминофенилмасляной кислот, церебролизина, Актовегина, Магне В6 [10, 11]. В настоящее время Церетон является единственным препаратом холина альфосцерата, разрешенным к применению в отечественной педиатрической практике.
Церетон (ЗАО «ФармФирма „Сотекс“», Россия) содержит 40,5% метаболически защищенного холина и представляет собой нейрометаболическое, нейротрофическое, нейропротективное лекарственное средство, активирующее церебральную ацетилхолинергическую систему [12, 13]. Церетон легко проникает через гематоэнцефалический барьер, накапливается преимущественно в ткани головного мозга и метаболизируется с образованием двух основных действующих веществ – холина (предшественника ацетилхолина) и глицерофосфата (компонента мембран нейронов). Холин активирует синтез ацетилхолина в пресинаптических структурах (терминалях) холинергических нейронов центральной нервной системы, способствуя улучшению холинергической трансмиссии, и оказывает прямое положительное воздействие на когнитивные функции. Кроме того, холина альфосцерат стимулирует выделение ацетилхолина из пресинаптических терминалей в естественных условиях [12, 13]. Терапевтическая эффективность Церетона определяется также прямым влиянием на другие церебральные нейротрансмиттерные системы – норадренергическую и дофаминергическую. При этом альфа-адреноблокирующее действие препарата предположительно способствует улучшению кровотока и нормализации пространственно-временных характеристик спонтанной биоэлектрической активности мозга. Второй образующийся метаболит холина альфосцерата – глицерофосфат является предшественником фосфатидилхолина, входящего в состав фосфолипидов (гидрофобного слоя) нейрональных мембран, и способствует нейропротекции и активации церебральных репаративных процессов. Помимо этого холина альфосцерат непосредственно связан с синтезом гормона роста, чем обусловлено его эффективное нейротрофическое действие [12–14]. Препарат характеризуется хорошей переносимостью, высоким профилем безопасности, выводится преимущественно через легкие в виде диоксида углерода (85%), а также через почки и кишечник (15%) [12].
Таким образом, Церетон характеризуется разнообразным спектром положительного комплексного действия, способствует восстановлению нейротрансмиссии (как универсальный донор холина и за счет стимуляции высвобождения ацетилхолина из пресинаптических терминалей), а также активации процессов нейропластичности (с восстановлением поврежденных мембран, увеличением числа холинергических нейронов, секреции нейротрофических факторов и рецепторов к ним, стимуляции аксонального спраутинга, восстановлением роста и ветвления дендритных отростков, усилением роста дендритных шипиков). Это определяет его широкое успешное применение в клинической неврологической практике [12–15].
В серии клинических исследований показан положительный эффект Церетона в отношении когнитивных и других неврологических нарушений при остром нарушении мозгового кровообращения (как при ишемическом, так и при геморрагическом инсульте), хронической недостаточности мозгового кровообращения, болезни Альцгеймера, рассеянном склерозе, ЧМТ [14–19].
Имеются многочисленные данные об эффективности холина альфосцерата у взрослых пациентов с ЧМТ в остром периоде, а также при лечении ее последствий [20–23].
По мнению большинства исследователей, основными патогенетическими механизмами положительного действия холина альфосцерата при ЧМТ являются повышение холинергической активности в церебральных структурах за счет усиления синтеза ацетилхолина, положительное влияние на фосфолипидный состав мембран нейронов фосфатидилхолина, а также улучшение церебральной перфузии, стабилизация тормозящих и активирующих влияний ретикулярной формации [20, 23].
Как показали результаты ряда исследований, даже после легкой ЧМТ могут длительное время сохраняться (не только в остром, но также подостром и хроническом периодах) структурные и функциональные нарушения, выявляемые при использовании методов функциональной нейровизуализации (магнитно-резонансная томография (МРТ), протоколы SPECT, DTI, функциональная МРТ, PET). При этом изменения обычно обнаруживаются в лобной и височной коре, мозолистом теле и подкорковых структурах, включая внутреннюю капсулу, таламус и мозжечок, что указывает на необходимость применения в комплексном лечении препаратов холина альфосцерата, стимулирующих процессы нейропластичности [23, 25].
В многочисленных работах также продемонстрировано развитие у пациентов с ЧМТ комплекса нарушений работы нейротрансмиттерных систем, что является возможной точкой приложения для восстановительных мероприятий [22, 24, 26]. Как известно, в патогенезе посттравматических когнитивных расстройств важнейшую роль играют холинергические системы мозга, поскольку холинергическая медиация лобной коры и гиппокапма у здоровых людей обеспечивает процессы внимания и памяти. Причем через мускариновые рецепторы, ассоциированные с G-протеином, ацетилхолин может обеспечивать как возбуждающий, так и тормозной эффект, а через ионотропные никотиновые рецепторы – возбуждающее действие [22, 24].
После ЧМТ отмечается быстрое высвобождение ацетилхолина с повышением его внеклеточной концентрации с последующим подавлением активности холинергических систем [25].
Согласно экспериментальным данным, связывание рецепторов и плотность транспортера ацетилхолина уменьшаются уже через час после травмы, сохраняясь в гипофункциональном состоянии длительное время (год и более). При этом наблюдается преимущественное поражение холинергических путей (от базального переднего мозга к корковым отделам), сохранность которых имеет важнейшее значение для восстановления когнитивных функций [25–31]. Предполагается также, что корковые проекции от базальных отделов мозга особенно чувствительны к накоплению нейрофибриллярных клубочков и тау-протеинзависимой агрегации, что может приводить к холинергической недостаточности после ЧМТ [25, 26]. При ЧМТ нередко имеют место структурные разрушения септогиппокампальных путей базального переднего мозга и утрата холинергических нейронов переднего мозга [25, 26].
В последние годы выявлено, что при ЧМТ у детей образуются аутоантитела к альфа-7-субъединицам нейронального ацетилхолинового рецептора, выполняющие функцию блокаторов рецептора ацетилхолина [32].
Таким образом, ввиду значительных изменений холинергической системы после ЧМТ для восстановления когнитивных функций патогенетически обосновано применение холина альфосцерата (Церетона), нормализующего работу нейротрансмиттерных систем и обеспечивающих коррекцию холинергической передачи, а также обладающего нейротрофическими свойствами, обеспечивающими восстановление нейронных сетей и улучшение проведения нервного импульса в синапсах [20–24].
Исследования, демонстрирующие эффективность холина альфосцерата (препарата Церетон) у пациентов детского возраста, немногочисленны [33–36]. С учетом терапевтического потенциала и удовлетворительного профиля безопасности препарата перспективно проведение клинических исследований его эффективности и безопасности в детском возрасте, основанных на современных принципах доказательной медицины.
Цель – оценить эффективность, безопасность и переносимость препарата Церетон (ЗАО «ФармФирма „Сотекс“», Россия) в форме капсул и раствора для приема внутрь у детей в возрасте 6–17 лет с когнитивными нарушениями легкой и средней степени тяжести в восстановительном периоде ЧМТ или геморрагического инсульта.
Материал и методы
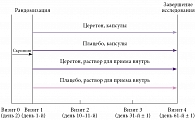
В 11 российских исследовательских центрах в 2019–2021 гг. было проведено двойное слепое рандомизированное плацебо-контролируемое клиническое исследование эффективности, безопасности и переносимости препарата Церетон при лечении когнитивных нарушений у детей в возрасте 6–17 лет в восстановительном периоде ЧМТ и геморрагического инсульта.
В исследовании участвовали 222 ребенка обоего пола. Исследование соответствовало всем положениям Хельсинкской декларации. Все пациенты и/или их родители подписали информированное согласие на участие в исследовании. Демографические и другие исходные характеристики пациентов (возраст, пол, длительность заболевания, предшествующие и сопутствующие заболевания, предшествующая и сопутствующая терапия) сравнивались между группами для демонстрации сопоставимости групп на исходном уровне.
Было рандомизировано 222 пациента. Все пациенты были стратифицированы по возрасту (6–10 лет, 11–15 лет, 16–17 лет) по 74 пациента в страте. Внутри каждой страты проводилась рандомизация в соотношении 1:1 в группу исследуемого препарата Церетон и плацебо (по 37 пациентов в группе). ITT-популяция включала 222 пациента, PP-популяция – 218 пациентов (четыре пациента прекратили участие в исследовании по желанию родителей).
Пациенты в возрасте 6–10 лет (n = 37) принимали препарат в виде раствора по 200 мг один раз в сутки до приема пищи, запивая водой, пациенты 11–15 лет (n = 37) – по одной капсуле (400 мг) утром и днем после еды в течение 60 дней, пациенты в возрасте 16–17 лет (n = 37) – по две капсулы (800 мг) утром и одной капсуле (400 мг) днем после еды (таблица). Курс лечения составил 60 дней.
На протяжении исследования пациенты могли использовать другие не запрещенные протоколом лекарственные средства, помимо исследуемых, для лечения сопутствующей патологии, которые они принимали до включения в исследование или были назначены врачом-исследователем в ходе исследования. Среди участников исследования были пациенты с сопутствующими заболеваниями, такими как миопия (n = 4), хронический гастрит (n = 2), хронический тонзиллит (n = 9).
Критерии включения в исследование:
- наличие подписанной формы информированного согласия информационного листка пациента (для родителя/усыновителя и пациента);
- возраст дети обоего пола – 6–17 лет включительно;
- индекс массы тела (ИМТ) в диапазоне, соответствующем возрасту и полу ребенка;
- ранний восстановительный период ЧМТ или геморрагического инсульта (период с 22-го дня до шести месяцев от события);
- постгеморрагические или посттравматические когнитивные нарушения легкой и средней степени тяжести;
- показатель IQ 70–109 баллов на основании теста Векслера, соответствующего возрасту пациента (для детей 6–15 лет – WISC и для детей 16–17 лет – WAIS);
- результаты МРТ, КТ головного мозга, подтверждавшие анамнестические сведения об особенностях этиологии и патогенеза когнитивных нарушений;
- для пациентов 14–17 лет включительно согласие на использование барьерных методов контрацепции на протяжении всего исследования и в течение трех недель после его окончания.
Критерии исключения:
- повышенная чувствительность к компонентам препарата;
- непереносимость или дефицит лактазы, глюкозо-галактозная мальабсорбция, врожденная галактоземия;
- тяжелые когнитивные нарушения (умственная отсталость, олигофрения и деменция) в анамнезе;
- данные о предыдущей тяжелой ЧМТ, тяжелых последствиях травм и заболеваний нервной системы, нейрохирургической патологии, тяжелых психиатрических заболеваниях в анамнезе;
- когнитивные нарушения, зафиксированные до текущей ЧМТ/геморрагического инсульта;
- врожденные пороки развития головного мозга (шизэнцефалия, лизэнцефалия, пахигирия, фокальная корковая дисплазия и т.д.);
- генетические заболевания и хромосомные аномалии;
- перинатальная патология центральной нервной системы;
- тяжелые, декомпенсированные или нестабильные соматические заболевания.
Пациенты обследовались до лечения, на 10–11-й день лечения, а также после одно- и двухмесячного курса терапии (рис. 1).
Статистическая обработка полученных данных проводилась с использованием статистического пакета Tibco STATISTICA v.13.
Критерии оценки эффективности. Первичный критерий оценки эффективности терапии был основан на результатах теста Векслера:
- WISC (для детей 6–15 лет);
- WAIS (для детей 16–17 лет).
Первичной конечной точкой служила оценка величины эффекта, рассчитанная по тесту Векслера к визиту 4 (60-й день терапии). За величину эффекта принималось значение d по Коэну, рассчитанное на основании данных визитов 0 и 4 в каждой группе.
В соответствии с протоколом исследования, доказательством гипотезы превосходства терапии препаратом Церетон являлось установление статистически значимого различия между группами Церетона и плацебо по среднему значению величины эффекта (по возрастным подгруппам). За величину эффекта принималось значение d по Коэну, рассчитанное на основании данных до и после лечения в каждой группе.
Вторичные конечные точки:
- оценка показателя IQ по тесту Векслера к визиту 4 (130 баллов и выше – очень высокий IQ, 120–129 баллов – высокий, 110–119 баллов – хорошая норма, 90–109 баллов – средний IQ, 80–89 баллов – плохая норма, 70–79 баллов – пограничная зона, 69 баллов и ниже – умственный дефект);
- оценка сумм вербальных и невербальных показателей (шкальные оценки) по тесту Векслера к визиту 4;
- динамика показателей нейропсихологического тестирования на запоминание десяти слов;
- динамика оценки врачом эффективности терапии по пятибалльной шкале (1 – отсутствие клинических симптомов, 2 – регресс основных клинических симптомов, 3 – уменьшение выраженности клинических симптомов, 4 – отсутствие положительной динамики клинических симптомов, 5 – усиление клинической симптоматики);
- динамика показателей клинического состояния по шкале CGI-C (0 – не оценивалось, 1 – состояние пациента значительно улучшилось, 2 – состояние пациента заметно улучшилось, 3 – состояние пациента улучшилось минимально, 4 – состояние пациента осталось без изменений, 5 – состояние пациента минимально ухудшилось, 6 – состояние пациента заметно ухудшилось, 7 – состояние пациента значительно ухудшилось).
Критерии оценки безопасности:
- общее количество нежелательных явлений (НЯ), стратифицированных по тяжести и частоте;
- частота НЯ, связанных с применением исследуемого препарата/плацебо;
- частота серьезных НЯ, связанных с применением исследуемого препарата/плацебо;
- количество пациентов, у которых зарегистрировано как минимум одно НЯ;
- количество пациентов, прервавших лечение из-за развития НЯ;
- количество пациентов с хорошей, удовлетворительной, неудовлетворительной переносимостью исследуемого препарата/плацебо.
Переносимость оценивали на основании частоты НЯ, связанных с применением исследуемого препарата/плацебо:
- хорошая – отсутствие НЯ;
- удовлетворительная – наличие НЯ, не потребовавших медикаментозной коррекции состояния;
- неудовлетворительная – наличие НЯ, потребовавших медикаментозного лечения.
Результаты
Анализ эффективности по первичной конечной точке
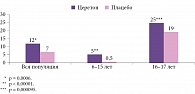
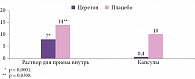
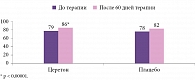
Анализ эффективности по первичной конечной точке (PP-population) продемонстрировал достоверное различие по величине эффекта (d по Коэну) между группами препарата Церетон и плацебо в возрастных подгруппах (рис. 2). Показано также достоверное различие по величине эффекта (d по Коэну) между группами препарата Церетон и плацебо в подгруппах по лекарственной форме (рис. 3).
Оценка общего показателя IQ по тесту Векслера
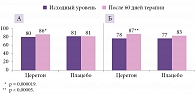
Оценка общего показателя IQ по тесту Векслера выявила статистически значимые различия между группами Церетона и плацебо по итогам терапии как для всей популяции (рис. 4), так и по возрастным стратам (лекарственным формам) (рис. 5).
При анализе данных для всей популяции пациентов в результате применения препарата Церетон установлено достоверное повышение среднего вербального показателя IQ с 82 до 88 баллов, невербального показателя IQ – с 79 до 87 баллов (p = 0,00002), общего показателя IQ – с 79 до 86 баллов. При сравнительном анализе баллов вербального, невербального и общего показателя IQ зарегистрированы статистически значимые различия между группами препарата Церетон и плацебо по окончании курса лечения (p = 0,000001, p = 0,00002, p < 0,00001 соответственно).
Анализ данных пациентов, принимавших исследуемый препарат/плацебо в форме раствора, продемонстрировал повышение среднего значения вербального показателя IQ с 84 до 88 баллов, невербального показателя IQ – с 81 до 86 баллов, общего показателя IQ – с 80 до 86 баллов. В ходе сравнительного анализа баллов вербального, невербального и общего показателя IQ выявлены статистически значимые различия между группами препарата Церетон и плацебо по окончании курса лечения (p = 0,0016, p = 0,0003, p = 0,0001 соответственно).
Результаты анализа данных пациентов, принимавших исследуемый препарат/плацебо в форме капсул, свидетельствуют о повышении среднего значения вербального показателя IQ с 81 до 88 баллов, невербального показателя IQ – с 79 до 88 баллов, общего показателя IQ – с 78 до 87 баллов. При сравнительном анализе баллов вербального, невербального и общего показателя IQ зафиксированы статистически значимые различия между группами препарата Церетон и плацебо (p = 0,00001, p = 0,0043, p = 0,00005 соответственно).
Оценка общего балла вербальных и невербальных показателей по тесту Векслера
При оценке общего балла вербальных и невербальных показателей теста Векслера получены статистически значимые различия показателей в группах препарата Церетон и плацебо по итогам терапии как для всей обследуемой популяции (рис. 6), так и для отдельных возрастных групп (рис. 7).
При анализе данных всей популяции отмечалось повышение среднего значения суммы вербальных оценок по тесту Векслера в группе препарата Церетон с 35 до 41 балла, суммы невербальных оценок – с 34 до 40 баллов, общей суммы оценок – с 70 до 82 баллов. В результате сравнительного анализа сумм вербальных, невербальных оценок и общей суммы оценок по тесту Векслера получены статистически значимые различия между группами препарата Церетон и плацебо по окончании курса лечения (p < 0,0001, p = 0,000002, p < 0,0001 соответственно).
Анализ результатов данных возрастной подгруппы пациентов 6–10 лет продемонстрировал повышение средней суммы вербальных оценок теста Векслера в группе препарата Церетон с 37 до 40 баллов, суммы невербальных оценок – с 36 до 40 баллов, общей суммы оценок – с 73 до 80 баллов. При сравнительном анализе сумм вербальных, невербальных оценок и общей суммы оценок теста Векслера установлены статистически значимые различия между группами препарата Церетон и плацебо по окончании курса лечения (p = 0,0018, p = 0,0004, p = 0,0001 соответственно).
Анализ результатов данных возрастной подгруппы 11–17 лет показал увеличение средней суммы вербальных оценок теста Векслера с 34 до 42 баллов, суммы невербальных оценок – с 34 до 40 баллов, общей суммы оценок – с 68 до 82 баллов. В ходе сравнительного анализа сумм вербальных, невербальных оценок и общей суммы оценок по тесту Векслера зафиксированы статистически значимые различия между группами препарата Церетон и плацебо по окончании курса лечения (p = 0,00001, p = 0,0008, p = 0,00001 соответственно).
Нейропсихологическое тестирование на запоминание десяти слов
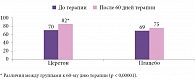
Статистический анализ динамики показателей нейропсихологического теста на запоминание десяти слов обнаружил значимые различия между показателями до и после лечения в группе терапии Церетоном, а также между группами Церетона и плацебо по итогам лечения во всех возрастных стратах (рис. 8), что свидетельствовало об улучшении памяти после применения Церетона.
Оценка врачом эффективности терапии по пятибалльной шкале и динамики показателей клинического состояния по шкале CGI-C
При оценке врачом эффективности терапии по пятибалльной шкале установлены статистически значимые различия (p < 0,00001) между группами Церетона и плацебо по всем возрастным стратам на визитах 2–4, что свидетельствовало о положительной клинической динамике уже с 11-го дня терапии Церетоном (рис. 9).
При анализе динамики показателей клинического состояния по шкале CGI-C получены статистически значимые различия (p < 0,00001) между группами Церетона и плацебо на визитах 2–4 по всем возрастным стратам, что подтверждает отчетливую положительную клиническую динамику уже с 11-го дня лечения Церетоном (рис. 10).
Безопасность и переносимость препарата Церетон у детей 6–17 лет
В ходе исследования всего у 6 (2,7%) пациентов из 222 зарегистрированы НЯ легкой степени.
Причинно-следственную связь с терапией исследуемым препаратом/плацебо врачи-исследователи оценили как несвязанную у 4 (в 66,67%) пациентов с вирусной инфекцией, диареей и как сомнительную у 2 (33,33%) пациентов с головной болью. Анализ частоты исходов НЯ показал выздоровление/прекращение НЯ в 100% случаев. При сравнительном анализе НЯ по тяжести, причинно-следственной связи с терапией и исходу не выявлено межгрупповых различий. Не зарегистрировано случаев серьезных НЯ, в том числе летальных исходов и других значимых НЯ.
Заключение
Результаты проведенного многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования продемонстрировали высокую эффективность при лечении когнитивных нарушений и клинико-неврологических проявлений в восстановительном периоде ЧМТ и геморрагического инсульта у пациентов в возрасте от 6 до 17 лет. Доказана превосходящая результативность Церетона по сравнению с плацебо в улучшении когнитивных функций (памяти и интеллекта), а также клинического состояния в целом у детей с последствиями ЧМТ и геморрагического инсульта. В группе пациентов, принимавших Церетон, не зарегистрировано нежелательных явлений. Установлен сопоставимый характер профилей безопасности препарата Церетон и плацебо.
Таким образом, результаты клинического исследования свидетельствуют о высокой эффективности, безопасности и переносимости препарата Церетон при лечении детей и подростков в возрасте от 6 до 17 лет.
D.D. Gainetdinova, PhD, Prof., O.V. Agranovich, PhD, Prof., S.A. Nemkova, PhD, Prof., N.N. Maslova, O.V. Khaletskaya, O.V. Kurushina, PhD, Prof., N.M. Khasanova, PhD, E.Sh. Sagutdinova, N.B. Balcerovich, S.V. Teplykh, O.A. Perminova
Kazan State Medical University
Stavropol State Medical University
N.I. Pirogov Russian National Research Medical University
Smolensk State Medical University
Volga State Medical University
Volgograd State Medical University
Arkhangelsk Regional Clinical Hospital
Multidisciplinary clinical medical center ‘Bonum’, Yekaterinburg
Children's City Polyclinic № 45 Nevsky District, St. Petersburg
Professorial Clinic LLC, Perm
City Children's Clinical Polyclinic № 5, Perm
Contact person: Svetlana A. Nemkova, nemkova-sa@yandex.ru
The aim is to evaluate the efficacy, safety and tolerability of the drug Cereton in the form of capsules and oral solution in children aged 6–17 years with mild and moderate cognitive impairment in the recovery period of traumatic brain injury (TBI) or hemorrhagic stroke.
Material and methods. 222 patients were randomized. All of them were stratified by age (6–10 years old, 11–15 years old, 16–17 years old) for 74 patients in the stratum. Within each stratum, randomization was carried out in a 1:1 ratio into the group of the studied drug Cereton and placebo (37 patients per group). Patients aged 6–10 years took the drug in the form of a 200 mg solution once a day before meals, washed down with water, patients aged 11–15 years – one capsule (400 mg) in the morning and afternoon after meals for 60 days, and patients aged 16–17 years – two capsules (800 mg) in the morning and one capsule (400 mg) in the afternoon after meals.
Results. Cereton has been shown to be more effective than placebo in improving cognitive functions (memory and intelligence), as well as the clinical condition in general in children with the consequences of TBI and hemorrhagic stroke. At the same time, no adverse events were registered in the group of patients receiving Cereton, which indicates the high safety of the drug.
Conclusion. The drug Cereton is highly effective in patients aged 6–17 years with cognitive impairment, as well as in the treatment of clinical and neurological manifestations in the recovery period of TBI and hemorrhagic stroke.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.