Синдром пароксизмальной симпатической гиперактивности: современное состояние проблемы и собственное клиническое наблюдение
- Аннотация
- Статья
- Ссылки
- English

Синдром пароксизмальной симпатической гиперактивности: патогенез, симптомы, лечение
Неврологический синдром, в настоящее время именуемый синдромом пароксизмальной симпатической гиперактивности (СПСГ), впервые был описан в работе Уайлдера Грейвса Пенфилда, посвященной лечению 41-летней женщины с холестеатомой III желудочка в 1929 г. [1, 2]. В научных публикациях встречаются разные названия данного синдрома: центральная вегетативная дисрегуляция, синдром среднего мозга, синдром вегетативной дисфункции и др. [2, 3]. В нашей стране широкое распространение получил термин «диэнцефально-катаболический синдром», указывающий на патофизиологическую основу развития синдрома и сформулированный в 1950-х гг. в Ленинградском нейрохирургическом институте (ЛНХИ) им. проф. А.Л. Поленова [2, 3]. Современное название «пароксизмальная симпатическая активность» появилось в 2014 г., тогда же и было окончательно утверждено международным советом экспертов. В том же году СПСГ было дано определение синдрома, возникающего у больных после тяжелой приобретенной черепно-мозговой травмы (ЧМТ), характеризующейся пароксизмальным повышением симпатической (увеличением артериального давления (АД), частоты сердечных сокращений (ЧСС), частоты дыхательных движений (ЧДД), температуры, потоотделения) и двигательной активности [2, 4].
Частота пароксизмальной симпатической гиперактивности варьирует в диапазоне 8–33%, при этом половых или возрастных особенностей течения не прослеживается [3, 5].
Развитие СПСГ связано с множеством факторов, обусловливающих поражение головного мозга, в частности с субарахноидальным кровоизлиянием, ЧМТ, диффузным аксональным повреждением [6]. Статистически установлено, что риск развития пароксизмальной гиперактивности коррелирует с тяжестью ЧМТ. Более того, ЧМТ становится причиной СПСГ почти в 80% случаев [7]. Механизм развития СПСГ у детей схож с таковым у взрослых и связан с влиянием гипоксии на вещество головного мозга. Тем не менее есть основания считать, что СПСГ у детей протекает тяжелее, чем у взрослых, что, вероятно, обусловлено особенностями функционирования и формирования вегетативной нервной системы [8, 9]. Однозначной позиции в отношении механизмов развития СПСГ не выработано. Однако существует ряд версий, поддерживаемых мировым научным сообществом, так или иначе объясняющих патофизиологию развития СПСГ. Согласно одной из версий, имеет место развитие дезинтеграции ряда структур нервной системы, а именно снижение ингибирующего влияния корковых тормозных центров на гипоталамические, стволовые центры регуляции вегетативной нервной системы [10]. Гипоталамус, средний мозг, а также спинной мозг – основные структуры центральной нервной системы (ЦНС), участвующие в активации симпатической нервной системы (СНС). Нарушение тормозного воздействия вышележащих структур приводит к гиперактивации центров СНС и соответствующим клиническим проявлениям (inhibitory ratio model, EIR model) [10, 11]. В силу смещения баланса в отношении возбуждения/торможения даже минимальные афферентные стимулы могут вызывать гиперреакцию со стороны СНС [10–12]. Отечественная школа неврологии уделяет внимание структурам диэнцефалической системы, а именно нарушению биоэлектрической деятельности нейронов данных отделов [11]. Такая теория подразумевает изменение функциональной активности диэнцефальных структур в ответ на повреждающий фактор, а также возникновение продолжающихся после устранения патологического воздействия вегетативных реакций, проявляющихся рядом клинических симптомов (вазоконстрикцией, нарушением дыхания и т.д.) [11, 13].
В исследовании 2017 г. установлено, что дисфункция вегетативной нервной системы и сопутствующие ей эндокринные нарушения являются решающими факторами в патофизиологии СПСГ и приводят к нарушению энергетического баланса и изменению тонуса сосудов [14, 15]. Клиническая картина СПСГ складывается из многоформных вегетативных симптомов, таких как изменение ЧДД, ЧСС, гиперемия кожных покровов, центральная гипертермия, нарушение потоотделения, повышение АД, диффузное повышение мышечного тонуса.
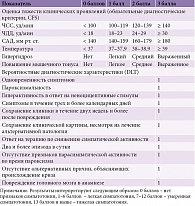
В 2017 г. была принята шкала оценки нарушений PSH-Assessment Measure (PSH-AM) [14, 16], содержащая две группы критериев для оценки наличия СПСГ. Первая группа подразумевает оценку тяжести клинических проявлений (Clinical Feature Scale, CFS), а именно шести ключевых симптомов: ЧСС, ЧДД, температуры, систолического АД (САД), мышечного тонуса и гипергидроза [2, 4]. Вторая группа включает оценку 11 вероятностных диагностических характеристик (Diagnostic Likelihood Tool, DLT) (табл. 1).
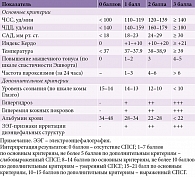
В 1950-х гг. в ЛНХИ им. проф. А.Л. Поленова были разработаны критерии диагностики и принципы лечения СПСГ (табл. 2) [2, 13].
Дифференциальная диагностика СПСГ достаточно сложна в силу необходимости проведения большого количества лабораторно-диагностических мероприятий для поиска иных этиологических причин развития симптомов. Речь, в частности, идет о гипертермии, дыхательных и сердечно-сосудистых нарушениях (табл. 3).
Кроме того, определение функции вегетативной нервной системы может быть основано на оценке вариабельности ритма сердца и рассматривается в данном случае как метод постоянного прикроватного мониторинга [17]. Измерение вариабельности ритма сердца (300-секундные интервалы), а также оценка чувствительности барорефлекса могут быть использованы в диагностике СПСГ. Терапия СПСГ основана на соблюдении общереанимационных мероприятий (нормоволемический статус, поддержание водно-электролитного баланса, нормогликемии, нормотермии, нутритивная поддержка). При возникновении СПСГ для купирования вегетативных нарушений используют бета-адреноблокаторы, бензодиазепиновые транквилизаторы, габапентин, клоназепам. При неэффективности препаратов первой линии рекомендуется переход на пролонгированное введение пропофола, опиоидов. В современных научных публикациях описан успешный опыт применения альфа‑2-адреноагонистов при СПСГ. Длительность терапии определяется индивидуально. В качестве профилактических мер рассматриваются раннее введение в лечебный наркоз и терапевтическая гипотермия, что способствует нейровегетативной стабилизации, формированию адекватного уровня нейрофункционирования, обеспечивает саногенетические предпосылки к компенсаторной и интегративной деятельности ЦНС.
Клинический случай
Пациент М., 19 лет, доставлен в клинику транспортом медицины катастроф. Обстоятельства травмы: 11 июля 2023 г. получил тяжелую сочетанную травму в результате дорожно-транспортного происшествия. Первая помощь, оказанная в районной больнице, включала интубацию трахеи, перевод на искусственную вентиляцию легких (ИВЛ), оперативное вмешательство по поводу стабилизации открытого перелома бедра аппаратом наружной фиксации. 17 июля для дальнейшего лечения переведен в ГБУЗ ТО «Областная клиническая больница № 2» (Тюмень) с диагнозом: политравма. Открытые оскольчатые переломы средней трети костей обеих голеней стадии IIБ со смещением. Открытый перелом костей левого голеностопного сустава. Закрытый оскольчатый перелом средне-верхней трети левой бедренной кости со смещением. Закрытая травма грудной клетки. Ушиб правого легкого. Закрытая ЧМТ. Ушиб головного мозга тяжелой степени тяжести. Отек головного мозга. Травматический шок 2–3-й степени.
Пациент госпитализирован в отделение реанимации под наблюдение мультидисциплинарной бригады. На вторые сутки в отделении реанимации зафиксированы три эпизода фокальных моторных эпилептических приступов. В течение последующих трех недель у пациента три-четыре раза в день регистрировались пароксизмы тахикардии, тахипноэ, гипертермии, повышенного потоотделения, повышения АД до 200/100 мм рт. ст. Лечебный наркоз проводился в течение девяти суток. При попытке выведения в диагностическое окно вновь отмечались симптомы СПСГ. На основании наблюдаемых клинических проявлений, а также данных, полученных в результате дополнительных методов исследования, возникло предположение о соответствии симптомов клинической картине СПСГ. В связи с этим была проведена оценка тяжести проявлений этого синдрома. Согласно шкале тяжести симпатотонии по PSH-AM, состояние пациента соответствовало тяжелым приступам симпатической гиперактивности (18 баллов). По шкале выраженности СПСГ, разработанной специалистами ЛНХИ им. проф. А.Л. Поленова, – выраженный СПСГ (17 баллов).
Неврологический статус: пациент лежит с открытыми глазами, на осмотр не реагирует. Общемозговая симптоматика: + (нарушение сознания). Глазные щели: D = S. Зрачки: D = S. Зрачковая реакция на свет: прямая, содружественная, сохраненная. Движения глазных яблок невозможно оценить, установлены центрально. Зрительные нарушения: невозможно оценить. Лицо: симметричное. Корнеальные рефлексы: D = S. Конъюнктивальный рефлекс: D = S. Язык: в полости рта, не показывает. Рефлексы орального автоматизма не вызываются. Тонус в руках повышен, тонус в ногах невозможно оценить из-за аппаратов наружной фиксации на левом бедре, левой и правой голенях. Оценка наличия парезов не представляется возможной. Рефлексы с рук вызываются, симметричны, средней живости, рефлексы с ног не оцениваются. Патологические двигательные феномены не вызываются. Менингеальных симптомов нет. У пациента приступообразно возникают пароксизмы тахикардии (до 200 уд/мин), гипертермии, потоотделения с генерализованными миоклониями до трех-четырех раз в сутки, миоклонии провоцируются пассивными движениями конечностей и болевыми стимулами. Мультиспиральная компьютерная томография головного мозга: в белом веществе больших гемисфер множественные гиподенсные очаги и сливные зоны. Аналогичные очаги определяются на уровне базальных ядер, таламусов, в мозолистом теле. Отмечается сглаженность кортико-медуллярного перехода в больших полушариях. Срединные структуры не смещены. Желудочковая система без признаков гидроцефалии и дислокации. Базальные цистерны не расширены, симметричны. Субарахноидальное пространство конвекситальной поверхности мозга, кортикальные борозды полушарий сглажены.
В ходе наблюдения и последующего дообследования диагноз был дополнен: ЧМТ. Ушиб головного мозга тяжелой степени. Стволовые миоклонии. Синдром Ланса – Адамса. СПСГ. Структурная эпилепсия с фокальными моторными гемикомпульсивными приступами с вторичной билатеральной генерализацией. Акинетический мутизм.
Ввиду тяжелой сочетанной патологии основная терапия была направлена на стабилизацию жизненно важных функций, раннюю реабилитацию. Особое внимание было уделено общереанимационным принципам, в том числе поддержанию стабильной гемодинамики, обеспечению пациента адекватной нутритивной поддержкой соразмерно потребностям организма, а также респираторной поддержке в виде ИВЛ, контролю температуры тела. Кроме того, на ранних этапах пациент был введен в наркоз для обеспечения возможности реализации адаптационных сил организма в целом и ЦНС в частности. Наркоз реализован комбинацией тиопентала натрия и опиоидного анальгетика (Промедол) в течение семи дней. Далее пациент получал симптоматическую и нейропротективную терапию, бета-блокаторы (метапролол) с целью поддержания референсных значений ЧСС, антагонисты рецепторов ангиотензина II (лозартан), а также ситуационно – диуретики (индапамид) с гипотензивной целью. С учетом развившейся структурной эпилепсии в схему лечения были введены вальпроевая кислота и карбамазепин. На фоне терапии в течение десяти дней удалось купировать клинические проявления СПСГ. Спустя два месяца пациенту назначили реабилитационные мероприятия на фоне выраженной положительной динамики в виде восстановления двигательных функций в связи с восстановлением костно-суставного аппарата, а также регресса неврологической симптоматики.
Заключение
Диагностика СПСГ достаточна сложна. Раннее выявление СПСГ ассоциируется с высокой информированностью врачей травматологических центров, а именно нейрохирургов, реаниматологов, травматологов, неврологов, о данной патологии. СПСГ осложняет течение основного заболевания, увеличивает риск инфекционных осложнений, развития полиорганной недостаточности, затрудняет мероприятия ранней реабилитации, тем самым потенцирует формирование остаточного неврологического дефицита и стойкой инвалидизации. В связи с этим изучение патогенеза, клинической картины и диагностики СПСГ остается важной мультидисциплинарной проблемой.
Yu.I. Doyan, PhD, I.A. Kiprin, O.A. Kicherova, PhD, D.A. Chertenko, T.V. Doyan
Tyumen State Medical University
Regional Clinical Hospital № 2, Tyumen
Contact person: Yuliya I. Doyan, yul-gol25@yandex.ru
Traumatic brain injury (TBI) remains one of the main problems in modern neurosurgery and neuroresuscitation. Among the working-age population, severe traumatic brain injury and combined trauma is one of the leading causes of persistent disability. Neurological symptoms, depending on the severity of TBI, vary from focal manifestations, such as central paresis, conduction disorders of sensitivity, disorders of higher cortical functions, to diffuse, such as the development of autonomic dysfunction, central respiratory and cardiovascular disorders, which often negatively affects the prognosis in this category of patients. One of the neurological syndromes complicating the acute period of severe TBI is the syndrome of paroxysmal sympathetic hyperactivity (SPSH). The main manifestations of SPSH are episodes of autonomic dysfunction with the development of tachycardia, arterial hypertension, tachypnea, hyperthermia, hyperemia of the skin, with an increase in the degree of depression of consciousness, increased muscle tone and sweating and irritation of the diencephalic structures on electroencephalography. Clinical manifestations are of the nature of a ‘vegetative storm’. Sympathetic paroxysms can develop from 1 to 15 times a day, with a duration of 10 to 30–40 minutes. The development of SPSH in the clinical picture of severe TBI increases the risk of infectious and hospital complications. Despite the vivid clinical picture, differential diagnostics of SPSH is a complex task due to the need to exclude a large number of comorbid pathologies. The issues of pathogenesis, diagnosis and treatment of SPSH remain unexplored. Assessment scales and algorithms for differential diagnostics of SPSH are being actively introduced into clinical practice, which is certainly of interest to doctors at neurotraumatology centers.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.