Круглогодичный аллергический ринит – «простой» насморк?
- Аннотация
- Статья
- Ссылки

Аллергический ринит – воспаление слизистой оболочки носа, обусловленное иммуноглобулин-Е-(IgE)-опосредованной реакцией повышенной чувствительности, развивающейся в результате попадания аллергенов на слизистую оболочку полости носа, и проявляющееся четырьмя основными симптомами: зудом, чиханием, выделениями из полости носа, затруднением носового дыхания [1]. Назальные симптомы, беспокоящие пациентов, в большинстве случаев тривиальны, но тем не менее могут приводить к значительному снижению качества жизни пациентов и членов их семей, оказывая негативное влияние на работоспособность, академическую успеваемость и социальную активность больных. Потеря трудоспособности, визиты к врачу и постоянная фармакотерапия АР формируют значительные прямые и косвенные экономические затраты как для системы здравоохранения, так и для общества в целом [2, 3].
АР занимает одно из первых мест в общей структуре аллергических заболеваний. За последние 2 десятилетия распространенность заболевания по всему миру увеличилась с 6 до 18% [4, 5]. По данным российских авторов, аллергическим ринитом в разных регионах Российской Федерации страдают 12,7–24% общей популяции, при этом отмечается ежегодный рост заболевания; пик АР приходится на молодой возраст [6, 4, 7]. Однако истинная распространенность аллергического ринита может быть гораздо выше: с одной стороны, это связано с тем, что не все пациенты с этим заболеванием обращаются за врачебной помощью, с другой стороны, врачи не всегда могут поставить верный диагноз. Существует несколько теорий, объясняющих увеличение роста распространенности аллергии в развитых странах [6]. Результаты ряда популяционных исследований свидетельствуют о том, что частота заболеваний аллергией увеличивается по мере индустриализации стран. Высказываются предположения, что загрязнение окружающей среды вызывает усиление IgE-опосредованного аллергического ответа, возможно, действуя как адъювант. Так называемая гигиеническая гипотеза, признаваемая и поддерживаемая все большим числом аллергологов, в настоящее время является альтернативной вышеизложенной теории. Согласно этой гипотезе, ранний контакт ребенка с микроорганизмами, находящимися в пище и воздухе, ведет к снижению частоты аллергии. Теория основана на эффекте микробной экспозиции нижних дыхательных путей у новорожденных в периоде младенчества (до года) и учитывает так называемый западный образ жизни в качестве фактора, провоцирующего развитие аллергического заболевания. При этом иммунологический механизм, «запускающий» аллергическое заболевание, не совсем ясен. Молекулярным механизмом, лежащим в основе гипотезы «гигиены», считают нарушение баланса между подтипами Т-хелперных клеток: Th1 и Th2. Именно соотношение Th1- и Th2-клеток влияет на чувствительность человека к аллергенам. В процессе иммунного ответа происходят синтез и высвобождение цитокинов из Th1-лимфоцитов, отвечающих на бактериальные или вирусные инфекции, или Th2-лимфоцитов, реагирующих на аллергены окружающей среды. Снижение контакта с инфекциями приводит к изменению баланса между подтипами Th-клеток в сторону Th2-лимфоцитов, что повышает восприимчивость к аллергенам. Сдвиг субпопуляции T-хелперных клеток в сторону преобладания Тh1, по всей видимости, связан со сниженной продукцией цитокинов, ответственных за врожденный иммунитет, стимулируемый бактериальными составляющими через систему толл-подобных рецепторов (toll-like receptor, TLR) (иммунная девиационная теория). Согласно другой теории (снижения иммунитета – супрессивная теория), экспозиция инфекционными аллергенами нижних дыхательных путей приводит к снижению активности регуляторных Т-клеток. Обе теории являются объектами изучения на современном этапе развития медицины [7, 5].
В последней версии международного европейского консенсуса по лечению АР предлагается выделить три формы ринита: сезонный (САР), круглогодичный (КАР) и профессиональный. Термин «профессиональный ринит» не имеет пока четкой дефиниции и не всегда опосредован IgE-аллергической реакцией. В 2001 г. эта классификация была пересмотрена в программе Всемирной организации здравоохранения (ВОЗ) ARIA (Allergic Rhinitis and its Impact on Asthma – Аллергический ринит и его влияние на бронхиальную астму) [1, 8]. Таким образом, предложено подразделять АР по продолжительности симптомов на персистирующий и интермиттирующий. Наличие симптомов АР менее 4 дней в неделю или менее 4 недель в году свидетельствует об интермиттирующей форме АР. Если симптомы АР присутствуют более 4 дней в неделю и более 4 недель в году, говорят о персистирующей форме АР. В основе определения степени тяжести АР лежит оценка влияния заболевания на качество жизни (сон, работоспособность, способность к учебе, занятия спортом и активным отдыхом) [1, 8, 3].
Самыми часто встречающимися сопутствующими АР заболеваниями являются астма и атопический дерматит. 40–50% пациентов с АР страдают от астмы и более 90% астматиков имеют ринит. Согласно международному документу ВОЗ GLORIA (2004) (Global Resources in Allergy), более чем у 50% детей и взрослых, страдающих АР, выявлены сопутствующие заболевания: синуситы, средние отиты, а у 42% пациентов имеются симптомы аллергического конъюнктивита, который особенно характерен для САР. Безусловно, при длительно персистирующих симптомах АР процент осложнений, возникающих у пациентов, выше. Именно данная категория пациентов чаще всего имеет сочетанную патологию: бронхиальную астму и аллергический ринит [5, 9]. Тяжелые и зачастую не диагностированные формы аллергического ринита приводят к ухудшению течения бронхиальной астмы, обусловливая ее неконтролируемое течение. Длительная персистенция симптомов АР характерна для КАР. Симптомы заболевания, доставляющие больному постоянное беспокойство, снижающие качество жизни и требующие длительного приема лекарственных препаратов, приводят к тому, что КАР относят к тяжелым формам аллергического ринита. К сожалению, зачастую лечение КАР осложняется ошибками при диагностике [9]. В связи с вышеизложенным в данной статье мы бы хотели рассмотреть именно подходы к лечению и диагностике данной формы заболевания.
Этиологические факторы КАР
Круглогодичный аллергический ринит (КАР) обусловлен воздействием ингаляционных аллергенов жилища, таких как клещи домашней пыли и аллергены домашних животных, тараканов и др.
Домашняя пыль состоит из многих органических и неорганических компонентов, включающих волокна, споры плесени, продукты жизнедеятельности (фекалии) клещей и других насекомых, перхоть и слюну млекопитающих. Основной аллергенной частью домашней пыли как сложного многокомпонентного аллергена являются клещи, которые чаще всего становятся причиной КАР. Аллергены домашнего клеща присутствуют во всех частях тела клеща, секрете и продуктах жизнедеятельности. В домашней пыли преобладают представители клещей семейства Pyroglyphidae, доминирующим видом которого в Европе и России является Dermatophagoides pteronyssinus, в Америке – Dermatofagoides farinae, что обусловлено разными климатическими условиями. На долю представителей других семейств приходится около 10% клещевой популяции. Концентрация клещей в воздухе зависит от сезона и географического положения страны.
Необходимо отметить, что в зависимости от их локализации аллергены домашнего клеща подразделяются на две группы:
1) содержащиеся преимущественно в фекалиях домашнего клеща;
2) локализующиеся в основном в теле клеща (в меньшей степени в фекалиях) и имеющие меньшую аллергенность.
В домашней пыли преобладают аллергены 1-й группы и лишь небольшое количество аллергенов 2-й группы. Большое количество аллергенов домашнего клеща обладает протеолитической активностью, в связи с чем они могут иметь более легкий доступ к иммунокомпетентным клеткам. Распространенность аллергии к клещам домашней пыли в популяции составляет в странах с сухим климатом около 15%, а в странах с влажным климатом – 20–35% [10]. Установлено, что в домах пациентов, страдающих атопическими заболеваниями, клещи, их вызывающие, встречаются чаще, чем в жилищах здоровых людей. У лиц с генетической предрасположенностью к атопии фактором риска развития сенсибилизации является наличие более 1000 экземпляров клещей на 1 грамм пыли. У пациентов, страдающих КАР, сенсибилизация к внутрижилищным аллергенам повышает риск развития бронхиальной астмы в 4 раза, а наличие более 500 экземпляров на 1 грамм пыли уже провоцирует приступ бронхиальной астмы. Существуют убедительные доказательства, что при наличии генетической предрасположенности к развитию IgE-опосредованных аллергических реакций, именно факторы окружающей среды определяют возникновение аллергических заболеваний [5].
Часто возникновение КАР обусловлено аллергенами животных: кошек, собак, лошадей, грызунов. Они содержатся в их перхоти, слюне, моче, секретах сальных и перианальных желез и являются одними из самых сильнодействующих аллергенов. По данным ВОЗ, от 2 до 30% населения разных стран сенсибилизировано к аллергенам животных [8]. АР может быть одним из первых проявлений при данном виде аллергии.
В некоторых регионах мира, а также в социальных группах с низким уровнем жизни сенсибилизация к аллергену таракана бывает более распространенной, чем к домашней пыли, и в ряде случаев является причиной тяжелых приступов бронхиальной астмы. Основные аллергены содержатся в экскрементах и хитиновой оболочке насекомых [6, 7].
На сегодняшний день различные авторы уделяют много внимания грибковой аллергии как причине КАР [3, 9]. Плесневые и дрожжевые грибки бурно вегетируют во влажное и теплое время года. Для грибков Cladosporum, Alternaria и Stemphylium характерна сезонность проявлений аллергии, а для грибков Aspergillus и Penicillium выраженность симптомов АР достаточно постоянна в течение года. Однако не стоит забывать, что проявления симптомов САР в определенных климатических условиях также являются круглогодичными.
Несмотря на то что аллергены клещей домашней пыли, спор грибов и тараканов являются круглогодичными, их количество в воздухе зависит от времени года. В связи с этим течение КАР имеет волнообразный характер и сопровождается сезонными вспышками, которые могут быть обусловлены наличием полисенсибилизации как к бытовым, так и к пыльцевым аллергенам. При ведении пациентов также нужно учитывать, что клинические проявления аллергического ринита могут быть также спровоцированы воздействием неспецифических раздражителей (табачный дым, воздушные поллютанты, некоторые химические соединения). Аналогичный эффект оказывает воздействие холодного воздуха, сквозняков, резкие перепады температуры, что указывает на высокую неспецифическую гиперреактивность слизистой оболочки носа у больных АР. Интересен тот факт, что пары переработанного дизельного топлива являются также своеобразным стимулятором, который приводит к повышению общего IgE, то есть к его повышенной продукции, и тем самым стимулирует аллергическое воспаление, что в конечном итоге может приводить как к развитию АР, так и к усилению уже имеющихся его симптомов [6].
Патогенез и клиническая картина АР
Слизистая оболочка полости носа обладает механизмом, распознающим аллергены за счет фиксации аллергенспецифического IgE на его высокоаффинных рецепторах (Fc-эпсилон-рецепторы 1-го типа, Fc-эпсилон-R1) на тучных клетках. Дифференцированные
В-лимфоциты продуцируют IgE, а Т-клетки являются регуляторами их синтеза. Взаимодействие аллергена с IgE происходит на тучных клетках соединительной ткани и базофилах. В том случае когда на Fc-эпсилон-R1 тучных клеток фиксирован аллергенспецифический IgE, аллерген, соединяясь с этим антителом, перекрестно связывает между собой молекулы IgE и, соответственно, Fc-эпсилон (R1 в клеточной мембране), что является стартовым механизмом, запускающим активацию тучных клеток. Затем следует высвобождение в межклеточное пространство медиаторов воспаления, которые расширяют просвет сосудов, повышают сосудистую проницаемость, усиливают секрецию слизи бокаловидными клетками и слизистыми железами, стимулируют афферентные нервные волокна. Через несколько минут после начала данного процесса развивается ранний аллергический ответ (РАО), что клинически проявляется в виде отека и выделения назального секрета. Стимуляцию афферентных нервов запускает аксон-рефлекс и приводит к локальному высвобождению нейропептидов, вещества Р, брадикининов, способствующих дальнейшей активации и дегрануляции Т-клеток [6, 11].
Реакция поздней фазы аллергического воспаления развивается через несколько часов после контакта с аллергеном и ассоциирована с эозинофильным воспалением слизистой носа, эндотелиальной экспрессией и эпителиальной адгезией молекул, хемокинов и цитокинов. Высвобождение медиаторов из инфильтрирующих лейкоцитов, как и из резидентных клеток (тучных клеток), выражается в симптомах назальной обструкции и развития неспецифической назальной гиперреактивности. Лейкотриены, высвобождаемые тучными клетками, эозинофилами, базофилами, макрофагами, нейтрофилами и эпителиальными клетками, играют важную роль в поздней фазе аллергических реакций, влияя на назальную обструкцию, слизистую секрецию и клеточное вовлечение в процесс [11, 12].
При персистирующем аллергическом рините продолжающийся низкодозовый контакт с аллергеном индуцирует постоянное воспаление слизистой (минимальное персистирующее воспаление) с гиперэкспрессией молекулы внутриклеточной адгезии 1 типа (Inter-Cellular Adhesion Molecule 1, ICAM-1), которая представляет главный рецептор для риновирусов. Данное обстоятельство объясняет склонность больных к вирусным инфекциям и их роль в обострении АР, риск развития бронхиальной астмы при АР, а также неспецифическую гиперреактивность слизистой оболочки носа [12].
Воздействие на минимальное персистирующее воспаление является важнейшим механизмом лечения АР и других аллергических заболеваний, а также профилактики их обострений. Опубликованы данные, подтверждающие, что продолжительное лечение антигистаминными препаратами не только купирует симптомы АР, но и уменьшает уровень минимального персистирующего воспаления, экспрессии ICAM-1, а также неспецифическую гиперреактивность слизистой оболочки носа за счет общего противовоспалительного эффекта. Хорошие результаты могут быть достигнуты при применении антагонистов лейкотриеновых рецепторов, что особенно актуально у пациентов, имеющих сочетание аллергического ринита и бронхиальной астмы [10].
Воздействие более низких концентраций аллергенов приводит к меньшей выраженности симптомов круглогодичного АР по сравнению с сезонным, тем самым затрудняя постановку диагноза. Зачастую единственной жалобой, предъявляемой больным, является хроническая заложенность носа. Постоянная заложенность носа вынуждает пациентов дышать ртом, что приводит к храпу, ночным кошмарам, постоянному сопению, изменению голоса, сухости, раздражению слизистой оболочки и болям в горле, может приводить к гипо- и даже аносмии. Вследствие этого резко снижается качество жизни, физическая и умственная активность.
Типичной жалобой больных является приступообразное чихание в ранние утренние часы, сразу после пробуждения. Среди других симптомов круглогодичного АР обращают на себя внимание бесцветные выделения из носа, зуд в носу, глазах, ушах, горле, слезотечение, боли в проекции лобных пазух, снижение слуха, появление шума в ушах. Стекание назального секрета по задней стенке глотки раздражает слизистую, являясь причиной хронического подкашливания. Постоянная заложенность носа может привести к возникновению как острых, так и хронических риносинуситов. Данное состояние сопровождается ощущением заложенности, гипосмией, кашлем, иногда болью в области пазух, тяжестью и головной болью. Подобный же механизм лежит в основе евстахиитов с последующим вовлечением в процесс среднего уха. Назальный полипоз может быть следствием хронического воспаления слизистой носа. Полипы в основном выпадают из слизистой синусов в средний носовой проход, усиливая назальную блокаду, вызывая аносмию, болевой синдром, и ухудшают клиническое течение риносинуситов [2, 12].
Диагностика КАР
Диагноз АР базируется на тщательном сборе анамнеза, показателях объективного обследования (риноскопии, назального обследования) и, безусловно, данных специфического аллергологического обследования.
К возможным дополнительным диагностическим тестам относятся: фиброоптическая риноскопия, цитология назального секрета, назальный тест с аллергеном и риноманометрией, конверсионная радиография, КТ-сканирование. Мониторирование уровня общего IgE малоинформативно.
При диагностике и дифференциальной диагностике КАР может возникнуть ряд трудностей, например, в случае поливалентной сенсибилизации к бытовым и пыльцевым аллергенам. В установлении диагноза основным являются результаты диагностических проб или определения аллергенспецифического IgE в сыворотке крови. Наибольшую трудность представляет дифференциальная диагностика КАР и круглогодичных ринитов неаллергической природы. В частности, АР следует дифференцировать от инфекционных ринитов, а также от вазомоторного или круглогодичного неаллергического ринита. Вследствие неспецифической гиперреактивности слизистой оболочки носа у 5–10% населения воздействие холодного воздуха, сквозняков, резкие перепады температуры могут вызвать симптомы вазомоторного ринита. Десятая часть этих лиц предъявляет жалобы круглогодично, что делает необходимым прием симптоматических средств (в частности, деконгестантов), а это усугубляет течение заболевания. Частое применение сосудосуживающих капель приводит к утолщению, гипертрофии слизистой носа, в результате развивается медикаментозный ринит, схожий с симптомами КАР. В то же время следует учитывать, что пациенты с КАР, не подозревая об аллергической природе своего заболевания, часто годами злоупотребляют деконгестантами и в последующем имеют сочетание двух заболеваний – КАР и медикаментозного ринита.
Лечение КАР
Основной проблемой в лечении АР остается недооценка степени тяжести заболевания и, соответственно, назначение неадекватного объема фармакотерапии. Часто это приводит к нарушению доверия между врачом и пациентом, незаслуженной дискредитации препаратов, утяжелению течения заболевания и, как следствие, к развитию всевозможных осложнений. Задача лечебных мероприятий состоит в том, чтобы влияние АР на качество жизни и работоспособность пациента было, насколько это возможно, минимальным [2, 13].
В лечении КАР выделяют следующие направления:
- Элиминационные мероприятия.
- Аллергенспецифическая иммунотерапия.
- Обучение пациентов.
- Фармакотерапия.
Избегание контакта с причинно-значимым аллергеном представляет собой фундаментальный подход для предотвращения аллергических симптомов заболевания. Однако данная цель трудно достижима, хотя, безусловно, проведение элиминационных мероприятий может повлиять на тяжесть проявления симптомов и снизить потребность в фармакотерапии.
До начала лечения необходимо уточнить форму заболевания (легкая, средняя, тяжелая), а также эпизодичность появления симптомов. Критерии тяжести аллергического ринита достаточно четко сформулированы в рамках инициативы ARIA (2001–2011).
Аллергенспецифическая иммунотерапия (АСИТ) используется в клинической практике более 100 лет. АСИТ – метод введения возрастающих доз специфических аллергенов пациентам с доказанной IgE-опосредованной сенсибилизацией. АСИТ различными методами позволяет не только уменьшить клинические проявления заболевания и тем самым снизить потребность в лекарственных препаратах, но и остановить прогрессирующее течение заболевания. АСИТ имеет свои противопоказания: тяжелые иммунологические, серьезные сердечно-сосудистые заболевания, злокачественные опухоли, текущая терапия бета-блокаторами (даже в виде глазных капель), неконтролируемая бронхиальная астма (ОФВ1 после лечения меньше 70%). Кроме того, АСИТ не следует проводить беременным женщинам и пациентам с низким комплаенсом [6].
Принципы фармакологической терапии АР были сформулированы в рекомендациях ARIA (2010). Согласно этому документу, для использования при АР рекомендуются антигистаминные препараты 2-го поколения, топические антигистаминные средства, интраназальные глюкокортикостероиды (ГКС), топические кромоны (высокобезопасны, но эффект незначительный), антагонисты лейкотриеновых рецепторов, ипратропиума бромид, деконгестанты. При этом следует придерживаться принципа ступенчатой терапии и индивидуального подхода. При АР не рекомендуются антигистаминные препараты 1-го поколения для базисного приема в связи с седативным эффектом, негативным влиянием на когнитивные функции, астму и другие сопутствующие заболевания; системные ГКС (в/м, пролонгированные).
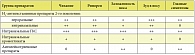
Руководствуясь так называемым ступенчатым подходом, врач должен назначать достаточный объем базисной терапии аллергического ринита, опираясь на знание механизма действия различных препаратов, применяемых при данном заболевании, и индивидуальные проявления симптомов у конкретного пациента [7, 8]. Учитывая, что основной жалобой пациентов с круглогодичным аллергическим ринитом является хроническая заложенность носа, терапия препаратами кромогликата или недокромила натрия, антилейкотриеновыми и антигистаминными препаратами 2-го поколения недостаточно эффективна. Препаратами выбора являются интраназальные ГКС (табл. 1) [10].
Интраназальные глюкокортикостероиды являются наиболее эффективными лекарственными средствами при АР. Молекулярные механизмы двухэтапной модели действия ГКС (геномный и внегеномные эффекты) лежат в основе их противоаллергического и противовоспалительного действия, заключающегося в одновременном влиянии на большинство клеток, вовлекаемых в аллергический процесс. Интраназальные ГКС тормозят активность всех клеток (эозинофилов, тучных клеток, лимфоцитов, дендритных, эпителиальных и эндотелиальных клеток), участвующих в развитии воспаления в полости носа. Эти препараты уменьшают ринорею, зуд, чихание, заложенность носа и глазные симптомы ринита. Последнее обусловлено торможением назо-окулярного рефлекса за счет выраженной локальной противовоспалительной активности интраназальных стероидов. Метаанализ последних исследований показал, что ГКС превосходят по эффективности антигистаминные препараты и антилейкотриеновые препараты в борьбе с такими симптомами АР, как заложенность носа, зуд, чихание, ринорея. Интраназальные ГКС могут быть использованы и в монотерапии, и в комбинации с пероральными антигистаминными препаратами. При регулярном и правильном использовании интраназальные ГКС эффективно уменьшают воспаление в слизистой оболочке носа и улучшают ее состояние. Поскольку для оптимального клинического эффекта необходимо надлежащее применение назального спрея, пациенты должны быть проинформированы о правильном использовании этих устройств. Наиболее распространенными побочными эффектами интраназальных ГКС являются носовые кровотечения, сухость и жжение слизистой носа. Как правило, эти эффекты отмечаются в течение первых дней лечения и редко являются поводом для отмены препаратов. При их появлении рекомендуется снизить используемую дозу и перейти к использованию назального спрея на водной основе. При неправильной технике ингаляции назальных стероидов описаны единичные случаи перфорации носовой перегородки. Для профилактики этого возможного побочного эффекта рекомендуется вводить препарат в полость носа в строго сагиттальном направлении.
При назначении интраназальных ГКС важен вопрос их безопасности. Побочные эффекты препаратов этой группы напрямую зависят от величины показателя их системной биодоступности. Современные интраназальные ГКС обладают низкой биодоступностью и хорошо переносятся больными. Следует иметь в виду, что биодоступность интраназальных препаратов определяется не только их всасыванием со слизистой оболочки носа, но и абсорбцией той части дозы (менее половины от введенной), которая, осев в глотке, проглатывается и всасывается в кишечнике. Кроме того, при нормально функционирующем мукоцилиарном транспорте основная часть препарата (до 96%) в течение 20–30 минут после интраназального введения переносится в глотку с помощью ресничек слизистой оболочки носа, откуда поступает в желудочно-кишечный тракт и подвергается абсорбции. Именно поэтому биодоступность при пероральном и интраназальном приеме является важной характеристикой интраназальных ГКС, в значительной степени определяющей их терапевтический индекс, то есть соотношение местной противовоспалительной активности и потенциала неблагоприятного системного действия (табл. 2) [4].
Низкая биодоступность современных интраназальных ГКС связана не только с их низкой абсорбцией, но и с быстрым и практически полным метаболизмом при первом проходе через печень. Это обусловливает в целом короткий период полувыведения интраназальных ГКС, однако продолжительность его варьирует в зависимости от препарата. Отдельно остановимся на возможности применения интраназальных ГКС для лечения АР у беременных женщин. Появились публикации, согласно данным которых при тяжелых формах АР препаратами выбора у беременных женщин являются интраназальные ГКС, но эти препараты должны назначаться с учетом их биодоступности. На сегодняшний момент ретроспективно не было зарегистрировано ни одного нежелательного явления после применения интраназальных ГКС у беременных женщин. Предположительно, данные рекомендации будут отражены в международных согласительных документах.
Метаанализ 84 исследований, проведенных в Германии за период с 1966 по 2009 г., продемонстрировал эффективность и безопасность данной группы препаратов. Дексаметазон, будесонид, флутиказона пропионат, флутиказона фуроат, флунизолид, мометазона фуроат, триамцинолон и беклометазона дипропионат были оценены в терапии АР. Эффективность определялась по действию препаратов на назальные и глазные симптомы и выражалась в виде балла эффективности. Оценка безопасности проводилась с позиции развития системных побочных эффектов (носовые кровотечения, задержка роста детей) и выражалась в виде балла безопасности. По выраженности клинического эффекта препараты распределились следующим образом: будесонид, мометазона фуроат, триамцинолон. Наибольшую безопасность (по упомянутым выше позициям) продемонстрировали мометазона фуроат, триамцинолон, флутиказона пропионат. Исследования показывали, что интраназальное применение беклометазона, но не других интраназальных ГКС, может замедлять рост у детей по сравнению с плацебо, однако долгосрочные исследования по изучению влияния беклометазона на рост у детей отсутствуют. Суммируя полученные данные, с позиции эффективности и безопасности лидерство среди интраназальных ГКС принадлежит мометазона фуроату и триамцинолону [3, 13].
Назонекс® (мометазона фуроат, производства компании MSD) обладает выраженным противовоспалительным действием, оказывает влияние на раннюю и позднюю фазы аллергического воспалительного ответа. Важно, что Назонекс® начинает действовать быстро, эффект может наступать уже через 5–11 часов после введения первой дозы. Применение Назонекса 1 раз в сутки позволяет контролировать и назальные (в том числе заложенность носа), и глазные симптомы АР в течение 24 часов. Назонекс® содержит глицерин, который обладает свойством увлажнять как кожу, так и слизистые оболочки и крайне редко вызывает сухость слизистой носа. При длительном применении способствует восстановлению гистологической структуры слизистой носа до нормы. При назначении интраназальных ГКС важным остается вопрос их безопасности. Побочные эффекты препаратов этой группы, как упоминалось выше, напрямую зависят от величины показателя их системной биодоступности. Назонекс® при назначении в виде водного назального спрея характеризуется крайне низкой биодоступностью (< 1%) и практически не определяется в плазме крови даже при использовании высокочувствительных методов исследования. Крайне низкая биодоступность обусловливает отсутствие системного действия даже при 20-кратном увеличении дозы. Высокая безопасность определяет возможность применения Назонекса пациентами широкого возрастного диапазона – как взрослыми (в том числе старческого возраста), так и детьми начиная с 2 лет.
В заключение отметим: несмотря на то что АР – достаточно распространенное и хорошо известное клиницистам заболевание, которое с каждым годом прогрессирует, существует проблема несвоевременной диагностики данной патологии врачами первичного звена, что, к сожалению, приводит к нерациональному подходу в лечении. В связи с этим очень важно, чтобы практические врачи понимали важность своевременной диагностики и необходимость применения современных схем лечения аллергического ринита.
Круглогодичный аллергический ринит обусловлен воздействием ингаляционных аллергенов жилища, таких как клещи домашней пыли и аллергены домашних животных, тараканов и др.
В установлении диагноза основным являются результаты диагностических проб или определения аллерген-специфического IgE в сыворотке крови.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.