Барьерные методы защиты слизистой оболочки носа у пациентов с аллергическим ринитом
- Аннотация
- Статья
- Ссылки
- English



Введение
Взаимодействие организма с внешней средой (антигены, аллергены, микроорганизмы и др.) осуществляется через слизистые оболочки. Это основные зоны контакта макроорганизма с антигенами окружающей среды. Слизистые оболочки покрывают все полые органы, контактирующие с внешней средой (респираторный тракт, носоглотка, слуховые проходы, внутренняя поверхность век и др.). Поверхность слизистых тканей человека огромна (около 300–400 м2). На ее иммунное обеспечение требуется большое количество клеток и молекул.
Слизистые оболочки служат барьером, защищающим организм от повреждающего воздействия агентов, способных проникать в организм через эпителий, вызывая развитие инфекционных и неинфекционных процессов, включая аллергические заболевания. Здоровые слизистые оболочки надежно защищают организм от агрессивного влияния. Поверхность поврежденной слизистой оболочки, как правило, заселяется микроорганизмами, что приводит к снижению защитных функций организма [1–5].
Барьерная функция слизистых оболочек реализуется и поддерживается за счет действия комплекса неспецифических факторов (перистальтические движения, движение ресничек эпителия, отделение слизи, выделение ферментов и др.), а также вовлечения специфических и неспецифических иммунных реакций, в частности местного, или мукозального, иммунитета. Понятие местного (мукозального, лат. mucosa – слизистая оболочка) иммунитета было сформулировано в 1930-х гг. А.М. Безредкой, который указал на важнейшую роль системы иммунитета, связанной со слизистыми оболочками. Защитную функцию выполняют неспецифические и специфические иммунные механизмы. Иммунная система слизистой оболочки полости носа, равно как и системный иммунитет, обеспечивает защиту с помощью факторов врожденного (неспецифического) и приобретенного (адаптивного) иммунитета [6].
К наиболее частым причинам образования дефектов защитной системы слизистой оболочки полости носа относят инфекционные (например, респираторные инфекции) и неинфекционные поражения. Из неинфекционных заболеваний часто встречается аллергический ринит (АР), который во всем мире признан одним из самых распространенных аллергических заболеваний среди взрослого и детского населения. По данным ARIA-2016, распространенность АР в мире составляет в педиатрической популяции 2–25%, во взрослой – до 40%, распространенность подтвержденного АР у взрослых в Европе – от 17 до 28,5% [7]. В России в течение 20 лет заболеваемость АР возросла в 4–6 раз. Показатель заболеваемости варьируется в зависимости от региона – от 12,7 до 24% всего населения [8].
По данным Центрального научно-исследовательского института организации и информатизации здравоохранения, в 2016 г. зарегистрирован 304 691 пациент с АР (207,9 чел. на 100 тыс. населения) [9].
Аллергический ринит является фактором риска развития бронхиальной астмы (БА) (насчитывается 200 млн пациентов с АР и БА), способствует развитию других заболеваний ЛОР-органов (синусита, отита, евстахиита, инфекций верхних дыхательных путей) [6].
Аллергический ринит – заболевание, характеризующееся IgE-опосредованным воспалением слизистой оболочки полости носа (развивается под действием аллергенов) и наличием ежедневно проявляющихся в течение часа и более хотя бы двух из следующих симптомов: заложенность (обструкция) носа, выделения из носа (ринорея), чихание, зуд в полости носа [10]. АР существенно влияет на качество жизни, работоспособность и способность к обучению и является одной из самых частых причин обращения к врачу. Больные АР и другими аллергическими заболеваниями в первую очередь обращаются за медицинской помощью к врачам первичного звена здравоохранения – участковым терапевтам, семейным врачам, педиатрам.
В согласительном документе ЛИРА-2018 в отношении диагностики и лечения АР предусмотрено следующее. Согласно действующим российским клиническим рекомендациям/протоколам, установить диагноз АР на основании анамнеза, жалоб и клинической картины и назначить лечение может лечащий врач любой специальности (педиатр, терапевт, оториноларинголог, аллерголог-иммунолог и др.). Если контроль заболевания не достигнут в течение 1,5–2 недель, рекомендуется пересмотреть терапию и/или решить вопрос о направлении пациента к оториноларингологу и/или аллергологу для подтверждения либо исключения диагноза АР [11].
Таким образом, доступность, качество и эффективность оказания медицинской помощи данной категории пациентов напрямую зависят от знаний и умений врачей первичного звена.
Этиология, классификация аллергического ринита
Ингаляционные аллергены, как сезонные (пыльца растений, споры плесневых грибов), так и круглогодичные или внутридомашние (клещи домашней пыли, аллергены домашних животных), служат основными триггерами, запускающими аллергическую реакцию, лежащую в основе развития АР. В зависимости от этиологического фактора выделяют сезонный аллергический ринит (САР) и круглогодичный аллергический ринит (КАР) (классифицируются по форме, характеру, тяжести течения, стадии заболевания). САР возникает в период цветения растений, вызывающих аллергию (обычно весной, летом или осенью), и развивается у сенсибилизированных лиц при концентрации пыльцы в воздухе 10–20 зерен на 1 см3 воздуха.
Классификация международных согласительных документов по АР (EAACI/WAO, ARIA 2008, 2010), которой в настоящее время отдается предпочтение, предлагает разделять АР:
- по характеру течения: интермиттирующий АР (симптомы беспокоят менее четырех дней в неделю или менее четырех недель в году), персистирующий АР (симптомы беспокоят более четырех дней в неделю и более четырех недель в году);
- тяжести течения: легкая степень тяжести АР (у пациента имеются лишь незначительные клинические проявления болезни, не нарушающие дневную активность и сон); средняя степень (симптомы нарушают сон пациента, препятствуют работе, учебе, занятиям спортом, качество жизни существенно ухудшается); тяжелая форма АР (симптомы настолько выражены, что пациент в отсутствие лечения не может нормально работать, учиться, заниматься спортом или проводить досуг и спать ночью);
- стадии течения АР (стадия обострения и стадия ремиссии) [10].
Диагностика
Обследование пациентов с АР включает:
- аллергологический анамнез;
- физикальное обследование;
- специфическую аллергологическую диагностику (постановка кожных проб с аллергенами, определение специфических IgE-антител, проведение назального провокационного теста со специфическими аллергенами);
- лабораторные исследования (цитологическое исследование секрета из полости носа (мазок) на наличие эозинофилов);
- обязательные инструментальные исследования (передняя риноскопия);
- дополнительные инструментальные исследования (рентгенологическое исследование полости носа и придаточных пазух носа, компьютерная томография полости носа и придаточных пазух носа, риноманометрия, эндоскопическое исследование полости носа, аппликационная проба с 0,1%-ным раствором адреналина гидрохлорида).
На диагностическом этапе необходимо оценивать сопутствующие заболевания.
Лечение
В соответствии с рекомендациями международных согласительных документов, лечение АР должно быть эффективным, безопасным и доступным для пациентов. Для достижения контроля над симптомами АР предусмотрена терапия, состоящая из последовательных ступеней. Каждая ступень предусматривает варианты фармакологической терапии в зависимости от выраженности симптомов АР.
Со времени последнего пересмотра ARIA в 2010 г. появились новые препараты и методы лечения АР, поэтому в 2016 г. комитет экспертов выпустил пересмотренный документ, в котором обозначены новые вопросы, требующие ответа, с рекомендациями или пересмотрены существующие рекомендации [12]. Для восстановления слизистой оболочки полости носа при АР необходимо использовать как специфические, так и неспецифические методы защиты и контроля состояния слизистых оболочек и симптомов болезни. К специфическим методам терапии АР относят элиминацию (устранение причинно-значимого аллергена) и аллергенспецифическую иммунотерапию. Неспецифические методы лечения АР включают в себя фармакотерапию, барьерные методы лечения и профилактики; другие альтернативные способы контроля состояния слизистых оболочек и симптомов болезни. Фармакотерапия, или симптоматическая терапия, направлена на устранение симптомов АР и предполагает использование препаратов с различным механизмом действия, влияющих на разные звенья аллергического воспаления, развивающегося при манифестации или обострении заболевания. При АР применяются пероральные и топические антигистаминные препараты (АГП), топические и системные глюкокортикостероиды (ГКС), стабилизаторы мембран тучных клеток (интраназальные кромоны), интраназальные и пероральные деконгестанты, интраназальные антихолинергические средства, антилейкотриеновые препараты. Каждый препарат имеет свои показания и противопоказания, перечисленные в инструкции к применению.
Последние годы в силу высокой безопасности и достаточной клинической эффективности широкое распространение получили барьерные методы лечения АР. Эти методы характеризуются способностью предупреждать или снижать проницаемость слизистых оболочек для аллергенов, препятствовать трансбарьерной сенсибилизации и развитию (обострению) аллергической реакции на действие аллергена. В соответствии с принципом действия барьерные методы подразделяют:
- на механические: фильтры, ирригационная терапия (промывание носа) – персональная гигиена носа, позволяющая очистить полость носа и пазухи. Ирригационная терапия практиковалась на протяжении веков в Индии, Китае и других странах;
- химические: средства для смазывания полости носа в целях защиты от проникновения вирусов, бактерий и прочих возбудителей инфекции;
- методы сочетанного действия.
Из недостатков механических барьерных методов следует выделить осторожное применение у детей и лиц с риском носового кровотечения, искривлением носовой перегородки, полипами, БА. При ношении фильтра желательно меньше разговаривать и стараться дышать носом. Особое внимание барьерным методам необходимо уделять в тех случаях, когда у пациентов имеются серьезные ограничения для приема лекарственных средств: беременность, лактация, детский возраст, спорт высших достижений, лекарственная аллергия и непереносимость.
К преимуществам барьерных методов относятся:
- простота и удобство применения;
- безопасность, в том числе в период гестации и лактации;
- сочетание с другими методами фармакотерапии;
- возможность использования в режиме «по требованию» (поездки, перелеты, нахождение в закрытых помещениях, где не исключен контакт с аллергенами и ирритантами);
- быстрый эффект, как при назначении назальных деконгестантов;
- отсутствие эффекта привыкания.
Накоплен большой опыт применения барьерных методов при АР и получены убедительные данные о безопасности и клинической эффективности препарата Назаваль. Еще в 1994 г. в Англии для этой цели был предложен инертный порошок целлюлозы – препарат Nasaleze, или Назаваль, который в настоящее время успешно применяется в 50 странах.
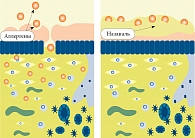
Назаваль – медицинское средство высокого класса безопасности, механизм действия которого заключается в защите слизистой оболочки полости носа от попадания в организм при дыхании разнообразных аэроаллергенов (пыльца растений, домашняя пыль, клещи домашней пыли, аллергены пуха, шерсть животных и птиц и др.), химических веществ, инфекционных агентов (бактерии, грибы, вирусы) и поллютантов (промышленные выбросы, выхлопы автотранспорта) (рис. 1).
Назаваль: характеристика и механизм действия
При использовании микродисперсный порошок целлюлозы (Назаваль) из спрея-дозатора попадает на слизистую оболочку носовых ходов, связывается со слизью и образует прозрачный гелеобразный слой, который выстилает носовую полость и служит естественным барьером на пути проникновения аэроаллергенов и поллютантов в организм, тем самым препятствуя развитию аллергической реакции (рис. 2). Впоследствии гель выводится благодаря работе мукоцилиарного аппарата. Целлюлозная добавка, в том числе порошок целлюлозы, безопасна для здоровья, разрешена в странах Евросоюза (Е460) и широко применяется в пищевой, кондитерской и медицинской промышленности в качестве носителя, стабилизатора, регулятора влаги, наполнителя или разделителя, причем для большинства продуктов питания без ограничения количества. Порошок целлюлозы обладает умеренным бактерицидным действием, однако к лекарственным препаратам не относится. Назаваль не является лекарством. Он представляет собой защитное медицинское средство высокого 1-го класса безопасности для длительного использования [13].
Важное свойство Назаваля: средний размер микрочастиц целлюлозы 118 мкм (от 5 до 500 мкм) позволяет им проникать только в носоглотку, не достигая трахеи, бронхов, бронхиол и альвеол. Гелеобразная защитная пленка, образуемая Назавалем на слизистой оболочке полости носа, играет важную роль в элиминации аллергенов [14]. Так, в исследовании in vitro механизма действия геля, образуемого порошком микродисперсной инертной целлюлозы, диффузия аллергена клеща домашней пыли (Der р1) через гелеобразную пленку значимо снижалась во все временные точки (15, 30, 45, 60, 180 и 360 минут). Через 15 минут только 0,76% базального количества аллергена диффундировало через пленку, через 360 минут – 14%, тогда как в группе контроля (агарный гель) диффузия аллергена составила 100% [15]. Важным фактором, влияющим на депонирование гидроксипропилметилцеллюлозы (ГМ), являются гигроскопические свойства порошка, позволяющие абсорбировать влагу из воздуха. Гигроскопичность – природная способность материала поглощать влагу из окружающей среды, что приводит к увеличению размера частицы за счет агрегации, вызванной локальным растворением и вторичной кристаллизацией. Порошки ГМ полидисперсные. То есть они содержат молекулы, способные к полимеризации и увеличению веса, что позволяет облегчать симптомы АР. При этом значение имеет не количество частиц, а их масса.
В одном из исследований ученые анализировали гигроскопичность и массу частиц интраназальной целлюлозы, применяемой для лечения САР. Показано, что после 24 месяцев хранения размер частиц увеличивается на 14%. Установлено, что частицы ГМ абсорбируют влагу из воздуха, находящегося в носовой полости, и увеличиваются в диаметре, занимая все больше пространства в дыхательных путях. Таким образом, степень поглощения частиц и степень эффективности возрастают с увеличением размера [14].
Назаваль состоит только из натуральных компонентов, не обладает системным воздействием, поэтому может использоваться в любом возрасте и у особых контингентов больных, а также у работников профессиональных сфер, требующих высокой концентрации внимания. Назаваль не вызывает сонливости, не влияет на аппетит. Препарат отличается быстрым началом действия (облегчение симптомов наступает через десять минут и в течение трех часов после применения), а также уникальной системой дозирования, размещенной внутри флакона. Система позволяет впрыскивать точно отмеренную дозу микродисперсной целлюлозы, обеспечивая равномерное распределение порошка в полости носа. Рекомендованная дозировка – по одному впрыску в каждый носовой ход три-четыре раза в день. Гелеобразная пленка, образуемая микродисперсным порошком растительной целлюлозы, легко удаляется при высмаркивании, поэтому после каждого очищения полости носа требуется повторное применение Назаваля. Гель выводится благодаря работе мукоцилиарного аппарата. При необходимости совместного применения с другими интраназальными лекарственными средствами Назаваль следует использовать не ранее чем через 30 минут после их применения [16].
Клиническая эффективность порошка микродисперсной целлюлозы продемонстрирована в зарубежных и российских исследованиях, проведенных у детей, подростков и взрослых с САР и КАР. Большая часть этих исследований – простые открытые наблюдательные, меньшая – двойные слепые плацебоконтролируемые. Тем не менее во всех этих исследованиях продемонстрирована эффективность микродисперсного порошка целлюлозы в профилактике и лечении АР.
Зарубежные клинические исследования эффективности порошка микродисперсной целлюлозы в монорежиме или комбинированном лечении АР
В одном из первых исследований, проведенных в Англии, с участием 102 взрослых больных САР показана эффективность Назаваля в 77% случаев [17]. По завершении шестинедельного периода исследования более 70% его участников оценили эффективность порошка целлюлозы как хорошую или высокую. Облегчение симптомов отмечалось в течение 0,1–3 часов после применения препарата. Побочные эффекты наблюдались редко, но на первой неделе 10% пациентов отмечали, что легко вдыхают большой объем порошка и это вызывает неприятное ощущение в области задней стенки глотки. У одного пациента зафиксирован зуд в глазах, у другого – боль в горле. Однако эти симптомы могли быть обусловлены и проявлениями АР. Трудности с определением объема порошка, оставшегося во флаконе (из непрозрачного белого пластика), были наиболее распространенным неудобством. В одном случае, когда порошок практически закончился, у пациента сразу же возникли серьезные симптомы АР.
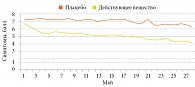
В мае 2013 г. было проведено двойное слепое плацебоконтролируемое исследование Назаваля в отношении облегчения симптомов АР [18]. У 108 пациентов в возрасте от 18 до 40 лет с поллинозом, вызываемым пыльцой трав, на фоне четырехнедельной терапии оценивали эффективность и безопасность Назаваля. Пациенты с легкими и умеренными симптомами поллиноза были случайным образом распределены в группы активного лечения и плацебо. При этом использовалось идентичное устройство для введения препарата в каждый носовой ход три раза в день. Пациентам разрешалось использовать средства экстренной терапии (пероральный АГП лоратадин и натрия кромогликат в форме глазных капель). Результаты исследования показали значительное снижение баллов тяжести в отношении чихания, ринореи, заложенности носа и симптомов со стороны глаз и нижних дыхательных путей в группе активного лечения. Клинически значимых нежелательных явлений не выявлено. Общие баллы назальных симптомов за каждый день с 1 по 28 мая представлены на рис. 3.
Средства экстренной терапии в виде АГП потребовались одному пациенту из группы активного лечения и одному – из группы плацебо. Ни один из них не применял глазных капель. При последующем наблюдении общее впечатление о лечении свидетельствовало о значительном преимуществе активного лечения (таблица).
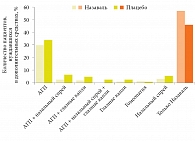
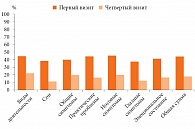
В другом двойном слепом плацебоконтролируемом исследовании пациенты получали Назаваль, плацебо, а также другие препараты для лечения АР [19]. Критерием эффективности Назаваля служило применение препаратов, необходимых для контроля симптомов. В исследование были включены 97 взрослых пациентов с симптомами АР в сезон пыления злаковых трав. Значимых различий в отношении симптомов АР в сравниваемых группах не выявлено. Однако была установлена существенная разница в объеме фармакотерапии, применяемой пациентами этих групп (рис. 4) [19].
Наиболее часто используемыми средствами были АГП. В группе активного лечения только АГП принимали 29% пациентов, в группе плацебо – 33%. Значимых различий между группами не установлено. Вместе с тем при анализе применения АГП в целом (количества больных, использовавших АГП независимо от того, применялись они в качестве монотерапии или в сочетании с другими препаратами) в группах активного лечения и плацебо насчитывалось 34 и 48% пациентов соответственно (p < 0,05). Следующими по частоте использования были интраназальные ГКС (ИнГКС). С учетом всех дней с умеренным (и выше) уровнем содержания пыльцы травы в воздухе назальные спреи использовали 10% пациентов активной группы и 14% – группы плацебо (p < 0,05). Только инертный порошок целлюлозы в отсутствие других фармакологических препаратов применяли 57% пациентов группы активного лечения и 44% – группы плацебо (рис. 4). Результаты этого исследования показали, что использование инертного порошка целлюлозы сокращает применение фармакологических лекарственных препаратов для контроля симптомов АР, что особенно важно в некоторых популяциях больных (дети, пожилые лица, беременные, кормящие женщины).
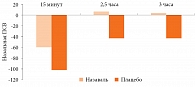
Следует отметить, что превентивное применение Назаваля значительно улучшает назальное дыхание после провокации аллергеном. В двойном слепом плацебоконтролируемом исследовании разница в назальной пиковой скорости выдоха (ПСВ) после провокации аллергеном луговых трав у больных, получавших микродисперсную целлюлозу, и пациентов, применявших плацебо, была достоверна во все временные точки после провокации (рис. 5) [20].
В аналогичном двойном слепом плацебоконтролируемом исследовании с перекрестным дизайном участвовали 15 пациентов с персистирующим АР, вызванным аллергией к клещу домашней пыли [13]. Результаты продемонстрировали существенную разницу в выраженности симптомов АР (ринорея, чихание, зуд) (рис. 6) и уровне ЕСР в назальном секрете после назального провокационного теста с аллергеном клещей. Пациенты, получавшие Назаваль, отличались значимо меньшей (р < 0,05) интенсивностью симптомов АР после провокации. Авторы сделали вывод об эффективности порошка инертной целлюлозы в уменьшении симптомов персистирующего АР, вызванного аллергией к клещу домашней пыли.
Российский опыт применения порошка микродисперсной целлюлозы в монорежиме или в комбинированном лечении АР
В Российской Федерации Назаваль зарегистрирован и разрешен к применению с 2009 г. Несколько отечественных исследований у взрослых и детей показали его эффективность в терапии АР.
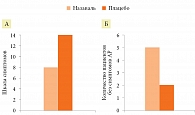
Т.В. Захаржевской и соавт. [21] было проведено открытое несравнительное исследование эффективности и безопасности спрея Назаваль в профилактике и лечении АР. В исследовании участвовало 48 больных (25 взрослых и 23 ребенка) с АР. Длительность лечения составила четыре недели с еженедельной оценкой клинических проявлений АР. Показано, что Назаваль уменьшает выраженность симптомов АР уже на первой неделе применения как у детей, так и у взрослых с АР. Кроме того, Назаваль улучшает качество жизни пациентов с АР более чем в два раза (рис. 7).
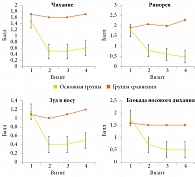
В открытом сравнительном исследовании, проведенном под руководством профессора Н.А. Геппе в 2010 г., препарат Назаваль статистически достоверно влиял на все симптомы САР у 50 детей в возрасте от четырех до 14 лет [22]. Оценивались объективные и субъективные симптомы САР до лечения и через две, четыре и шесть недель после начала применения препарата. Через две недели от начала применения микродисперсного порошка целлюлозы Назаваль в группе активного лечения достоверно уменьшились все симптомы САР: ринорея – с 1,8 ± 0,4 до 0,8 ± 0,6 балла, чихание – с 1,5 ± 0,6 до 0,5 ± 0,6, зуд в носу – с 1,2 ± 0,5 до 0,4 ± 0,5, блокада носового дыхания – с 1,8 ± 0,5 до 0,7 ± 0,6 балла (р < 0,001) (рис. 8) [22]. У большинства пациентов (73%) отчетливое улучшение состояния отмечалось уже к пятому дню от начала применения Назаваля. В последующие две недели у 12 (40%) детей симптомы купировались полностью. У остальных пациентов отмечалось дальнейшее снижение симптомов АР.
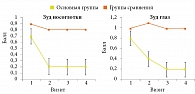
Важными в данном исследовании стали результаты влияния терапии Назавалем на сопутствующие АР симптомы конъюнктивита. Спустя две недели от начала лечения микродисперсным порошком инертной целлюлозы зуд глаз у пациентов уменьшился с 0,8 ± 0,7 до 0,4 ± 0,5 балла, а через четыре недели – до 0,2 ± 0,3 балла (рис. 9) [22].
На фоне применения спрея Назаваль девять (34,6%) детей эпизодически получали АГП, семеро (26,9%) – деконгестанты, трое (10%) – ИнГКС. В группе сравнения симптомы сохранялись на протяжении всего периода наблюдения, что требовало частого приема АГП – восемь (40%) детей, деконгестантов – 15 (75%). Восемь (40%) пациентов использовали ИнГКС (рис. 10) [22].
У двух (6,6%) детей со среднетяжелым САР препарат оказался малоэффективным и к терапии были добавлены ИнГКС. Двое (6,6%) детей отметили усиление чихания после применения препарата, впоследствии им отменили Назаваль. В целом большинство родителей и врачей (86,4%) оценили микродисперсный порошок целлюлозы как высокоэффективное средство для профилактики и лечения САР. Исследователи сделали заключение об эффективности микродисперсной целлюлозы в целях профилактики и лечения САР у детей, проявившейся в снижении не только интенсивности симптомов АР и сопутствующего конъюнктивита, но и потребности в дополнительной фармакотерапии.
В Институте иммунологии ФМБА России провели открытое несравнительное исследование эффективности препарата Назаваль у 30 взрослых пациентов с АР, вызванным пыльцевой аллергией [23]. Эффективность препарата оценивали на основании сравнения результатов провокационных назальных тестов, полученных до и после применения препарата Назаваль. Эффективность действия препарата Назаваль отмечалась у 28 (99,6%) пациентов, что выражалось статистически достоверным уменьшением назальной реактивности на причинно-значимый аллерген. Средняя пороговая концентрация аллергена при проведении провокационных назальных тестов исходно составила 1250 PNU/мл, а после применения препарата Назаваль – 5000 PNU/мл (p < 0,001). При этом четыре пациента не отмечали развития симптомов даже при провокации аллергеном в максимальной концентрации 10 000 PNU/мл. Лучшие результаты были получены у пациентов с изолированной пыльцевой сенсибилизацией и легким течением ринита. Двое больных, у которых препарат оказался неэффективным, имели сочетанную пыльцевую и бытовую сенсибилизацию. Исследователи предположили, что наличие бытовой сенсибилизации обусловливает персистирующее аллергическое воспаление слизистой оболочки полости носа и повышенную назальную гиперреактивость даже в отсутствие клинических проявлений ринита. Поскольку Назаваль не обладает противовоспалительным или противоаллергическим действием, не следует ожидать, что препарат повлияет на течение уже развившейся аллергической реакции. Тем не менее в составе комплексной терапии АР препарат способен блокировать дальнейшее поступление аллергена с вдыхаемым воздухом. В этом исследовании ни у одного из пациентов не зарегистрировано ни одного нежелательного явления.
Заключение
На текущий момент накоплена большая доказательная база эффективности и безопасности Назаваля в профилактике развития симптомов АР: зуда в носу, отека слизистой оболочки носа и нарушения носового дыхания, обильных слизистых выделений из носа, приступов чихания и зуда глаз. Применение Назаваля позволяет снизить лекарственную нагрузку у пациентов с АР, повысить их приверженность лечению и, как следствие, улучшить качество жизни.
Назаваль, действуя как естественный барьер по отношению к аэроаллергенам, препятствует развитию аллергии и других поражений слизистой оболочки полости носа. Эффективность препарата будет выше, если его использовать до начала и продолжать в течение всего периода контакта с аллергеном. При легкой степени АР Назаваль можно использовать в виде монотерапии, при средней степени – в составе комплексного лечения.
Преимуществом средства Назаваль является высокая безопасность и возможность применения у детей, беременных и кормящих женщин, спортсменов (отсутствие допинга), а также у работников профессиональных сфер, требующих высокой концентрации внимания.
Безопасность спрея Назаваль относится к наивысшему классу по классификации средств медицинского назначения. Противопоказанием к применению Назаваля является индивидуальная непереносимость.
O.V. Sebekina, PhD, N.M. Nenasheva, DM, PhD, Prof., A.Yu. Nasunova
Russian Medical Academy of Continuing Postgraduate Education
Clinic ‘Chaika’, LLC
Contact person: Oksana V. Sebekina, sebekina74@bk.ru
The mucous membranes of the nasal cavity protect the body from negative influence of damaging environmental factors, including allergens. This article analyzes the effectiveness of barrier therapy in allergic rhinitis (AR). The peculiarities of the action of microdispersed cellulose powder (Nazaval) – nasal spray for local use. Based on data from a number of studies, both foreign and Russian, it has been shown that Nazaval reduces the clinical symptoms of seasonal and year-round AR, is effective and safe in preventing AR, and as part of complex drug therapy contributes to more rapid relief of clinical manifestations of the disease and improving the quality of life of patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.