Состояние иммунного статуса у детей с сезонным аллергическим ринитом и оптимизация тактики лечения
- Аннотация
- Статья
- Ссылки
- English

Актуальность
Аллергический ринит (АР) представляет собой воспаление слизистой оболочки полости носа, опосредованное иммуноглобулином (Ig) Е и детерминированное воздействием аллергических антигенов у генетически предрасположенных пациентов. АР сопровождается определенными симптомами. Основными из них считаются обильная ринорея, зуд в носовой полости, частое чихание, заложенность носа. Иногда имеет место аносмия. Примерно 40% взрослой популяции страдают различными формами АР. У 15% больных АР ассоциируется с бронхиальной астмой (БА). У 55–85% пациентов с БА отмечаются симптомы АР [1].
Распространенность АР в педиатрической популяции достигает 5% среди детей в возрасте до трех лет, 8,5% – среди детей в возрасте 6–7 лет. У детей в возрасте 13–14 лет уровень заболеваемости составляет 14,6%, а у лиц в возрасте 20 лет и старше – 46% [2].
У иммунокомпрометированных пациентов с круглогодичным АР наблюдаются дефекты функционирования интерфероновой системы и другие нарушения адаптивной противовирусной защиты. Вирусные антигены способны запускать механизм развития аллергической реакции, сочетающейся с формированием Th2-зависимого иммунного ответа [2, 3].
Как известно, интерфероны 1-го типа (альфа/бета) играют определенную роль в подавлении аллергических реакций. Кроме того, у лиц с нарушениями секреции белков-интерферонов 1-го типа развиваются тяжелые аллергоатопические заболевания [4, 5].
Иммунологическую основу аллергических реакций составляет дисрегуляторный механизм активации CD4+ Th2-клеток. Фактор транскрипции GATA3 относится к представителям регуляторных белков, содержащим домен zinc finger («цинковый палец»), с помощью которого регулируется CD4+ Th2-комплекс и настраивается цитокиновый локус Th2 для быстрой активации, что характерно для аллергических реакций. Интерфероны 1-го типа альфа и бета разрушают петлю активации белка GATA3 и способствуют эпигенетическому подавлению Th2-специфической регуляторной области в гене GATA3. Интерфероны 1-го типа ингибируют Th2-клетки и блокируют экспрессию гена GATA3, что приводит к подавлению аллергической воспалительной реакции [6].
Аллерген-специфические IgE связываются с определенными рецепторами на мембранах базофилов и тучных клеток, выделяется медиатор воспаления гистамин, формирующий основную клиническую картину – заложенность носа (из-за дилятации сосудов), чихание и зуд. Однако ключевую роль в формировании иммунного ответа в полости носа играют CD4+-лимфоциты (Т-хелперы), которые вместе с эозинофилами, базофилами, фагоцитарными нейтрофилами обусловливают позднюю клиническую симптоматику АР и способствуют переходу острого АР в хронический [7].
Секреторный IgA играет важную роль в иммунологической защите полости носа и защищает слизистую оболочку от внедрения аллергенов, бактериальных и вирусных патогенов. Экспрессия интерферон-стимулированных генов также происходит в слизистой оболочке полости носа. Взаимосвязь АР и острых респираторных заболеваний (ОРЗ) вирусно-бактериальной этиологии не подвергается сомнению. Собственно вирусные и бактериальные патогены могут быть причинно-следственными аллергенами и вызывать персистирующее аллергическое воспаление: во время ОРЗ возрастает частота госпитализаций с АР и БА [3].
С учетом сказанного использование препаратов рекомбинантного интерферона альфа-2b в терапии АР патогенетически оправдано: благодаря биологическому механизму действия интерферона, являющегося плейотропным цитокином, не только подавляется вирусная репликация, усиливается клеточный иммунитет за счет активации NR-клеток и фагоцитов, но и оказывается общее антиаллергическое действие. Указанные лекарственные препараты должны обладать высокими адгезивными свойствами к слизистой оболочке носовой полости, достаточной длительностью фармакологического действия, высокой местной активностью и низким риском развития побочных и нежелательных явлений [8].
Всем перечисленным требованиям отвечает отечественный препарат рекомбинантного интерферона альфа-2b ВИФЕРОН®в комплексе с антиоксидантами. Препарат ВИФЕРОН® выпускается в следующих лекарственных формах: мазь, гель и ректальные суппозитории.
Препарат характеризуется выраженным антивирусным действием и высокой иммуномодулирующей активностью [9].
Лекарственная форма геля наиболее применима для носовой полости. Обладая гидрофильными свойствами, гель ВИФЕРОН® легко адсорбируется на муцинозной поверхности мерцательного эпителия слизистой оболочки носовой полости, усиливает свою диффузионную способность в преодолении эпителиальных барьеров слизистых оболочек, а собственно гелевая форма равномерно выделяет действующее вещество из своей субстанции в течение пяти часов, в связи с чем белок-интерферон в препарате ВИФЕРОН® гель сохраняет стабильность долгое время [10].
Цель – изучить эффективность иммуномодулирующей терапии при АР у детей.
Материал и методы
На протяжении 13 недель (с сентября по ноябрь 2023 г.) мы изучали эффективность терапевтического применения иммуномодулирующего препарата ВИФЕРОН® гель у 36 детей с диагнозом сезонного АР.
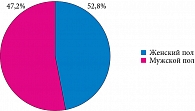
Исследовательскую когорту представляли 17 (47,2%) пациентов женского пола и 19 (52,8%) – мужского (рис. 1).
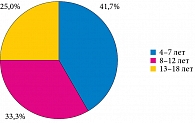
Возрастную группу от четырех до семи лет составили 9 (25,0%) человек, 8–12 лет – 12 (33,3%), 13–18 лет – 15 (41,7%) пациентов (рис. 2).
Все участники исследования были разделены на две группы. В первую (основную) группу вошли 23 пациента, у которых оценивали иммунологические и клинические показатели до и после терапии препаратом ВИФЕРОН® гель. Вторую (контрольную) группу составили 13 детей, которые получали стандартную терапию. У них также оценивали иммунологические показатели до и после лечения.
Препарат ВИФЕРОН® 36 000 МЕ/г гель применяли по следующей схеме: пациентам основной группы вводили гель два раза в день (полоска геля 0,5 см) в каждый носовой ход в течение 14 дней. Кроме препарата рекомбинантного интерферона альфа-2b с антиоксидантами другого специфического лечения пациенты не получали, за исключением сосудосуживающих симптоматических средств для купирования заложенности носа.
Пациенты контрольной группы получали специфическую антиаллергическую терапию антигистаминными препаратами, назальными сосудосуживающими средствами. Интерферонотерапию в этой группе не назначали.
В ходе исследования изучали субпопуляции лимфоцитов CD3+, CD4+, CD8+, CD19+ в качестве клеточного и гуморального звеньев иммунитета. Иммунофенотипирование лимфоцитов осуществлялось методом проточной цитометрии на проточном цитометре Bekson Dickenson на основе частиц, покрытых моноклональными антителами к CD3+, CD4+, CD8+, CD19+ (компания «Сорбент», Москва). Показатели антителообразования в отношении иммуноглобулинов различных типов (IgA, IgM, IgG) изучали методом радиальной диффузии по Манчини. Уровень циркулирующих иммунных комплексов (ЦИК) определяли нефелометрическим методом. Бактерицидную активность нейтрофилов, обладающих фагоцитарной активностью, оценивали с помощью НСТ-теста с нитросиним тетразолием [11, 12].
В процессе изучения параметра фагоцитарной активности наряду с абсолютными показателями биолюминесценции использовали индекс фагоцитарной активности (метод ИФА), позволяющий сопоставлять абсолютные значения, полученные в разных клеточных системах. Достоверность метода подтверждена микроскопическим методом оценки процента фагоцитоза (количество клеток, захвативших один объект фагоцитоза и более из 100 подсчитанных фагоцитов), фагоцитарного числа (количество объектов фагоцитоза, которое в среднем приходится на один из 100 подсчитанных фагоцитов) и фагоцитарного индекса (количество объектов фагоцитоза, которое приходится на один истинный фагоцит) [13].
Антимикробную активность лизоцима как фактора неспецифической резистентности определяли с помощью бактериальной петли в асептических условиях на основе взвеси микроорганизмов на бульоне Мюллера – Хинтона. Оптическая плотность приготовленной бактериальной взвеси при измерении на денситометре соответствовала 0,5 единицы по стандарту мутности МакФарланда, или 1,5 × 108 КОЕ/мл. Метод серийных разведений обеспечивал достоверность полученных результатов. Антимикробную активность лизоцима анализировали на стандартных штаммах Micrococcus lysodeikticus ATCC 4698, Staphylococcus aureus ATCC 29213, Streptococcus pneumoniae ATCC 49619 и Str. agalactiae ATCC 13813 [14].
Статистическую обработку полученных данных осуществляли с использованием программ Micrоsоft Excel 2023 и STATISTICA 10 (StatSоft Inc., США, лицензия № STAФ999K347156W). Тип распределения количественных признаков устанавливали с учетом параметра Р, определяющего достоверные сведения отличий, выделенных на основании характеристик Холмогорова – Смирнова, Вилкоксона. Вычисляли также значения показателя Р1, обеспечивающего достоверные сведения отличий по отношению к группе детей до и после лечения. Для признаков с нормальным распределением рассчитывали среднюю арифметическую (М) и стандартное отклонение (σ). Различия считались статистически значимыми при p ≤ 0,05.
Результаты и обсуждение
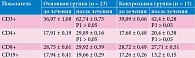
В результате проведенного исследования была доказана эффективность применения в комплексном лечении препарата ВИФЕРОН® гель. Данные анализа показателей клеточного звена иммунитета после лечения представлены в табл. 1.
После проведенной терапии у пациентов, получавших ВИФЕРОН® гель, отмечалось повышение уровня CD3+-лимфоцитов – 62,74 ± 0,75 против 36,97 ± 1,08, CD4+-лимфоцитов – 29,89 ± 0,16 против 17,91 ± 0,19. Значения CD8+ имели тенденцию к повышению, однако различие в показателях до и после терапии недостоверно. Снижение показателей CD19+ наблюдалось в группе детей, находившихся на базисной терапии после лечения.
В показателях CD3+ и CD4+ у детей, получавших стандартную терапию, достоверного различия не выявлено. Зафиксировано лишь небольшое повышение CD3+ после общепринятой терапии – 42,4 ± 0,28 против 39,09 ± 0,66 и повышение CD4+ – 20,4 ± 0,38 против 17,68 ± 0,48 (Р1 > 0,05; р ≤ 0,05).
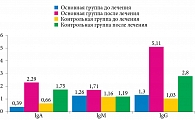
Данные в отношении гуморального звена иммунитета представлены на рис. 3. В основной группе уровни IgA составили 0,39 ± 0,09 и 2,29 ± 0,25 г/л (Р1 > 0,05; р ≤ 0,05), в контрольной – 0,66 ± 0,27 и 1,75 ± 0,06 г/л до и после лечения соответственно (Р1 > 0,05; р ≤ 0,05).
Показатели IgМ незначительно увеличились в группах, где были дети после лечения.
Зарегистрировано также повышение уровня IgG после лечения – 5,11 ± 1,41 против 1,30 ± 0,13 (Р1 > 0,05; р ≤ 0,05).
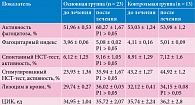
Показатели функциональной активности фагоцитов, фагоцитарного индекса, НСТ-теста, ЦИК и антимикробной активности лизоцима в крови представлены в табл. 2. На фоне применения препарата ВИФЕРОН® гель наблюдалось достоверное повышение активности фагоцитоза – 60,27 ± 1,67 против 51,96 ± 0,53. Кроме того, отмечалось повышение фагоцитарного индекса: 5,08 ± 0,02 против 3,96 ± 0,06 (Р1 > 0,05: р ≤ 0,05).
Значения спонтанного НСТ-теста составили 6,12 ± 1,25 и 9,16 ± 1,05 (Р1 > 0,05; р ≤ 0,5), стимулированного НСТ-теста – 23,93 ± 1,36 и 35,94 ± 1,67 до и после лечения соответственно (Р1 > 0,05; р ≤ 0,05).
До лечения значение активности лизоцима составляло 29,74 ± 0,27, после терапии – 36,02 ± 0,03 (Р1 > 0,05; р ≤ 0,05).
Показатели ЦИК повысились незначительно.
У детей, находившихся на базисной терапии, не выявлено достоверных различий в иммунологических показателях (р ≥ 0,05).
Результатом проведенного лечения стало снижение выраженности симптомов АР, таких как выделения из носа, заложенность носа и чихание. Пациенты констатировали улучшение состояния на восьмой неделе терапии (рис. 4).
Побочных эффектов или нежелательных явлений и осложнений у пациентов основной группы на фоне интерферонотерапии не зафиксировано. У пациентов контрольной группы отмечались незначительные побочные явления при использовании традиционной терапии (сухость и жжение в носовой полости), которые не потребовали специфического или симптоматического лечения и купировались самостоятельно.
Заключение
Полученные результаты позволяют сделать вывод о высокой эффективности препарата рекомбинантного интерферона альфа-2b ВИФЕРОН® гель в комплексе с антиоксидантами при сезонном АР у детей. На восьмой неделе терапии у пациентов основной группы, применявших данный препарат, выраженность симптомов АР уменьшилась в среднем в 2,5 раза. Побочных и иных нежелательных эффектов не наблюдалось. Лечение пациенты переносили хорошо.
Стабилизация иммунограммы и достоверное улучшение иммунологических показателей свидетельствуют о высокой иммуномодулирующей активности рекомбинантного интерферона альфа-2b в терапии сезонного АР у детей разных возрастных групп.
Включение в комплексную терапию АР препарата ВИФЕРОН® гель в комбинации с антигистаминными средствами, глюкокортикостероидами и симптоматическими сосудосуживающими препаратами местного интраназального действия поможет на более качественном, научно обоснованном уровне решить проблему адекватного лечения и профилактики АР у детей.
Авторы заявляют об отсутствии конфликта интересов.
T.B. Kasokhov, PhD, Prof., Artem I. Mazur, Artur I. Mazur, Z.A. Torchinоva
North Ossetian State Medical Academy
Contact person: Timofey B. Kasokhov, kasohov@mail.ru
The article discusses the current aspects of the effectiveness of immunomodulatory therapy for seasonal allergic rhinitis in children. It is known that one of the main factors in the pathogenesis of allergic rhinitis are transient disorders of the mucosal and systemic immunity of the child, therefore, immunotherapy and immunorehabilitation in local climatic conditions may become a promising direction in solving problems of optimizing and improving the effectiveness of treatment and prevention of children with allergic rhinitis. As an immunomodulatory therapy, the authors used a drug of recombinant interferon α-2b with antioxidants – VIFERON® in the dosage form of a gel. The study took place over 13 weeks, from September to November 2023, and involved 36 children aged 4 to 18 years with a diagnosis of allergic rhinitis. During the therapy, there was a significant increase in CD3+ and CD4+ lymphocytes, an increase in plasma levels of IgA, lysozyme fractions, as well as indicators of phagocytic activity of neutrophils and phagocytic index. The results obtained allow us to conclude that the use of the drug VIFERON® is highly effective in the complex treatment of seasonal allergic rhinitis in children.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.