Ксофиго – новое звено в эффективной последовательной схеме лечения метастатического кастрационно-резистентного рака предстательной железы. XII Конгресс Российского общества онкоурологов. Сателлитный симпозиум компании Bayer
- Аннотация
- Статья
- Ссылки



Лечение кастрационно-резистентного рака предстательной железы
Симпозиум открыл член-корреспондент РАН, президент Российского общества онкоурологов, заведующий отделением урологии НИИ клинической онкологии Национального медицинского исследовательского центра онкологии им. Н.Н. Блохина, профессор Всеволод Борисович МАТВЕЕВ. Он проанализировал современные методы лечения кастрационно-резистентного рака предстательной железы (КРРПЖ), акцентировав внимание аудитории на том, что у большинства пациентов с диссеминированным опухолевым процессом в предстательной железе после гормональной терапии заболевание постепенно прогрессирует в форме КРРПЖ.
К критериям КРРПЖ относятся:
- кастрационный уровень тестостерона менее 50 нг/дл, или 1,7 нмоль/л;
- три последовательных повышения уровня простатспецифического антигена (ПСА) с интервалом не менее одной недели, с двумя 50-процентными увеличениями выше надира при уровне ПСА > 2 нг/мл;
- радиологическое прогрессирование: появление двух и более очагов, по данным радиоизотопного сканирования скелета, или увеличение мягкотканного компонента, согласно критериям оценки ответа опухоли на лечение (Response Evaluation Criteria in Solid Tumors – RECIST).
Терапия пациентов с КРРПЖ направлена на подавление патогенетических механизмов развития гормонорефрактерности. В России в первой линии терапии применяют доцетаксел, абиратерон и энзалутамид.
Доцетаксел – первый цитотоксический препарат, продемонстрировавший преимущество в отношении медианы общей выживаемости у пациентов с морфологически подтвержденным метастатическим КРРПЖ.
В исследовании TAX 327 участвовали больные метастатическим КРРПЖ с уровнем тестостерона менее 50 нг/мл, признаками прогрессирования опухолевого процесса, не получавшие антиандрогенов в течение шести недель до начала лечения1. Участники исследования были рандомизированы на три группы:
- доцетаксела 75 мг/м² каждые три недели, десять курсов и преднизолона 5 мг два раза в день постоянно;
- доцетаксела 30 мг/м² еженедельно, пять недель, повторный курс на седьмой неделе, пять курсов и преднизолона 5 мг два раза в день постоянно;
- митоксантрона 12 мг/м² каждые три недели, десять курсов и преднизолона 5 мг два раза в день постоянно.
На фоне применения доцетаксела достоверно увеличилась общая продолжительность жизни пациентов. Помимо этого были достигнуты вторичные цели: уменьшение болевого синдрома и уровня ПСА, объективный ответ при наличии мягкотканных метастазов.
Цитотоксические химиопрепараты характеризуются определенной токсичностью. Согласно данным исследования, в результате гематологической токсичности доцетаксела у пациентов развивалась нейтропения. Тяжелая форма нейтропении – фебрильная нейтропения зарегистрирована только в 2,7% случаев. Ни одного смертельного исхода от сепсиса в группах пациентов, принимавших доцетаксел, не зафиксировано. С негематологической токсичностью, как правило, были связаны слабость, тошнота и диарея.
Кабазитаксел, относящийся к группе таксанов, разработан специально для преодоления резистентности клеток предстательной железы к доцетакселу. Кабазитаксел активен в отношении чувствительных к доцетакселу опухолей. Кроме того, препарат продемонстрировал активность в отношении опухолевых моделей, не чувствительных к химиотерапии, включая доцетаксел.
В клиническом исследовании TROPIC (фаза III) у больных метастатическим КРРПЖ с прогрессированием после предшествующей химиотерапии на основе доцетаксела сравнивали эффективность комбинации кабазитаксела и преднизона/преднизолона и комбинации активного препарата митоксантрона и преднизона/преднизолона. В исследовании участвовали пациенты с обширным метастатическим поражением костей (80%), каждый четвертый больной имел висцеральные метастазы.
Согласно полученным данным, по сравнению с комбинацией митоксантрона и преднизона/преднизолона применение комбинации кабазитаксела и преднизона/преднизолона позволило достоверно снизить риск смерти на 30% (p < 0,0001) и клинически значимо увеличить медиану общей выживаемости с 12,7 до 15,1 месяца. Кроме того, при использовании кабазитаксела и преднизона/преднизолона достоверно увеличилась медиана выживаемости без прогрессирования – 2,8 месяца (1,4 месяца в группе митоксантрона и преднизона/преднизолона) (p < 0,0001)2.
Самыми частыми гематологическими неблагоприятными явлениями 3–4-й степени при применении кабазитаксела были нейтропения (81,7%) и фебрильная нейтропения (7,5%), негематологическими – тошнота (1,9%), рвота (1,9%) и диарея (6%).
Попытки улучшить результаты лечения больных метастатическим КРРПЖ подтолкнули ученых к проведению рандомизированного открытого исследования FIRSTANA. В нем сравнивали два режима терапии кабазитакселом 20 и 25 мг/м2 на фоне стандартного назначения доцетаксела 75 мг/м2 в первой линии терапии. Медианы выживаемости без прогрессирования и общей выживаемости между группами оказались сопоставимы. Однако в группе пациентов, получавших кабазитаксел 25 мг/м2, частота объективных ответов была достоверно выше3.
Таким образом, доцетаксел остается препаратом первой линии терапии, а кабазитаксел – препаратом второй линии химиотерапии у пациентов с метастатическим КРРПЖ.
При КРРПЖ применяют специфический ингибитор биосинтеза тестостерона – абиратерона ацетат. Являясь предшественником действующего вещества абиратерона, ингибирующего цитохром Р450 с17 (CYP17), абиратерона ацетат подавляет синтез андрогенов в надпочечниках, яичках и непосредственно в ткани предстательной железы. При использовании абиратерона достоверно увеличивается общая выживаемость, уменьшаются болевой синдром и количество костных осложнений. Препарат хорошо переносится пациентами.
В рандомизированном плацебоконтролируемом двойном слепом исследовании COU-AA-301 (фаза II) с участием больных метастатическим КРРПЖ, ранее получавших таксаны, в группе абиратерона ацетата медиана общей выживаемости достигла 14,8 месяца. В группе плацебо этот показатель составил 10,9 месяца. Показано, что абиратерон значимо снижает болевой синдром и увеличивает период до развития костных метастазов. Нежелательные явления, как правило, связаны с последствиями усиления выработки альдостерона в надпочечниках, что клинически выражается задержкой жидкости, артериальной гипертензией, гипокалиемией4.
В исследовании COU-AA-302 (фаза III) изучали эффективность и безопасность абиратерона ацетата в первой линии терапии у пациентов с метастатическим КРРПЖ, ранее не получавших химиотерапии. Пациентам первой группы назначали абиратерон и преднизолон, второй – плацебо и преднизолон. В отличие от второй группы в первой достоверно снизился риск смерти. Медиана выживаемости без прогрессирования в группе абиратерона в два раза превысила таковую в группе плацебо – 16,5 против 8,2 месяца соответственно5.
Сказанное свидетельствует о наличии предпосылок для назначения абиратерона не только во второй, но и в первой линии терапии пациентов с метастатическим КРРПЖ.
Энзалутамид – мощный ингибитор андрогенных рецепторов, блокирующий несколько этапов сигнального пути андрогенных рецепторов. Он характеризуется высокой аффинностью к андрогенным рецепторам, способностью ингибировать их транслокацию в ядро клетки и блокировать связывание андрогенных рецепторов с ДНК, предупреждая модуляцию экспрессии гена.
Эффективность энзалутамида изучали в ряде клинических исследований.
В двойном слепом плацебоконтролируемом рандомизированном исследовании AFFIRM (фаза III) участвовали 1199 пациентов с прогрессирующим метастатическим КРРПЖ, ранее применявших доцетаксел. Первичная цель исследования – общая выживаемость пациентов на фоне приема энзалутамида по сравнению с группой плацебо. На фоне применения энзалутамида отмечалось статистически достоверное увеличение медианы общей выживаемости по сравнению с плацебо – на 4,8 месяца и снижение риска прогрессирования – на 60%, согласно результатам рентгенологического исследования. У пациентов, получавших энзалутамид, риск прогрессирования боли уменьшился на 44%6.
В плацебоконтролируемом рандомизированном исследовании PREVAIL (фаза III) изучали безопасность и эффективность энзалутамида в первой линии терапии 1717 пациентов с прогрессирующим метастатическим КРРПЖ, ранее не получавших химиотерапии7. По сравнению с группой плацебо в группе энзалутамида зафиксированы увеличение медианы радиологической выживаемости без прогрессирования и достоверное увеличение общей выживаемости.
На основании данных исследований препарат энзалутамид включен в стандарты лечения метастатического КРРПЖ.
В клинической онкологической практике используются разные варианты радиоизотопной терапии. По словам профессора В.Б. Матвеева, исторически тропные к костной ткани изотопы изучались в клинических исследованиях как средство купирования болевого синдрома при костных метастазах. В клинической практике применяются стронций-89 и самарий-153 – тропные к костной ткани изотопы с бета-излучением. Однако вследствие относительно длинной волны излучения бета-частиц при использовании бета-изотопов поражается костный мозг. От бета-частиц альфа-излучатели отличаются максимальной длиной волны, которая обычно не превышает 100 нм. Отношение дозы облучения костной ткани к костному мозгу может быть потенциально увеличено в три раза при замене бета-излучателя на альфа-излучатель8.
Альфа-излучатель радий-223, действующий как остеотропный агент, характеризуется хорошим гематологическим профилем токсичности. Период полураспада радия-223 – 11,4 дня, что выгодно отличает его от других представителей альфа-излучателей, таких как радий-226 (1601 год)9.
Препарат радия-223 (Ra-223) применяли в рандомизированном плацебоконтролируемом клиническом исследовании ALSYMPCA (фаза III) у больных метастатическим КРРПЖ с симптоматическими костными метастазами. Результаты показали значимое увеличение общей выживаемости в группе пациентов, получавших терапию Ra-223, по сравнению с плацебо (14,9 и 11,3 месяца соответственно). Кроме того, показатели выживаемости не зависели от предшествующей химиотерапии доцетакселом10. На основании подтвержденной в исследовании эффективности Ra-223 (Ксофиго) в лечении больных метастатическим КРРПЖ препарат включен в рекомендации ведущих медицинских сообществ, таких как Европейское общество медицинской онкологии (ESMO), Национальная всеобъемлющая онкологическая сеть США (NCCN), Европейская ассоциация урологов (EAU).
В заключение профессор В.Б. Матвеев подчеркнул, что методы лечения КРРПЖ с каждым годом совершенствуются, поэтому нельзя определить оптимальную последовательность назначения новых препаратов.
Лечение пациентов с КРРПЖ требует персонализированного подхода. В отсутствие доказанных преимуществ той или иной последовательности предпочтение надо отдавать наименее токсичному и хорошо переносимому препарату в качестве терапии первой линии.
Ra-223: механизм действия. Исследование ALSYMPCA
Доктор Joan CARLES из отделения онкологии Университетской клиники Валь д’Эброн (Барселона, Испания) (Vall d’Hebron University Hospital, Oncology Department) в своем докладе затронул вопросы таргетной терапии метастатического КРРПЖ альфа-частицами. Он подчеркнул, что за последние несколько лет лечение рака, особенно рака предстательной железы, существенно изменилось. Сегодня известно, что таргетная альфа-терапия при ее минимальной токсичности обеспечивает доставку системного излучения выборочно к раковым клеткам и микроокружению опухоли для контроля рака11.
Препарат на основе радия хлорида (Ra-223) обладает уникальным механизмом действия и эффективен при метастатическом КРРПЖ. Важным свойством препарата является способность связываться с ионами кальция. В организме кальций концентрируется прежде всего в костной ткани. Ra-223, внедряясь в кристаллы гидроксиапатита – основного минерального вещества ткани, направленно воздействует на метастазы в кости.
По данным исследований, у больных КРРПЖ с метастазами в костной ткани однократная инъекция Ra-223 незамедлительно воздействует на опухолевые клетки, остеобласты и остеокласты. Высокий уровень линейной передачи энергии альфа-излучателей обеспечивает высокую частоту разрывов двухцепочечных ДНК в прилегающих опухолевых клетках. Как следствие – мощный цитотоксический эффект уже через 24 часа после введения Ra-22312. Таргетное воздействие препарата Ra-223 (Ксофиго) на опухолевые клетки обусловлено наличием источника альфа-лучей низкой частоты и высокой мощности.
Докладчик проанализировал результаты международного проспективного рандомизированного исследования ALSYMPCA (фаза III).
В исследовании участвовал 921 больной метастатическим КРРПЖ с симптоматическими костными метастазами. Критериями включения в исследование были наличие, по данным визуализации, более двух метастазов в скелете, отсутствие висцеральных метастазов. В исследовании участвовали так называемые хемонаивные пациенты и те, кто ранее получал химиотерапию доцетакселом. Больных рандомизировали на две группы – группу Ra-223 (Ксофиго) 50 КБк/кг (шесть инъекций с четырехнедельным интервалом) и наилучшей стандартной терапии и группу плацебо и стандартного лечения13. Первичная конечная точка исследования – общая выживаемость, ключевые вторичные конечные точки – время до первого симптомного события со стороны скелета (ССС), безопасность, уровень качества жизни.
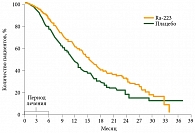
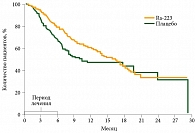
В исследовании ALSYMPCA на фоне приема препарата Ra-223 медиана общей выживаемости увеличилась на 3,6 месяца (рис. 1). При этом эффективность и безопасность не зависели от предшествующего назначения доцетаксела. Время до первого ССС после применения Ra-223 превысило таковое при использовании плацебо – 15,6 и 9,8 месяца соответственно (рис. 2).
Оценка качества жизни больных метастатическим КРРПЖ с помощью модульного опросника FACT-P продемонстрировала, что в большинстве случаев снизилась интенсивность болевого синдрома и улучшилось общее самочувствие. На фоне применения Ксофиго отмечались в основном легкие и незначительные побочные эффекты.
«Результаты рандомизированного исследования наглядно показали, что пациенты, получавшие экспериментальное лечение препаратом Ксофиго, подвергались токсичности в меньшей степени, чем больные, применявшие плацебо. Это очень важно для показаний безопасности и эффективности препарата», – констатировал доктор J. Carles.
Результаты исследования ALSYMPCA были подтверждены в международном проспективном открытом исследовании EAP (фаза IIIb), проведенном в США в условиях реальной клинической практики. В исследовании участвовали пациенты с метастатическим КРРПЖ как с симптомами костных метастазов, так и без симптомов. В исследование не включались пациенты с метастазами в легких и головном мозге. Больным назначали Ra-223 – шесть инъекций с четырехнедельным интервалом, а также стандартную терапию14. Ключевыми конечными точками исследования были безопасность терапии Ra-223, качество жизни пациентов, общая выживаемость. По окончании терапии осуществлялось шестимесячное наблюдение за пациентами для оценки безопасности.
В исследовании EAP в целом зафиксирована хорошая переносимость препарата Ra-223. Проблем с безопасностью терапии, отличных от таковых в исследовании ALSYMPCA, не наблюдалось. Медианы общей выживаемости в исследованиях EAP и ALSYMPCA были сопоставимы – 16 и 14,9 месяца соответственно.
Предварительные данные ретроспективных анализов продемонстрировали улучшение показателей общей выживаемости у пациентов, получавших Ra-223 и сопутствующую терапию деносумабом или абиратероном. Полученные данные требуют дальнейшего изучения и подтверждения в клинических исследованиях.
Докладчик рассмотрел тактику лечения метастатического КРРПЖ на конкретных примерах.
Больной А., 83 года. Диагноз: ранняя стадия метастатического КРРПЖ. В августе 1993 г. отмечалось повышение уровня ПСА до 13 нг/мл. У пациента выявлена аденокарцинома. Индекс Глисона – 7 (4 + 3). Выполнена радикальная простатэктомия (T3aN0M0). Через три месяца после операции уровень ПСА снизился относительно исходного. В апреле 1996 г. имел место рецидив, уровень ПСА увеличился до 4,5 нг/мл. Проведена консервативная лучевая терапия тазовой области. Уровень ПСА по окончании терапии – 0,4 нг/мл. Спустя два года вновь наблюдалось повышение уровня ПСА до 12 нг/мл. Больному выполнена интермиттирующая антиандрогенная терапия с последующим биохимическим ответом – ПСА – 0,5 нг/мл. В марте 2012 г. уровень ПСА увеличился до 4,4 нг/мл. Пациенту проведена биопсия, подтверждено наличие аденокарциномы – рецидив рака предстательной железы. Назначены паллиативная лучевая терапия седалищно-лобковой области и продолжение антиандрогенной терапии. Из-за развития метастатического КРРПЖ у пациента с поражением костей в июле 2013 г. начата терапия препаратом Ra-223. Уже после второго цикла его приема болевой синдром был купирован. После четвертого цикла уровни щелочной фосфатазы и ПСА составили 83 Ед/л и 0,2 нг/мл соответственно. В январе 2014 г. по завершении терапии препаратом Ra-223 у больного отмечалось стабильное состояние. В июне 2015 г. у пациента возникла боль в спине. Проведена паллиативная лучевая терапия на метастаз в области спины. В ноябре 2016 г. зафиксировано клиническое прогрессирование заболевания (ПСА – 11,6 нг/мл, щелочная фосфатаза – 104 Ед/л, кальций – 9,4 мг/дл). Назначена терапия энзалутамидом, на фоне которой общее состояние больного улучшилось, боль в спине исчезла. На данный момент больной находится в стабильном состоянии.
Больной С., 59 лет. В декабре 2014 г. появилась боль в пояснице. Уровень ПСА – 1,1 нг/мл, щелочной фосфатазы – 2028 Ед/л, кальция – 9 мг/дл. Сцинтиграфия скелета и компьютерная томография продемонстрировали наличие метастазов в кости. Магнитно-резонансная томография (МРТ) выявила компрессию нервных корешков S1–S2. Диагноз: поздняя стадия метастатического КРРПЖ. По результатам биопсии – индекс Глисона 4 + 4. Пациенту назначены антиандрогенная терапия, лучевая терапия на область крестца. В феврале 2015 г. симптомы заболевания отсутствовали. Больной начал получать доцетаксел (75 мг/м2). Уровень тестостерона – 28,76 нмоль/л, ПСА – 277 нг/мл. В мае 2015 г. у пациента развились обусловленные химиотерапией алопеция 2-й степени и нейропатия 1-й степени. Он получил шесть циклов доцетаксела. Уровень тестостерона – 17 нмоль/л, ПСА – 10 нг/мл. В декабре 2015 г., по данным сцинтиграфии и анализов крови, отмечалось прогрессирование заболевания (ПСА – 587,45 нг/мл, щелочная фосфатаза – 1112 Ед/л). Пациенту назначили кабазитаксел 25 мг/м2. На фоне терапии уровни ПСА и щелочной фосфатазы снизились. Данные сцинтиграфии свидетельствовали о стабильном состоянии. Результаты компьютерной томографии (КТ) показали отсутствие метастазов в лимфатических узлах и внутренних органах. Однако после начала очередного прогрессирования метастатического процесса больному назначили терапию препаратом Ra-223. После начала терапии болевой синдром и симптомы заболевания были купированы. Пациент продолжает работать и сохраняет повседневную активность. Данные сцинтиграфии скелета и компьютерной томографии показали отсутствие новых метастазов.
Таким образом, результаты проведенных исследований и клинический опыт показывают, что у пациентов с метастатическим раком предстательной железы на фоне применения препарата Ra-223 (Ксофиго) увеличивается продолжительность жизни, снижаются проявления болевого синдрома и улучшается самочувствие.
Российский опыт применения Ra-223
Заведующий отделением радиохирургического лечения открытыми радионуклидами Медицинского радиологического научного центра им. А.Ф. Цыба (филиал Национального медицинского исследовательского центра радиологии Минздрава России), д.м.н. Валерий Васильевич КРЫЛОВ рассказал об опыте применения препарата Ra-223 в России.
Использовать радий в быту и терапии различных заболеваний начали еще в прошлом столетии. Его добавляли в косметические средства (губную помаду, шампунь, крем, пудру), поскольку считалось, что радиоактивные вещества улучшают состояние здоровья и стимулируют клетки организма. Первый опыт медицинского применения радиоактивных источников был связан с брахитерапией, лечением заболеваний суставов. В течение многих десятилетий радий применяли в лечении пациентов со злокачественными опухолями.
Рак предстательной железы – наиболее распространенная опухоль мочеполовой системы у мужчин. Причем в большинстве случаев развиваются костные метастазы, в том числе множественные. Развитие ассоциированных со скелетом осложнений (выраженный болевой синдром, патологические переломы, компрессия спинного мозга и др.) значительно снижает продолжительность и качество жизни больных раком предстательной железы с метастазами в костной ткани.
Алгоритм лечения пациентов с метастатическим поражением костей предусматривает дистанционную лучевую терапию, применение бисфосфонатов, химиотерапию, гормонотерапию, симптоматическое лечение (обезболивающие препараты и др.), хирургическое лечение, радионуклидную терапию. Показания и противопоказания к применению радионуклидной терапии аналогичны таковым разных радиофармпрепаратов. Радионуклидная терапия в случае костных метастазов показана при наличии:
- множественных метастазов в кости;
- болевого синдрома;
- прогрессирования костных метастазов на фоне лечения;
- позитивных результатов остеосцинтиграфии (активное накопление в метастазах диагностических остеотропных препаратов с 99mTc).
Радионуклидная терапия при костных метастазах противопоказана в случае:
- прогрессирующего снижения показателей крови (уровни тромбоцитов < 100 × 109/л, лейкоцитов < 2,5 × 109/л, гемоглобина < 90 г/л);
- тяжелого общего состояния, статуса активности по Карновскому < 60, прогноза выживания менее двух месяцев;
- тяжелой коагулопатии;
- угрозы патологического перелома и компрессии спинного мозга;
- планируемой миелосупрессивной терапии;
- быстрого развития внекостных метастазов (например, метастазы в печени, легких, головном мозге)15.
Чтобы начать радионуклидную терапию, необязательно ждать возникновения манифестирующего болевого синдрома, прогрессирования симптомов костного метастазирования на всех этапах предыдущего лечения. Современные радиофармацевтические препараты должны обладать остеотропным действием, оказывать выраженный цитотоксический эффект на метастатические очаги и таргетно влиять на участки ремоделирования костной ткани. Использование остеотропных радиофармпрепаратов приводит к длительному обезболиванию и в ряде случаев позволяет достичь редукции опухоли.
В российской клинической практике в целях паллиативной терапии костных метастазов активно используют остеотропные радиофармпрепараты на основе 153Sm (оксабифор) и 89Sr-хлорид. Разработаны новые радиофармпрепараты на основе 188Re (фосфорен и золерен). Профиль токсичности и скорость начала действия всех перечисленных препаратов различны.
Для больных КРРПЖ с множественными симптомными метастазами в кости скелета создан препарат на основе Ra-223. Ra-223 – излучатель альфа-частиц с дистанцией распространения в тканях < 100 мкм. Период полураспада Ra-223 – 11,4 дня. Ra-223 действует как остеотропный агент и имеет хороший гематологический профиль токсичности. Препарат оказывает дополнительное воздействие на микросреду опухоли, обладает благоприятным биораспределением. Максимальное накопление в костях Ra-223 достигается через 24 часа после применения.
Экскреция Ra-223 происходит в основном через кишечник, поэтому препарат не относится к нефротоксичным или гепатотоксичным.
Докладчик подчеркнул, что в ряде широкомасштабных рандомизированных исследований III фазы доказано увеличение продолжительности жизни больных КРРПЖ на фоне лечения препаратом Ra-223. При сравнении Ra-223 с другими радионуклидными методами лечения пациентов с множественными метастазами в кости подтверждены его положительное влияние на общую выживаемость больных, безопасность, удобство применения, перевозки и хранения.
Согласно современным рекомендациям, у пациентов с преимущественным поражением костей в отсутствие висцеральных метастазов можно применять Ra-223 до этапа химиотерапии16.
В исследовании ALSYMPCA (фаза III) показано достоверное преимущество Ra-223 перед плацебо в лечении пациентов с метастатическим КРРПЖ. Обновленный анализ результатов исследования подтвердил данные промежуточного анализа о 30%-ном снижении риска смерти в группе Ra-223 по сравнению с группой плацебо. Показатели активности в повседневной деятельности и качества жизни пациентов также были выше в группе Ra-223. Наиболее частым проявлением гематологической токсичности была анемия (31%), реже встречались тромбоцитопения (12%) и нейтропения (5%). В целом терапия Ra-223 характеризовалась низким уровнем миелотоксичности и незначительными побочными эффектами по сравнению с плацебо.
В.В. Крылов акцентировал внимание на критериях отбора пациентов для проведения радионуклидной терапии препаратом на основе Ra-223. Терапия на основе этого препарата показана прежде всего больным КРРПЖ с костными метастазами и отсутствием подтвержденных висцеральных метастазов. Перед проведением терапии необходима оценка функции печени и почек. Непременное условие использования радионуклидного метода – мониторинг состояния пациентов между циклами терапии.
Для выявления и оценки метастатических костных поражений используют сцинтиграфию, позитронно-эмиссионную томографию (ПЭТ), КТ, МРТ и рентгенологическое исследование. Исходя из критериев RECIST, сцинтиграфия, ПЭТ и рентгенограммы непригодны для адекватного измерения размеров костных очагов. Однако эти методы могут использоваться для отслеживания количества очагов метастазирования. Литические или смешанные метастазы с определяемыми мягкотканными компонентами, по данным КТ и МРТ, могут применяться для оценки динамики на основании изменений размеров определяемого мягкотканного компонента. Бластические костные метастазы неизмеримы.
Рекомендуемый алгоритм оценки динамики костных очагов у больных КРРПЖ включает изучение уровней ПСА, щелочной фосфатазы, лактатдегидрогеназы в крови и клиническую оценку симптомов перед проведением очередного цикла терапии (один раз в три-четыре недели). Каждые 12 недель больным необходимо выполнять диагностическую сцинтиграфию костей, КТ или МРТ.
Таким образом, динамика костных метастазов определяется по трем параметрам – клиническим симптомам, биохимическим маркерам и радиологическим изменениям (МРТ, КТ и др.). О наличии той или иной динамики можно судить по изменениям двух-трех параметров оценки состояния больных с костными метастазами. Такой подход обеспечивает более точные представления о динамике заболевания и позволяет дифференцировать эффект обострения от прогрессирования.
Докладчик привел клинический случай.
Пациент 1959 года рождения с метастатическим КРРПЖ. При проведении 2 октября 2012 г. биопсии выявлена аденокарцинома предстательной железы – 8 (4 + 4) баллов по шкале Глисона. По данным мультиспиральной КТ – тотальное метастатическое поражение костей по склеротическому типу. С октября 2012 г. по июль 2014 г. пациент получал Элигард 22,5 мг три месяца, бикалутамид 150 мг/сут. С февраля 2014 г. отмечалось прогрессирование заболевания. Уровень ПСА – 63,2 нг/мл. Результаты спиральной КТ подтвердили наличие множественных диффузных метастазов во всех отделах скелета, рак предстательной железы Т3b без поражения лимфоузлов и висцеральных органов. Болевой синдром умеренной интенсивности. Больному назначены ибупрофен 800 мг/сут и терапия Ra-223. После первых циклов терапии Ra-223 наблюдался выраженный эффект – частичный метаболический ответ, по данным остеосцинтиграфии, полный биохимический ответ. Время до прогрессирования заболевания по завершении терапии – полтора года. При этом перерыв в лечении между вторым и третьим циклами составил 5,5 месяца, что не оказало негативного влияния на результаты лечения. Кроме того, вынужденный перерыв в лечении позволил восстановить процесс кроветворения, снизив тем самым риск гематологических осложнений. В результате удалось провести все шесть циклов терапии Ra-223.
Таким образом, один из наиболее простых в использовании и безопасных современных остеотропных радиофармпрепаратов Ra-223 (Ксофиго) увеличивает продолжительность жизни пациентов с метастатическим КРРПЖ.
Заключение
Для больных КРРПЖ с множественными симптомными метастазами в кости скелета разработан новый радиофармацевтический препарат дихлорид радия-223 – Ксофиго (компания «Байер»). Это таргетный радиофармпрепарат, альфа-излучающий изотоп щелочноземельного металла радия. Применение Ксофиго способствует «поломкам» в структуре ДНК опухолевых клеток и приводит к выраженному местному цитотоксическому эффекту на метастатические очаги. Препарат имитирует кальций и образует соединения с гидроксиапатитом в участках ремоделирования костей при метастазах в костной ткани.
По данным крупномасштабных рандомизированных исследований III фазы, терапия Ra-223 характеризуется низким уровнем миелотоксичности и незначительным количеством побочных эффектов по сравнению с плацебо. Терапия препаратом на основе Ra-223 Ксофиго позволяет не только увеличить продолжительность жизни больных метастатическим КРРПЖ с метастазами в кости скелета, но и улучшить качество их жизни.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.