Лечение тяжелой бронхиальной астмы: текущие опции и новые возможности. XVIII Национальный конгресс по болезням органов дыхания. Сателлитный симпозиум компании «Санофи»
- Аннотация
- Статья
- Ссылки






Т2-астма (Type-2 asthma) – фенотип, эндотип или другое? Место термина в современной системе знаний о бронхиальной астме
Характерным признаком бронхиальной астмы (БА) является хроническое воспаление дыхательных путей1. Как отметил заведующий кафедрой пульмонологии Московского государственного медицинского университета им. И.М. Сеченова, член-корреспондент РАН, д.м.н., профессор Сергей Николаевич АВДЕЕВ, воспаление приводит к патофизиологическим последствиям – гиперреактивности, ремоделированию дыхательных путей, бронхиальной обструкции и обострениям заболевания2.
Концепция воспаления при БА в последнее время претерпела значительные изменения, обусловленные пониманием гетерогенности заболевания. Кроме того, сегодня БА следует рассматривать с позиции не только контроля, но и тяжести. Как известно, чем тяжелее астма, тем ниже контроль.
По мнению докладчика, особую озабоченность специалистов вызывают пациенты с тяжелой БА. По данным национального исследования НИКА (2011 г.), таковых не более 10% всех пульмонологических больных, но именно данная группа пациентов требует наиболее сложных лечебных подходов3.
В международном руководстве GINA (Global Initiative for Asthma, пересмотр 2018 г.) предусмотрен ступенчатый подход к лечению пациентов с БА. Терапия подразделяется на пять ступеней (этапов):
- 1-я ступень: короткодействующие бета-2-агонисты (КДБА) по требованию;
- 2-я ступень: плюс ингаляционные глюкокортикостероиды (ИГКС);
- 3-я ступень: плюс длительно действующие бета-2-агонисты (ДДБА);
- 4-я ступень: плюс тиотропия бромид и/или другие препараты для базисной терапии;
- 5-я ступень: выбор лечения на основе фенотипов.
Терапия на основе фенотипа БА (5-я ступень) позволяет обеспечить персонифицированный подход к ведению пациентов с астмой.
По словам профессора С.Н. Авдеева, следует избегать путаницы в определении понятия фенотипа. «Сегодня мы говорим не просто о фенотипах в контексте заболеваний, а о клинических фенотипах», – уточнил он. Клинический фенотип – это по сути признак заболевания или комбинация признаков, описывающих клинические различия между группами пациентов, во многом определяющие клинические исходы заболевания. Еще одним ключевым понятием является эндотип – подтип заболевания, характеризующийся уникальным или отличительным патогенетическим/молекулярным механизмом, определяющим ответ на лечение4. Таким образом, клинический фенотип и эндотип – два ключевых понятия, предопределяющие выбор терапии.
Согласно GINA-2018, наиболее распространенными фенотипами БА являются аллергическая, неаллергическая, астма с поздним дебютом, астма с фиксированной бронхиальной обструкцией, астма, ассоциированная с ожирением. Поскольку в настоящее время БА рассматривается как гетерогенное заболевание, она может быть разделена на два больших эндотипа: БА, обусловленная воспалением второго типа (Т2-астма), и БА, не связанная с воспалением 2-го типа (не-Т2-астма)5–7.
БА, связанная с воспалением 2-го типа, ассоциируется с эозинофильным и/или аллергическим фенотипом. Бронхиальная астма, не связанная с воспалением 2-го типа, характеризуется поздним началом, и ее фенотипы ассоциируются с ожирением, курением, нейтрофильным воспалением5–7.
Сегодня в фокусе внимания пульмонологов прежде всего Т2-астма, характер воспаления при которой обусловлен повышенной экспрессией цитокинов 2-го типа (T2-цитокинов). К цитокинам второго типа относятся интерлейкины (ИЛ) 4, 5, 13. Это ключевые цитокины, играющие главную роль в патогенезе воспаления 2-го типа, лежащего в основе развития Т2-астмы.
У значительной доли пациентов (50–70%) отмечается эндотип астмы с высоким уровнем экспрессии Т2-цитокинов ИЛ-4, ИЛ-13, ИЛ-5, характеризующийся иммунным ответом 2-го типа. При определении Т2-эндотипа астмы следует обращать внимание на эозинофилию крови, тканевую эозинофилию, повышение уровня иммуноглобулина (Ig) E в сыворотке крови, уровень оксида азота, наличие сопутствующих заболеваний со стороны полости носа, атопического дерматита8–11.
Больные БА с высоким уровнем экспрессии Т2-цитокинов отвечают на терапию глюкокортикостероидами (ГКС). Между тем при тяжелой форме Т2-астмы нередко приходится прибегать к так называемой биологической терапии. «Определяя эти понятия сегодня, мы все больше уходим в сторону персонализированной медицины»,– констатировал профессор С.Н. Авдеев.
Гетерогенность бронхиальной астмы. Современные подходы к лечению тяжелой бронхиальной астмы
В соответствии с отечественными руководствами и рекомендациями GINA, тяжелая бронхиальная астма требует назначения терапии четвертой-пятой ступени. По словам профессора кафедры клинической аллергологии Российской медицинской академии непрерывного профессионального образования (РМАНПО), д.м.н. Натальи Михайловны НЕНАШЕВОЙ, это предусматривает включение в алгоритм лечения высоких доз ингаляционных ГКС (ИГКС) и ДДБА или антилейкотриеновых препаратов/теофиллина. Иногда пациентам назначают системные ГКС. Тем не менее, несмотря на применяемую терапию, пациенты с тяжелой БА не всегда достигают контроля12.
Тяжелая БА гетерогенна, и определение ее фенотипов необходимо для назначения целевой (таргетной) терапии. В американской исследовательской программе по изучению тяжелой БА (Severe Asthma Research Program – SARP) представлены пять кластеров, или пять фенотипов БА, но только три из них соответствуют тяжелой астме13:
- тяжелая астма с поздним началом (характеризуется повышенным индексом массы тела и повышенным уровнем эозинофилов);
- аллергическая БА (отличается ранним дебютом, вариабельностью течения с обострениями и повышенным уровнем эозинофилов);
- астма с тяжелой фиксированной обструкцией (самый сложный фенотип, встречается у лиц пожилого возраста с выраженным снижением объема форсированного выдоха за первую секунду (ОФВ1), характеризуется нейтрофильным и эозинофильным воспалением).
Известно множество фенотипов астмы и как минимум два эндотипа. Эндотип – подтип заболевания, который определяется отличительным функциональным или патобиологическим механизмом. В настоящее время выделяют два эндотипа астмы – Т2 и не-Т2. Один эндотип может включать несколько фенотипов астмы, поскольку на формирование фенотипа, в частности, влияют окружающая среда и коморбидность.
Как уже отмечалось, аллергическая астма с ранним дебютом заболевания и эозинофильная астма с поздним началом – два больших фенотипа Т2-астмы. Поздняя эозинофильная астма нередко ассоциируется с полипозным риносинуситом, непереносимостью нестероидных противовоспалительных препаратов. В реальной клинической практике два указанных фенотипа сочетаются не менее чем в 30% случаев. Тогда можно говорить о смешанной БА.
Таким образом, Т2-астму отличают эозинофильное воспаление, наличие аллергенспецифических IgE, бронхиальная гиперреактивность и ремоделирование. В формировании Т2-эндотипа участвуют Th2-клетки и тучные клетки, эпителиальные и врожденные лимфоидные клетки 2-го типа (ILC2). Эти клетки вырабатывают цитокины, характерные для иммунного ответа 2-го типа, – ИЛ-4, ИЛ-5, ИЛ-9, ИЛ-1314.
Инициаторами воспалительного иммунного ответа 2-го типа являются клетки и медиаторы воспаления, относящиеся к механизмам врожденного и адаптивного иммунитета. Th2 и ILC2 не только передают сигнал воспаления эффекторным клеткам посредством секреции ИЛ-4, ИЛ-13 и ИЛ-5, но и модулируют его.
Цитокины ИЛ-4, ИЛ-13 и ИЛ-5 регулируют иммунный ответ 2-го типа, а функции ИЛ-4 и ИЛ-13 частично дублируют друг друга. ИЛ-4 способствует активации В-лимфоцитов и переключению синтеза на изотип IgE, направленной миграции эозинофилов и дифференцировке наивного Т-лимфоцита в Т-лимфоцит хелпер 2-го типа. ИЛ-13 участвует в активации В-лимфоцитов и переключении синтеза на изотип IgE, а также в ремоделировании дыхательных путей, гиперплазии бокаловидных клеток и гиперпродукции слизи, способствует сокращению и пролиферации гладкомышечных клеток, направляет миграцию эозинофилов в ткани. ИЛ-5 активирует эозинофилы крови, способствует их дифференцировке и выживанию7, 15.
ИЛ-4 и ИЛ-13 считаются центральными сигнальными молекулами в патогенезе воспаления 2-го типа. В ответ на эти сигнальные молекулы происходит активация эффекторных клеток, в частности клеток гладких мышц бронхов, клеток эпителия дыхательных путей, иммунных клеток. Взаимодействие ИЛ-4 и ИЛ-13 со специфическими рецепторами, а именно альфа-субъединицей рецептора ИЛ-4, приводит к активации этих клеток и экспрессии цитокинов 2-го типа, хемокинов, активации дополнительных воспалительных путей. Не случайно ИЛ-4 и ИЛ-13 служат основными мишенями при терапии БА, обусловленной иммунным ответом 2-го типа16.
В России и за рубежом для биологической терапии БА зарегистрированы омализумаб (моноклональное анти-IgE-антитело), реслизумаб (моноклональное антитело к ИЛ-5), меполизумаб (моноклональное антитело к ИЛ-5). Ожидается регистрация бенрализумаба – моноклонального антитела к рецептору ИЛ-5. Однако данные биологические препараты не влияют на центральные сигнальные молекулы ИЛ-4 и ИЛ-13. В связи с этим особый интерес представляют молекулы, влияющие на ИЛ-4: антагонист альфа-субъединицы рецептора ИЛ-4 – дупилумаб. Как уже отмечалось, ИЛ-4 и ИЛ-13 связываются с общей субъединицей рецептора ИЛ-4Rα. Дупилумаб представляет собой человеческое рекомбинантное моноклональное антитело IgG4, которое связывается с ИЛ-4Rα и блокирует сигнальные пути как ИЛ-4, так и ИЛ-13. Поскольку у сигнальных путей ИЛ-4 и ИЛ-13 есть специфические и частично дублирующие друг друга функции, блокада с помощью дупилумаба уменьшает каскад воспаления, опосредованный T2-клетками15.
Эффективность дупилумаба при тяжелой БА оценивали в ряде клинических исследований, в частности в международном исследовании фазы III Liberty Asthma QUEST. В нем участвовали и сотрудники кафедры клинической аллергологии РМАНПО. Всего в исследование Liberty Asthma QUEST было включено 1902 пациента с тяжелой БА. Основные критерии включения:
- использование ИГКС в средней или высокой дозе + один-два дополнительных препарата базисной терапии;
- пребронходилатационное значение (преБД) ОФВ1 ≤ 80% прогнозируемого значения для взрослых;
- ACQ-5 ≥ 1,5;
- степень обратимости ОФВ1 ≥ 12%;
- наличие более одного курса лечения системным ГКС или случая госпитализации/вызова скорой помощи по поводу обострения БА.
Пациенты включались в исследование на основании клинических критериев независимо от уровня каких-либо биомаркеров Т2-воспаления (эозинофилов, IgE и др.). Пациенты были разделены на группы: дупилумаб 200 мг, дупилумаб 300 мг, плацебо 200 мг и плацебо 300 мг (инъекции один раз в две недели). Исследование продолжалось 52 недели с последующим наблюдением до 64-й недели или переходом в открытое продолженное исследование17, 18.
Первичной конечной точкой служили годовая частота тяжелых обострений БА за 52 недели и абсолютное изменение преБД ОФВ1 на 12-й неделе по сравнению с исходным значением. Вторичные основные конечные точки – годовая частота тяжелых обострений за 52 недели у пациентов с уровнем эозинофилов ≥ 150 и ≥ 300 кл/мкл, абсолютное изменение преБД ОФВ1 на 12-й неделе у пациентов с уровнем эозинофилов ≥ 150 и ≥ 300 кл/мкл, изменение балльной оценки по ACQ-5 и общего балла по AQLQ на 24-й неделе по сравнению с исходным значением, приведенная к годовому показателю частота тяжелых обострений БА, ставших причиной госпитализации/вызова скорой помощи.
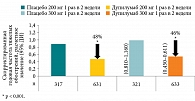
Результаты исследования показали статистически значимое преимущество дупилумаба в обеих дозах перед плацебо в снижении частоты тяжелых обострений у пациентов с неконтролируемой персистирующей БА (рис. 1).
Дупилумаб в дозе 200 мг снижал частоту тяжелых обострений БА на 48%, а в дозе 300 мг – на 46% по сравнению с плацебо в группе пациентов, получивших не менее одной дозы препарата (популяция intention-to-treat (ITT), в которую включались пациенты независимо от уровня каких-либо биомаркеров Т2-воспаления).
Предварительно запланированный субанализ по оценке эффективности дупилумаба при различном уровне эозинофилии показал выраженное преимущество дупилумаба перед плацебо у пациентов с разным уровнем эозинофилов (рис. 2).
У пациентов с исходным уровнем эозинофилов 300 кл/мкл дупилумаб в дозе 200 мг снижал частоту тяжелых обострений на 66%, а в дозе 300 мг – на 67% по сравнению с плацебо. У пациентов с исходным уровнем эозинофилов 150 кл/мкл и выше данный показатель составил 56 и 60% соответственно18.
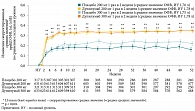
Дупилумаб продемонстрировал преимущество перед плацебо и по динамике ОФВ1 (рис. 3).
Эффект дупилумаба в улучшении функции дыхания был быстрым и стабильным на протяжении всего периода терапии (52 недели) в популяции ITT независимо от уровня биомаркеров Т2-воспаления.
Предварительно запланированный субанализ показал более выраженный эффект на фоне терапии дупилумабом по сравнению с плацебо у пациентов с исходным уровнем эозинофилов 300 кл/мкл: прирост преБД ОФВ1 к 12-й неделе лечения составил 210 и 240 мл соответственно. У пациентов с исходным уровнем эозинофилов >150 мк/мкл аналогичные показатели по сравнению с группой плацебо достигли 170 и 150 мл соответственно. У пациентов с уровнем эозинофилов < 150 кл/мкл достоверной разницы между группами активной терапии и плацебо не зарегистрировано.
Дупилумаб статистически значимо улучшал контроль БА по опроснику ACQ-5 к 24-й неделе у пациентов с неконтролируемой персистирующей БА.
Дупилумаб продемонстрировал хорошую переносимость и безопасность. Общая частота любых нежелательных явлений в группах дупилумаба и плацебо была схожей: 81% – в группах дупилумаба, 83–84% – в группах плацебо. Дупилумаб в обеих дозировках чаще, чем плацебо, вызывал реакцию в месте введения – 17 против 8%. Как правило, реакция отмечалась при первом введении препарата с последующей регрессией и не требовала прекращения терапии.
Резюмируя сказанное, профессор Н.М. Ненашева подчеркнула, что тяжелая БА фенотипически гетерогенна и в ее основе лежат по крайней мере два эндотипа – с доминированием Т2-воспаления и отсутствием значимого Т2-воспаления. В формировании Т2-воспаления участвуют разные цитокины, из которых наиболее значимы ИЛ-4, ИЛ-13 и ИЛ-5.
Дупилумаб – полностью человеческое моноклональное IgG4-антитело, уменьшающее каскад воспаления, опосредованный Т2-клетками. В исследовании фазы III Liberty Asthma QUEST, включавшем подростков старше 12 лет и взрослых, дупилумаб улучшал исходы БА по всем ключевым доменам в общей популяции пациентов, способствуя статистически и клинически значимому снижению годовой частоты тяжелых обострений, улучшению функции легких, качества жизни и контроля БА. Кроме того, у пациентов с неконтролируемой персистирующей БА отмечалась хорошая переносимость дупилумаба.
Гормонозависимая бронхиальная астма. Новые опции для достижения стероид-спарринг-эффекта
Гормонозависимая БА – это астма тяжелого течения, контроль которой достигается на фоне поддерживающей терапии пероральными ГКС19. Заведующий кафедрой пульмонологии Северо-Западного государственного медицинского университета (СЗГМУ) им. И.И. Мечникова, д.м.н., профессор Александр Викторович ЕМЕЛЬЯНОВ рассказал о ведении пациентов с гормонозависимой БА, а также об эффективности и безопасности анти-ИЛ-4/13 моноклонального антитела.
Число больных БА, принимающих системные ГКС, остается высоким. Так, в США системные ГКС получают 11–38% пациентов с тяжелой астмой, в Европе – 16–58%20, 21. По данным отечественного исследования, из 119 пациентов с тяжелой астмой 13% имеют гормонозависимую астму и получают системные ГКС в качестве поддерживающего лечения22.
Как известно, длительный прием системных ГКС опасен развитием побочных эффектов, таких как остеопороз и переломы, артериальная гипертензия, сахарный диабет, синдром Иценко – Кушинга, миопатия, инфекции, пептические язвы, расстройства сна, диспноэ, депрессия и апатия, катаракта и глаукома. Не случайно сегодня особый интерес специалистов вызывает дупилумаб как средство совершенствования лечения тяжелой астмы.
Профессор А.В. Емельянов представил результаты многоцентрового двойного слепого плацебоконтролируемого исследования фазы III Liberty Asthma VENTURE, в котором приняли участие специалисты из 16 стран, в том числе сотрудники кафедры пульмонологии СЗГМУ им. И.И. Мечникова23. В исследование после так называемой фазы оптимизации пероральных ГКС были включены 210 больных гормонозависимой астмой. Пациенты были разделены на две группы – группу дупилумаба 300 мг один раз в две недели и группу плацебо 300 мг один раз в две недели.
Основные критерии включения:
- регулярное лечение системными пероральными ГКС 5–30 мг/сут последние шесть месяцев;
- использование ИГКС в высокой дозе + до двух препаратов базисной терапии;
- преБД ОФВ1 ≤ 80% прогнозируемого значения для взрослых;
- степень обратимости ОФВ1 ≥ 12%.
Пациенты включались в исследование независимо от уровня каких-либо биомаркеров Т2-воспаления.
Первичной конечной точкой считалось процентное снижение дозы пероральных ГКС (от исходного уровня до 24-й недели) при одновременном поддержании контроля астмы.
Ключевые вторичные конечные точки:
- процент пациентов, достигших снижения дозы пероральных ГКС на 50% по сравнению с исходным уровнем при одновременном поддержании контроля бронхиальной астмы;
- процент пациентов, достигших снижения дозы до < 5 мг/сут при одновременном поддержании контроля БА;
- процент пациентов, не нуждавшихся в приеме пероральных ГКС при одновременном поддержании контроля астмы;
- количество тяжелых обострений БА за год;
- абсолютное изменение преБД ОФВ1 по сравнению с исходным значением;
- динамика оценки по опроснику ACQ-5 (от исходного уровня до 24-й недели).
В исследовании участвовали взрослые пациенты (средний возраст – 51 год) с тяжелой формой стероид-зависимой астмы: средний возраст возникновения БА – 31 год, среднее значение преБД ОФВ1 – 52%. Участники исследования в среднем имели двухлетний опыт применения пероральных ГКС, оптимизированная средняя суточная доза которых на исходном уровне составляла 10–12 мг.
Согласно полученным данным, дупилумаб статистически значимо снижал дозу пероральных ГКС по сравнению с плацебо к 24-й неделе лечения в общей популяции (рис. 4).
При использовании дупилумаба потребность в пероральных ГКС сокращалась на 70,1% (в группе плацебо – на 41,9%; среднее значение; медиана составила 100 и 50% соответственно)23.
Дупилумаб статистически значимо влиял на достижение вторичных конечных точек по сравнению с плацебо. В группе дупилумаба 80% пациентов достигли снижения дозы пероральных ГКС на ≥ 50%, у 69% пациентов доза пероральных ГКС была уменьшена до 5 мг/сут, 48% пациентов более не нуждались в этих препаратах. В группе плацебо аналогичные показатели составили 50, 33 и 25% соответственно (рис. 5)23.
Существенное снижение потребности в пероральных ГКС в группе дупилумаба отмечалось при разном исходном уровне эозинофилов. Так, при исходном уровне ≥ 300 кл/мкл в группе дупилумаба подобное снижение составило 79,5%, в группе плацебо – 42,7%. При исходном уровне ≥ 150 кл/мкл данные показатели составили 75,9 и 46,5% соответственно, а при исходном уровне эозинофилов < 150 кл/мкл – 63,8 и 36,9% соответственно23.
Через 24 недели в группе дупилумаба тяжелые обострения астмы наблюдались на 59% реже, чем в группе плацебо. Кроме того, в группе дупилумаба отмечалось статистически значимое улучшение функции легких23.
Переносимость дупилумаба была хорошей. Общее количество любых нежелательных явлений в группе дупилумаба было сопоставимо с таковым в группе плацебо (62 против 64%). Наиболее частым нежелательным явлением у пациентов, получавших дупилумаб, было транзиторное повышение уровня эозинофилов периферической крови (14 против 1%), которое не имело клинического значения, и реакции в месте инъекции (9 против 4%).
Важный момент: в исследование стероид-сберегающего эффекта Liberty Asthma VENTURE включали пациентов с тяжелой стероид-зависимой БА на основании клинических критериев, то есть без отбора по исходному уровню биомаркеров, характерных для воспаления 2-го типа. На основании полученных данных можно сделать следующие выводы:
- дупилумаб значительно сокращает потребность в пероральных ГКС, одновременно снижая количество тяжелых обострений БА и улучшая функцию легких;
- препарат эффективен у пациентов с гормонозависимой БА независимо от исходного уровня эозинофилов крови или FeNO. Наиболее выраженные результаты имеют место при высоких значениях любого из этих биомаркеров;
- дупилумаб хорошо переносится пациентами.
Завершая выступление, профессор А.В. Емельянов отметил, что гормонозависимая астма – тяжелое заболевание. При длительном использовании системных ГКС часто наблюдаются серьезные побочные эффекты. Однако биологическая терапия, в частности с использованием дупилумаба, позволяет добиться снижения дозы или полной отмены системных ГКС без ухудшения течения БА у значительной части пациентов.
Заключение
Бронхиальная астма – гетерогенное заболевание, которое подразделяется на два эндотипа – Т2-астма и не-Т2-астма. У пациентов с тяжелой Т2-астмой, несмотря на применение базисной терапии, сохраняется активное Т2-воспаление. В связи с этим особый интерес представляет ингибирование эффектов ИЛ-4 и ИЛ-13, играющих центральную роль в развитии воспаления 2-го типа, с помощью дупилумаба.
Дупилумаб продемонстрировал эффективность в лечении тяжелой астмы в многоцентровых клинических исследованиях фазы III Liberty Asthma QUEST и Liberty Asthma VENTURE. В исследовании QUEST в результате применения дупилумаба улучшались исходы БА по всем ключевым доменам в общей популяции пациентов, снижалась годовая частота тяжелых обострений на 46–48% у пациентов с неконтролируемой персистирующей БА по сравнению с плацебо, статистически и клинически значимо улучшалась функция легких как у больных с уровнем эозинофилов от 150 кл/мкл, так и особенно выраженно у больных с исходно высоким уровнем эозинофилов, а также улучшался контроль БА и повышалось качество жизни.
Результаты исследования VENTURE, посвященного оценке эффективности дупилумаба у больных гормонозависимой тяжелой астмой, показали, что дупилумаб статистически значимо (на 70%) снижает потребность в пероральных ГКС по сравнению с плацебо к 24-й неделе в общей популяции, уменьшает количество тяжелых обострений БА на 59% и улучшает функцию легких. Препарат характеризуется благоприятным профилем безопасности.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.