Таргетная терапия пациентов с тяжелым атопическим дерматитом – первый научный прорыв за последние 26 лет. XII Международный форум дерматовенерологов и косметологов. Сателлитный симпозиум компании «Санофи»
- Аннотация
- Статья
- Ссылки
В связи с тем что в последние годы отмечается тенденция к увеличению числа пациентов с тяжелыми формами атопического дерматита, в рамках XII Международного форума дерматовенерологов и косметологов 14 марта 2019 г. в Москве состоялся сателлитный симпозиум компании «Санофи», посвященный вопросам терапии именно таких больных. В частности, ведущие российские специалисты в области дерматологии обсудили современные представления о патогенезе атопического дерматита, перспективы применения высокоселективной биологической терапии, затронули вопросы качества жизни пациентов с атопическим дерматитом.
В связи с тем что в последние годы отмечается тенденция к увеличению числа пациентов с тяжелыми формами атопического дерматита, в рамках XII Международного форума дерматовенерологов и косметологов 14 марта 2019 г. в Москве состоялся сателлитный симпозиум компании «Санофи», посвященный вопросам терапии именно таких больных. В частности, ведущие российские специалисты в области дерматологии обсудили современные представления о патогенезе атопического дерматита, перспективы применения высокоселективной биологической терапии, затронули вопросы качества жизни пациентов с атопическим дерматитом.



Прорыв в науке и появление таргетной терапии для пациентов с атопическим дерматитом
Симпозиум открыл заведующий отделом оказания специализированной помощи Московского научно-практического центра дерматовенерологии и косметологии Департамента здравоохранения г. Москвы, к.м.н. Дмитрий Николаевич СЕРОВ.
В начале выступления докладчик отметил, что за последние годы распространенность атопического дерматита (АтД) увеличилась. Данная тенденция прослеживается как в детской, так и во взрослой популяции. Поэтому актуальность внедрения новых эффективных методов лечения сохраняется.
В настоящее время целью терапии является не только купирование клинических проявлений, но и достижение длительной ремиссии заболевания. При выборе тактики ведения пациентов необходимо учитывать тяжесть, распространенность и остроту воспалительного кожного процесса.
При легкой форме АтД применяют базисную терапию, а также увлажняющие и успокаивающие средства. Больным рекомендуют избегать контакта с раздражителями и триггерами, вызывающими обострение заболевания.
Как при легкой, так и при средней степени тяжести АтД преимущественно назначают топическую терапию: глюкокортикостероиды (ГКС) низкой и средней активности, блокаторы кальциневрина.
Топические ГКС (тГКС) средней и высокой активности и блокаторы кальциневрина применяют при средней степени тяжести АтД, а также при тяжелой форме заболевания.
Если при тяжелых формах АтД ответ на топическую терапию отсутствует, к ней добавляют системные препараты, такие как циклоспорин А и метотрексат (метотрексат не зарегистрирован в РФ по показанию «атопический дерматит»)1–4.
В России при АтД циклоспорин А используется в редких случаях, поскольку препарат обладает широким спектром нежелательных явлений. Так, при длительном курсе лечения циклоспорин А может оказывать нефротоксический и гепатотоксический эффекты. Поэтому необходимо регулярное наблюдение таких больных – с оценкой тяжести и распространенности кожного процесса.
Известно, что АтД – мультифакториальное воспалительное заболевание, в развитии которого важную роль играют такие этиологические факторы, как состояние иммунной системы, кожного барьера5, наследственная предрасположенность6 и факторы окружающей среды7.
Очевидно, что здоровая кожа является барьером, защищающим организм от проникновения экзогенных молекул/антигенов8. Важной частью кожного барьера считается роговой слой эпидермиса. Он обеспечивает механическую защиту кожи, ее непроницаемость для различных веществ и живых организмов, бактерицидность9, 10. «Плотные контакты запечатывают пространство между кератиноцитами в зернистом слое, что приводит к ограничению тока ионов и, как следствие, защите кожи от воздействия различных провоцирующих факторов», – пояснил докладчик.
Гистологическая картина АтД характеризуется выраженным спонгиозом, паракератозом и изменениями соединительной ткани. Внутриэпидермальное скопление жидкости обусловливает формирование везикул. Паракератоз приводит к нарушению и повышению проницаемости кожного барьера. С АтД ассоциируются прежде всего вакуолярные изменения соединительной ткани.
Согласно прежним представлениям о патогенезе АтД, под воздействием внешних факторов (аллергенов) происходит дифференцировка Т-хелперов 2-го типа (Th2), выброс большого количества интерлейкинов (IL), в том числе IL-4, -5, -13, происходит воздействие на В-клетки, начинается выработка большого количества иммуноглобулина (Ig) E. Кроме того, наблюдаются повышение уровня эозинофилов, нарушение дифференцировки Т-хелперов 1-го типа (Th1), выработка фактора некроза опухоли α (TNF-α), интерферона γ. Все это приводит к развитию воспаления11, 12.
Исходя из этой модели патогенеза, для лечения тяжелых форм АтД применяли системные препараты, которые воздействовали на разные этапы патогенеза. Была предпринята попытка исследовать моноклональное антитело, связывающее IgE, – омализумаб. Однако, несмотря на то что такая терапия уменьшала концентрацию IgE в сыворотке крови, при оценке клинических конечных точек не отмечалось улучшения течения заболевания по сравнению с контрольной группой13, 14.
Ряд исследований был посвящен оценке эффективности инфликсимаба при тяжелом АтД у взрослых пациентов.
Согласно результатам постмаркетингового исследования, инфликсимаб как моноклональное антитело к TNF-α способствовал уменьшению концентрации последнего. В то же время эффект был кратковременным. При долгосрочном применении инфликсимаба эффективность терапии снижалась15. Поэтому инфликсимаб не зарегистрирован для лечения АтД.
Аналогичные результаты получены в исследовании эффективности меполизумаба16. Препарат уменьшал количество эозинофилов в тканях и периферической крови. В то же время при оценке клинических конечных точек улучшение состояния у пациентов с АтД зафиксировано не было. Результаты исследований позволили сделать вывод, что влияние на такие ключевые звенья патогенеза, как IgE, TNF-α и эозинофилы, не всегда приводит к длительной ремиссии заболевания.
В связи с последними данными – о ведущей роли интерлейкинов в развитии воспалительной реакции при АтД – была принята новая концепция патогенеза АтД. Так, под воздействием факторов окружающей среды (аллергенов) и при наличии наследственной предрасположенности нарушается целостность кожного барьера, происходит дифференцировка наивных Т-хелперов в Т-хелперы 2-го типа, выброс большого количества IL-4, -13 и -31. Повышение продукции интерлейкина само по себе может вызывать воспаление кожи, индуцировать нарушение кожного барьера, дифференцировки кератиноцитов, усугубляя патологическую реакцию при АтД.
Известно, что интерлейкины задействованы в развитии как острой, так и хронической стадии АтД. Кроме того, с ними ассоциируется последующая лихенизация. В частности, IL-4 участвует в дифференцировке Th2 и экспрессии IL-31. Последний влияет на возникновение зуда. Кожный зуд – основной симптом АтД. Именно с ним связано нарушение целостности кожного барьера. Поэтому было очень важно обнаружить звено иммунопатогенеза АтД, которое запускает патологические процессы. Воздействие IL-4 и IL-13 на одни и те же рецепторы обусловливает опосредованное цитокинами привлечение Т-лимфоцитов и эозинофилов, активацию прайминга тучных клеток, в последующем – выброс большого количества IgE, а также синтез тимусного стромального лимфопоэтина кератиноцитами и миграцию компетентных клеток17–19.
Уменьшение терминальной дифференцировки кератиноцитов приводит к нарушению целостности кожного барьера, снижению содержания барьерных белков эпидермиса10–22.
Таким образом, именно IL-4 и IL-13 опосредуют воспаление и барьерную дисфункцию при АтД.
Результаты исследований подтверждают, что уровни IL-4 и IL-13 коррелируют с активностью заболевания23. При этом экспрессия цитокинов повышается как при обострении, так и при хроническом течении заболевания.
Расширение представлений о патогенезе АтД стало основанием для рассмотрения в качестве новых методов лечения таргетных препаратов. Таргетная терапия воздействует на основные факторы развития и прогрессирования заболевания.
Не так давно был разработан препарат дупилумаб. Это человеческое моноклональное антитело, которое специфически связывается с α-субъединицей рецептора IL-4 (IL-4Rα) и таким образом ингибирует передачу сигналов IL-4 и IL-13.
Дупилумаб блокирует эффекты цитокинов IL-4 и IL-13.
Данный препарат зарегистрирован во многих странах. В России для лечения атопического дерматита и бронхиальной астмы он был зарегистрирован 4 апреля 2019 г.
Эффективность дупилумаба подтверждена результатами рандомизированных плацебоконтролируемых исследований с высоким уровнем доказательности. Применение таргетного препарата способствовало уменьшению степени поражения кожи, а также выраженности зуда. Кроме того, дупилумаб как в монотерапии, так и в сочетании с тГКС позволял достичь первичной конечной точки эффективности в исследованиях фазы III.
Двойные рандомизированные плацебоконтролируемые клинические исследования SOLO 1 и SOLO 2 подтвердили эффективность дупилумаба в монотерапии у пациентов с АтД24. Целью исследований было оценить эффективность и безопасность монотерапии дупилумабом по сравнению с плацебо у взрослых пациентов со среднетяжелым и тяжелым АтД при недостаточном контроле заболевания или невозможности применять препараты для наружной терапии. После рандомизации пациенты были распределены на три группы: плацебо, дупилумаб 300 мг один раз в неделю (данный режим дозирования не одобрен к применению) и дупилумаб 300 мг один раз в две недели.
Все участники исследования должны были применять увлажняющие средства два раза в день более семи дней до рандомизации и на протяжении всего периода наблюдения.
Продолжительность лечения составила 16 недель.
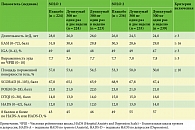
У пациентов, включенных в исследования, бремя заболевания на исходном уровне было высоким (выраженность зуда, распространенность воспалительного процесса, нарушение качества жизни) (таблица).
Оценку степени тяжести АтД проводили по различным шкалам, включая SCORAD (SCORing Atopic Dermatitis).
В качестве первичной конечной точки была выбрана доля больных, у которых удалось достичь нуля или одного балла (полное или почти полное очищение кожи) по IGA (Investigator Global Assessment) и снижения показателя на два балла и более относительно исходного уровня к 16-й неделе, а также уменьшения тяжести атопического дерматита по EASI (Eczema Area and Severity Index).
Через 16 недель при использовании обоих режимов дозирования дупилумаба достигнуты равнозначные конечные точки – IGA 0, 1 и EASI 75.
Применение дупилумаба сопровождалось достоверным уменьшением зуда, тревожности и депрессии, улучшением качества жизни. Необходимо отметить, что значимое снижение зуда отмечалось уже через две недели лечения.
Такая терапия характеризовалась благоприятным профилем безопасности. Общая частота возникновения нежелательных явлений в группах дупилумаба и плацебо была сопоставимой.
В заключение Д.Н. Серов отметил, что дупилумаб – первый биологический препарат для таргетного лечения АтД. Он может применяться для терапии атопического дерматита среднетяжелого и тяжелого течения у взрослых пациентов при недостаточном ответе на терапию топическими препаратами или в случае, когда топические препараты не могут быть назначены. Препарат зарегистрирован в России в апреле 2019 г., следовательно, в скором времени он будет доступен для пациентов.
Биологическая терапия при атопическом дерматите с позиции консенсусных рекомендаций
Продолжил тему применения методов биологической терапии в лечении больных АтД руководитель отдела клинической дерматовенерологии и косметологии Московского научно-практического центра дерматовенерологии и косметологии Департамента здравоохранения г. Москвы, д.м.н., профессор Андрей Николаевич ЛЬВОВ. Прежде всего он подчеркнул значимость появления таргетной терапии, воздействующей на интерлейкины. По мнению А.Н. Львова, это способствует открытию широких перспектив в лечении больных АтД с выраженным зудом и воспалительной реакцией.
На сегодняшний день ведущие российские и зарубежные эксперты пересматривают подходы к терапии данного заболевания.
Самым действенным методом разработки общего руководства для клинической практики является поиск консенсуса в мультидисциплинарной команде экспертов, среди которых не только дерматологи, но и педиатры, аллергологи-иммунологи, врачи общей практики, пульмонологи. «В процессе достижения консенсуса появляются практические рекомендации, направленные на улучшение состояния пациентов», – прокомментировал выступающий.
Согласно опубликованным руководствам, при ведении пациентов с АтД должен применяться ступенчатый подход, который предполагает учет тяжести заболевания.
Согласно зарубежным рекомендациям, одним из возможных препаратов биологической терапии АтД признан дупилумаб. Дупилумаб зарегистрирован в США, Евросоюзе и Японии для лечения взрослых пациентов со среднетяжелым и тяжелым АтД, у которых не удается достичь контроля над заболеванием с помощью топических препаратов или использование таких препаратов не рекомендуется.
В связи с появлением новых методов терапии возникает ряд вопросов: как, когда и по какой схеме переводить пациентов с терапии традиционными препаратами, такими как циклоспорин, на биологическую терапию? Можно ли сразу начинать терапию дупилумабом?
Известно, что циклоспорин введен в дерматологическую практику три десятилетия назад. Он зарегистрирован во многих европейских странах, в том числе России, для лечения пациентов с тяжелым АтД, не отвечающих на топическую терапию4. Препарат является универсальным иммунодепрессантом – подавляет активацию определенных классов Т-лимфоцитов и блокирует выработку IL-225. Несмотря на доказанную эффективность, у некоторых пациентов с АтД не формируется ответа на терапию циклоспорином. Кроме того, препарат обладает широким спектром ограничений к применению, связанных с развитием нежелательных явлений. Речь, в частности, идет о пациентах с артериальной гипертензией, патологией почек, печени, нарушениями обменных процессов. Существуют также протоколы обследования пациентов, получающих циклоспорин, в отношении необходимости исключения легочных инфекций, прежде всего туберкулеза26.
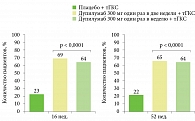
Появление в арсенале врачей таргетного биологического препарата дупилумаба значительно расширило возможности лечения АтД. В подтверждение докладчик представил данные о применении дупилумаба в составе комбинированной терапии пациентов с АтД. Эффективность длительного совместного применения дупилумаба с тГКС оценивали в рандомизированном плацебоконтролируемом двойном слепом исследовании CHRONOS. Общая продолжительность лечения в исследовании составила 52 недели27.
Всего было рандомизировано 740 взрослых пациентов с неконтролируемым среднетяжелым и тяжелым АтД из 14 стран Европы, Азиатско-Тихоокеанского региона и Северной Америки.
На момент прекращения сбора данных 623 пациента включены в 52-недельный анализ эффективности и безопасности дупилумаба.
Пациентов разделили на следующие группы: дупилумаб 300 мг один раз в неделю (данный режим дозирования не одобрен к применению), дупилумаб 300 мг каждые две недели и плацебо. Кроме того, все больные получали тГКС.
Результаты исследования продемонстрировали, что терапия дупилумабом в сочетании с тГКС хорошо переносилась и обеспечивала значительный клинический эффект. Кроме того, применение дупилумаба ассоциировалось с более частым достижением EASI 75 к 16-й и 52-й неделе (рисунок).
В группе пациентов, получавших дупилумаб в разных дозах в течение 52 недель, зафиксировано стойкое улучшение симптомов по SCORAD, значимое уменьшение кожного зуда, степени тревожности и депрессии, улучшение качества жизни. Уменьшение кожного зуда отмечалось уже с четвертой недели терапии, положительная динамика сохранялась на протяжении всего периода наблюдения. Во время исследования переносимость дупилумаба была хорошей, профиль безопасности, который оценивался за 52 недели, соответствовал профилю безопасности за 16-недельный период. Суммарная частота возникновения нежелательных явлений была сопоставимой в группах «дупилумаб + тГКС» и «плацебо + тГКС». При этом нежелательные явления, ставшие причиной прекращения лечения, в группе дупилумаба фиксировались реже, чем в группе плацебо.
Подводя итог, профессор А.Н. Львов подчеркнул высокую достоверность полученных в ходе клинических исследований данных и выразил мнение о необходимости подтверждения данных об эффективности и безопасности дупилумаба у больных АтД на базе российских научных центров.
Как таргетная терапия может повлиять на качество жизни пациентов с атопическим дерматитом и другими аллергическими заболеваниями
По словам заведующей первым дерматовенерологическим отделением Московского научно-практического центра дерматовенерологии и косметологии Департамента здравоохранения г. Москвы, к.м.н. Ксении Юрьевны ФЕДОТОВОЙ, атопический дерматит – хроническое воспалительное заболевание кожи. К основным признакам заболевания относятся выраженная сухость кожи (ксероз), диффузные эритематозные очаги на коже туловища и лица, папуло-везикулезные элементы с мокнутием, лихенизированные и экскориированные бляшки.
Интенсивный кожный зуд – один из главных симптомов АтД, на который жалуются пациенты.
Локализация поражений может быть как генерализованной (складки кожи, сгибательных поверхностей, запястья, лодыжки, веки), так и ограниченной (голова, шея). Чем больше площадь поражения кожи, тем тяжелее заболевание28.
Симптомы АтД, в частности интенсивный зуд, нарушают повседневную активность больных, сон, снижают их социальное функционирование и работоспособность. Как следствие, ухудшается их психическое здоровье. В то же время у пациентов с АтД нередко развиваются осложнения (бактериальные, вирусные и грибковые инфекции кожи), сопутствующие заболевания, опосредованные воспалением 2-го типа (type 2 inflammation) (бронхиальная астма, аллергический ринит, хронический риносинусит с назальным полипозом)29, 30.
Было проведено наблюдательное исследование пациентов со среднетяжелым и тяжелым АтД, которые получали не только топическую, но и системную терапию. У больных оценивали выраженность, частоту и длительность кожного зуда31. Установлено, что 85,8% пациентов ежедневно испытывали зуд, при этом 46,3% – выраженный. У 29,7% пациентов с АтД ощущение зуда присутствовало в течение всего дня. Более 46,0% больных отмечали, что кожный зуд существенно влиял на сон, досуг и отдых, социальную жизнь, выполнение работы по дому, текущих дел вне дома, учебу. В течение пяти – семи дней в неделю на сухость и огрубление кожи жаловались 91,1% больных, шелушение – 77,6%, образование трещин – 66,6%, кровоточивость – 51,1%, мокнутие – 34,2% пациентов.
Известно, что сильные расчесы вследствие зуда часто приводят к образованию эрозий, экссудации и кровоточивости32. В результате барьерная функция кожи нарушается, риск проникновения различных раздражителей, аллергенов повышается. Таким образом, расчесывание кожи приводит к усилению воспаления и еще более сильному зуду33.
Согласно результатам масштабного Американского исследования состояния здоровья и благополучия (National Health and Wellness Survey), в котором приняли участие 71 182 пациента с АтД, частота нарушения сна достигала 31,2%34. Повышенная утомляемость у пациентов с АтД была связана с трудностями при самообслуживании35. Усталость, сонливость и бессонница обусловлены плохим общим состоянием здоровья36. Пациенты со среднетяжелым и тяжелым АтД значительно чаще страдали от зуда и нарушения сна, чем больные с легкой формой заболевания.
Дополнительным фактором риска тяжелого течения АтД являются бактериальные инфекции. Так, у пациентов с АтД в 73–100% случаев наблюдалась колонизация кожи золотистым стафилококком (Staphylococcus aureus) с плотностью до 107 КОЕ/см2 в отсутствие клинических проявлений инфекции37, 38. Помимо стафилококковой инфекции нередко отмечалось присоединение стрептококковой инфекции39. Доказано, что золотистый стафилококк усугубляет или способствует поддержанию воспалительного процесса40.
Известно, что периоды обострения АтД сменяются периодами ремиссии. Однако даже при ремиссии заболевания большинство пациентов испытывают беспокойство по поводу развития следующего обострения. Анализ данных наблюдательного исследования продемонстрировал, что у 1371 пациента с АтД средней степени тяжести обострение фиксировалось в течение 113 дней в году, у 631 пациента с тяжелым АтД – 192 дней41.
О тревоге или депрессии сообщили 43% взрослых пациентов со среднетяжелым и тяжелым АтД. При этом тяжесть симптомов тревоги и депрессии коррелировала со степенью тяжести заболевания31.
Взрослые пациенты с АтД часто страдают такими сопутствующими заболеваниями, как аллергический ринит, бронхиальная астма, аллергический конъюнктивит. По некоторым данным, 63–76% больных АтД независимо от степени тяжести страдают как минимум еще одним сопутствующим аллергическим заболеванием42, 43.
В США проведено одномоментное наблюдательное исследование, в котором участвовали 202 врача и 1064 пациента со среднетяжелым и тяжелым АтД44. Для оценки эффективности терапии у пациентов с АтД применяли EASI, POEM (Patient-Oriented Eczema Measure). Оценку качества жизни проводили с помощью дерматологического индекса качества жизни DLQI (Dermatology Life Quality Index) и опросника производительности труда и снижения активности WPAI:SHP (Work Productivity and Activity Impairment Questionnaire for Specific Health Problems). Критериями неудовлетворительного контроля заболевания выступили сохраняющиеся обострения, прогрессирование заболевания, неудовлетворенность врачей результатами лечения. По оценкам врачей, неудовлетворительный контроль заболевания наблюдался у 58,7% больных со среднетяжелым и тяжелым АтД. Таковой в большинстве случаев сохранялся и на фоне терапии системными ГКС.
В то же время результаты исследований SOLO 1 и 2, CHRONOS свидетельствуют, что препарат дупилумаб способствовал улучшению состояния взрослых пациентов с АтД на протяжении всего периода лечения. В группе дупилумаба в отличие от группы плацебо отмечены лучшие результаты в отношении показателей РОЕМ и DLQI24, 27.
Таким образом, появление таргетного биологического препарата дупилумаба, способного прицельно воздействовать на ключевые звенья патогенеза атопического дерматита, может снизить бремя этого тяжелого заболевания, добиться длительной ремиссии и повысить качество жизни пациентов.
Заключение
Понимание механизмов развития аллергического воспаления при АтД открывает новые возможности в разработке патогенетических методов лечения. Перспективным направлением в терапии АтД тяжелого и среднетяжелого течения является использование дупилумаба – антагониста IL-4Rα. Это рекомбинантное человеческое моноклональное антитело, способное связываться с субъединицей IL-4R и ингибировать передачу сигналов цитокинов IL-4 и IL-13. Блокирование эффектов цитокинов снижает воспалительный ответ и способствует улучшению симптомов заболевания. Результаты клинических исследований продемонстрировали, что использование таргетного биологического препарата способствует улучшению качества жизни пациентов с атопическим дерматитом тяжелого и среднетяжелого течения при благоприятном профиле эффективности и безопасности.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.