Лекарственная терапия в современном лечении рака поджелудочной железы
- Аннотация
- Статья
- Ссылки

Заболеваемость РПЖ в России в 2007 г. составила 14037 новых случаев (четвертое место среди опухолей пищеварительной системы). За последние пять лет заболеваемость РПЖ возросла на 4,2% у мужчин и на 12,1% у женщин. Смертность от этого заболевания в 2007 г. в России составила 14473 случая (4,9% от всех опухолей у мужчин и 5,5% от всех опухолей у женщин). Стандартизованные показатели смертности от РПЖ в 2007 г. для мужчин – 9/100000 (6-е место), для женщин – 4,8/100000 (8-е место). Превалирование показателей смертности над показателями заболеваемости связано с посмертной диагностикой РПЖ [1].
Европейские статистические данные по РПЖ схожи с российскими показателями. В 2008 г. показатель заболеваемости равнялся 68500, что меньше показателя смертности – 70200 (это объясняется посмертной диагностикой в части случаев). Стандартизованный показатель для обоих полов – 11,7/100000. Средний возраст заболевших – 72 года [2]. По данным Международного агентства по изучению рака в Лионе (2007), РПЖ занимает 13-е место по заболеваемости в мире для обоих полов, а по смертности – 8-е место. В 2009 г. в США РПЖ заболели 42470 человек (10-е место для обоих полов), умерли 35240, соотношение смертности и заболеваемости – 0,83. 80% заболевших старше 60 лет [3]. Из 230 тыс. зарегистрированных больных в мире умирают 98% [4].
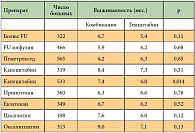
После установления диагноза РПЖ однолетняя выживаемость составляет 15,2% у мужчин и 16,4% у женщин. Показатель пятилетней выживаемости больных РПЖ – менее 5%: 3,8% у мужчин и 4,6% у женщин. В США за 25 лет – с 1975 по 2000 г. – показатели пятилетней популяционной выживаемости увеличились с 3% до 4%. При этом пятилетняя выживаемость от всех опухолей за указанный период увеличилась на 13%, от рака толстой кишки – на 12%, рака пищевода – на 9%, рака желудка – на 8%. Только у 10% больных опухоль, выявленная во время первичной диагностики, является операбельной. Лимфатическая диссеминация выявляется в 45–70% при опухолях менее 2 см в диаметре. До 30% опухолей, выявленных впервые, относят к группам локально распространенных и 60% – к метастатическим. Удручающе выглядят данные по медиане выживаемости больных РПЖ: операбельные – 15–19 мес., местнораспространенные – 6–10 месяцев, метастатические – 3–6 мес. (табл. 1) [5].
Адъювантная терапия рака поджелудочной железы
Результаты хирургического лечения РПЖ (даже после R0 резекции) оставляют желать лучшего. Рецидивы возникают у 80% пациентов, метастазы в печень – у 50%, в брюшину – у 25%. Медиана выживаемости после R0 резекции составляет 15–20 мес., а после R1 резекции – 8–12 мес. [6, 7]. Необходимость адъювантного лечения РПЖ была признана в конце ХХ века. Неудачными были попытки улучшить выживаемость радикально оперированных больных с помощью лучевой терапии в исследованиях M.H. Kaiser и S.S. Ellenberg (1985) (дозы повышались до 54 Гр). Группа EORTC (European Organization for Research and Treatment of Cancer) провела исследование, где сравнивали 2 группы оперированных больных РПЖ (n = 114): пациенты одной группы наблюдались, другой – получали химиолучевую терапию (2 цикла – фторурацил инфузионно + лучевая терапия, сплит-курс по 20 Гр). Больные с Т3 первичной опухолью исключались из исследования. Медиана выживаемости составила 17,1 мес. в химиолучевой группе и 12,6 мес. в группе наблюдения, 2 года выжили соответственно 37% и 23% больных [8]. Исследование было подвергнуто критике из-за субоптимальных доз облучения [4].
В исследовании ESPAC-1 (A European, randomised study to assess the roles of adjuvant chemotherapy (5FU + Folinic Acid) and adjuvant chemoradiation (40GY + 5FU) in resectable pancreatic cancer; Европейская группа по изучению РПЖ), проведенном на 289 оперированных радикально, были сравнены группа наблюдения, группа больных, получавших адъювантно химиотерапию: 6 пятидневных циклов фторурацила (разовая доза 425 мг/м2) + лейковорин (разовая доза 20 мг/м2), и группа, подвергнутая химиолучевой терапии (дозы фторурацила и лейковорина были идентичны тем, которые получали пациенты из группы химиотерапии, дозы облучения – 40 Гр). Оказалось, что медиана выживаемости больных, получавших адъювантную химиотерапию фторурацилом, была 20,1 мес., в группе наблюдения – 15,5 мес. (р = 0, 009), а в группе с химиолучевой терапией медиана выживаемости – 14,0 мес. – была ниже, чем в контрольной группе, не получавшей адъювантного лечения (HR = 1,28). Это объяснялось тем, что в третьей группе не удавалось провести адекватного лечения (ни химиотерапевтического, ни лучевого) в связи с возросшей токсичностью терапии [9].
Группой RTOG (Radiation Therapy Oncology Group) организовано сравнение эффективности двух вариантов химиолучевой адъювантной терапии РПЖ (3 недели фторурацил 250 мг/м2 ежедневно или гемцитабин 1 г/м2 в 1, 8 и 15-й дни), затем 12 недель химиолучевое лечение (фторурацил в обеих группах инфузионно 250 мг/м2 + облучение 50,4 Гр в ежедневных фракциях по 1,8 Гр), затем еще в течение 3 недель лечение фторурацилом в указанных ранее дозах в 1-й группе и гемцитабином во 2-й группе. При адъювантной терапии после операции по поводу рака головки поджелудочной железы (ПЖ) медиана выживаемости была достоверно выше в группе с гемцитабином – 39,6 мес. против 20,6 мес. в группе с фторурацилом. После адъювантной терапии по поводу рака тела или хвоста ПЖ достоверной разницы в группах не получено [10].
Международное исследование CONCO-001, проведенное на 368 оперированных больных по поводу локального РПЖ, показало, что применение гемцитабина в адъювантном режиме (6 циклов в дозах 1 Гр/м2 в 1, 8 и 15-й дни, каждые 3 недели, без облучения) приводит к увеличению медианы выживаемости до 20,1 мес. (в контрольной группе – 20,2 мес., р = 0,06). Безрецидивная выживаемость составляла в группе с гемцитабином 13,4 мес., в группе наблюдения – 6,9 мес., разница достоверна (р < 0,001); медиана общей выживаемости – 22,8 и 20,2 мес. соответственно (р = 0,005). При стратификации больных по типу операции R0 или R1 (без опухолевых клеток по краям разреза или с ними) безрецидивная выживаемость составила 15,8 и 13,1 мес., а в группах наблюдения – 7,3 и 5,5 мес. Разницы в однолетней выживаемости не выявлено (72 и 72,5%), но к трем и пяти годам количество выживших пациентов, получавших адъювантное лечение, выше – 36,5% против 19,5% и 21% против 9% в группах наблюдения [11, 12].
В исследовании ESPAC-3 на 1088 оперированных больных РПЖ (R1 – 35%, в 70% – вовлечение регионарных лимфоузлов) сравнивалась адъювантная терапия фторурацилом в комбинации с лейковорином (1-я группа) и гемцитабином (2-я группа). Медиана общей выживаемости в 1-й группе – 23 мес., во 2-й группе – 23,6 мес., разница статистически не достоверна. Авторы считают, что тенденция исключения фторурацила из арсенала лечения РПЖ является ошибкой. Вместе с тем они указывают в качестве преимуществ гемцитабина его меньшую токсичность [13]. Начато исследование ESPAC-4, где больные рандомизированы на группы, получающие Гемзар (гемцитабин) или GemCap (гемцитабин и капецитабин). В настоящее время, согласно рекомендациям ESMO (European Society for Medical Oncology) и NCI (National Cancer Institute, США), адъювантная терапия РПЖ входит в стандарты лечения в большинстве стран.
Неоадъювантная терапия
Цели предоперационной терапии – снизить стадийность течения опухоли и тем самым повысить резектабельность сомнительно-операбельных опухолей, предотвратить диссеминацию и имплантацию опухолевых клеток во время хирургической операции. Тема неоадъювантной химиолучевой терапии рака поджелудочной железы разрабатывается учеными Андерсоновского онкологического центра Техасского университета (Хьюстон, США). В качестве предоперационного лечения применялась комбинация фторурацила, паклитаксела и гемцитабина вместе с облучением (доза 30 Гр). Медиана выживаемости после предоперационной терапии и гастропанкреатодуоденальной резекции (ГПДР) составила 30 мес., после операции – 17 мес. [14].
Известны результаты исследования, в котором сравнивалось предоперационное введение гемцитабина и комбинации гемцитабина с паклитакселом, ГПДР выполнялась на 16-й неделе после химиотерапии. Один год выжили 16% больных после лечения комбинацией препаратов и 46% после монотерапии гемцитабином. 54% прооперированы радикально, 36% паллиативно, и 10% было отказано в операции из-за прогрессирования опухоли [15]. В настоящее время неоадъювантная терапия не нашла широкого применения в лечении операбельного рака поджелудочной железы, так как не влияет на возможность увеличения числа резектабельных больных.
Лечение распространенного РПЖ
26% случаев РПЖ во время первичной диагностики квалифицируются как неоперабельные местнораспространенные опухоли [16]. Группой ECOG (Eastern Cooperative Oncology Group) было проведено крупное исследование III фазы E 4201. Сравнивалось наружное облучение в течение 6 недель (50,4 Гр) в сочетании с гемцитабином 1 раз в неделю по 600 мг/м2 с монотерапией гемцитабином по 1000 мг/м2 (6 еженедельных доз). Медиана общей выживаемости составила соответственно 18 и 24 мес. (р = 0,034), дольше жили пациенты, получавшие Гемзар и лучевую терапию [17].
Накоплен опыт интраоперационной лучевой терапии (ИОЛТ) при РПЖ. Christopher G. Willett и соавт. в 2001 г. суммировали опыт 3 американских клиник по дооперационному, интраоперационному и послеоперационному облучению больных и заключили, что лучшие показатели выживаемости и меньшая частота рецидивов отмечаются при ИОЛТ [18]. В целом большинство исследований по местнораспространенному раку поджелудочной железы свидетельствуют о том, что предпочтение при этом варианте заболевания следует отдавать химиолучевому лечению, при котором химиопрепараты используются как радиосенсибилизаторы, а в дальнейшем пациенты переводятся на стандартную химиотерапию в соответствии с принципами лечения диссеминированной болезни.
Более 60% больных РПЖ на момент установления диагноза уже поражены метастазами. Медиана их выживаемости – 3–5 мес. Главными целями лекарственной терапии у этой когорты пациентов являются уменьшение страданий пациентов, улучшение качества и продление сроков жизни. Исторически первыми препаратами, предложенными для лечения РПЖ на этом этапе болезни, были фторурацил и митомицин. По современным оценкам, реальная эффективность фторурацила при диссеминированном раке поджелудочной железы менее 10%. Усиление эффекта фторурацила лейковорином при РПЖ не так выражено, как при раке толстой кишки. Медиана выживаемости, по данным J.A. De Caprio и соавт., составляет всего 6,2 мес., тем не менее 17% пациентов прожили более 1 года [19].
Следующим по значимости препаратом для лечения метастатического РПЖ после фторурацила до 90-х гг. прошлого века был митомицин. Препарат обеспечивал противоопухолевый эффект в 27% случаев, улучшал качество жизни у 20–30% больных, не увеличивая общую выживаемость (5 мес.) [20]. Комбинация митомицина и фторурацила увеличивала медиану общей выживаемости этих больных до 6,5 мес., в контрольной группе (инфузии фторурацила) этот показатель составил 5,1 мес. (р = 0,04) [21]. Уязвимыми для митомицина оказались клетки РПЖ с делецией супрессорного гена DPC4. Хотя подобные мутации в клетках этого гена встречаются у половины больных РПЖ, лишь некоторые из этих пациентов отвечают значительным увеличением сроков жизни [22]. Важной вехой лекарственной терапии РПЖ явилось открытие гемцитабина. Препарат признан стандартом 1-й линии химиотерапии РПЖ, допускается его применение даже при статусе больного 60% по шкале Карновского [4].
M.L. Rothenberg в 1995 г. отметил выраженный симптоматический эффект гемцитабина у больных РПЖ, прогрессировавших после терапии фторурацилом. Была разработана система оценки симптоматического эффекта при РПЖ. Критериями клинического улучшения являются снижение доз обезболивающих препаратов на 50%, изменение статуса по шкале Карновского на 20%, прибавка веса [23]. Мультицентровое сравнение эффективности гемцитабина и фторурацила осуществлено H.A. Burris и соавт. в 1997 г. Клиническое улучшение зарегистрировано в 24% и 5% случаев соответственно, медиана общей выживаемости – 5,7 и 4,2 мес., выживаемость 1 год – 18% и 2%. Это исследование послужило основанием для решения FDA о применении GEM (гемцитабин) в качестве стандарта первой линии химиотерапии метастатического РПЖ [24].
Широко используется комбинация GEM + MMC: гемцитабин 800 мг/м2 в 1, 8 и 15-й дни и митомицин 8 мг/м2 в 1 день. Цикл повторяют каждые 4 недели. Частичный эффект регистрируется в 32%, клиническое улучшение – в 46–60%, медиана общей выживаемости – 6,5–9 мес. [28, 29]. Несколько исследователей оценили комбинацию гемцитабина и иринотекана (Iri). Режим состоял из GEM 1000 мг/м2 и Iri 100 мг/м2, оба препарата вводились в 1-й и 8-й дни, цикл повторяли каждые 3 недели. Падение маркера Ca 19,9 > 50% и частичная ремиссия регистрировались у трети больных, еще у 25% – стабилизация процесса. Выживаемость не превышала 1 года [30]. В сравнительном рандомизированном исследовании эффективности GEM + Iri и GEM в монотерапии достоверной была только разница в клиническом улучшении – 42,2% в комбинированной группе и 24% при монотерапии.
Были проведены рандомизированные исследования активности гемцитабина и комбинации гемцитабина и цисплатина (DDP) при РПЖ. Оказалось, что непосредственный эффект от присоединения цисплатина повышается в 3 раза и достигает 36%. Позднее оценочные работы подтвердили целесообразность комбинации. GEM назначался в дозах 1000 мг/м2 в 1, 8 и 15-й дни, DDP по 40 мг/м2 – в 1-й и 15-й дни. Общий эффект регистрировался в 22–36%, редко отмечались даже полные эффекты (8–10%), клиническое улучшение было выраженным в 75%, медиана выживаемости составляла 9–10 мес.
В 2005 г. M. Airoldi и соавт. оценивался режим GEM-OXA. Гемцитабин применялся в инфузионном режиме 10 мг/м2 в 1 минуту, разовая доза 1000 мг/м2, оксалиплатин в дозе 100 мг/м2. Оба препарата вводились 1 раз в 2 недели до прогрессирования или неустранимой токсичности. Эффект зарегистрирован в 30%, клиническое улучшение – в 50%. Медиана выживаемости – 9,5 мес., 40% выжили 1 год (что не типично) [31]. Режим GEM-OXA был применен для терапии больных РПЖ, переставших отвечать на гемцитабин в монотерапии. Клиническое улучшение отмечено у 51,6% больных. Были обобщены материалы трех рандомизированных исследований, сравнивающих результаты применения гемцитабина и комбинации гемцитабина с производными платины. Во всех исследованиях отмечено достоверное увеличение времени до прогрессирования и статистически незначимое увеличение общей выживаемости.
В исследовании Е6201 сравнили 3 различные модификации лечения распространенного РПЖ – монотерапию гемцитабином (280 больных), инфузионное введение гемцитабина (FDR – 277 пациентов) и комбинацию GEM-OXA. Медиана общей выживаемости составила 4,59; 6,01 и 6,47 мес. соответственно, но результаты статистически недостоверны. Позитивным было исследование, выполненное в Великобритании. Сравнение комбинации гемцитабина и капецитабина и монотерапии гемцитабином было в пользу комбинированного лечения: эффект зарегистрирован соответственно в 14,2% и 7,1% случаев (р = 0,008), 1 год выжили 23% и 17% (р = 0,023), медиана общей выживаемости – 7,4 и 6,0 мес.
Оральные фторпиримидины UFT и S1 широко комбинировались с гемцитабином. Клиническое улучшение при комбинации UFT и GEM отмечалось у 50% больных, снижение маркеров – на 50% у трети пациентов, медиана выживаемости составляла 8,3 мес. Режим GEM + S1 был оценен в 2007 г. Частичный эффект зарегистрирован у 44% больных, медиана времени до прогрессирования составила 5,9 мес., медиана общей выживаемости – 10,1 мес., 1 год выжили 33% больных. В рандомизированном исследовании сравнивали монотерапию гемцитабином и комбинацию GS (гемцитабин 1000 мг/м2 инфузионно в течение 30 мин в 1-й и 15-й дни и S1 40 мг/м2 перорально дважды в день в 1–14-й дни, каждые 4 недели). Контроль болезни достигнут в 56,6% для Гемзара и 79,3% для комбинации GS (р = 0,021); медиана времени до прогрессирования 3,6 и 5,4 мес. соответственно (р = 0,036); медиана общей выживаемости – 8,7 и 14,1 мес. (р = 0,105) [32].
На ASCO в 2010 г. были представлены результаты исследования FOLFRINOX данной схемы по сравнению с монотерапией Гемзаром. В иcследование включены 342 пациента – объективный ответ 31,6 и 9,4 (р = 0,0001); медиана выживаемости составила 10,5 мес. (p < 0,0001); общая выживаемость – 11,1 и 6,8 мес. (НР 0,57; р < 0,001) [33]. Из-за малой чувствительности к классической химиотерапии в мире широко осуществляется оценка эффективности при РПЖ таргетных лекарств. В фундаментальных исследованиях доказана роль активации рецепторов эпидермального фактора роста (EGFR) в прогрессировании РПЖ, они экспрессированы в опухолевых клетках РПЖ в 90%. Паракринное образование лиганда эпидермального фактора роста (EGF) и трансформирующего фактора роста альфа (TGF-α) и их взаимодействие с упомянутыми рецепторами запускают и контролируют агрессивную пролиферацию клеток РПЖ.
Среди ингибиторов этого сигнального пути доказанный клинический интерес представляет эрлотиниб. Эрлотиниб – высокоселективный ингибитор тирозинкиназного домена EGFR, конкурирует с АТФ, подавляет фосфорилирование тирозинкиназ, относится к подгруппе малых молекул, прерывает передачу пролиферативных и ангиогенных сигналов. Высокий уровень стабилизации при терапии больных с метастатическим РПЖ гемцитабином и эрлотинибом был замечен в 2004 г.
III фаза исследования этого режима в сравнении с монотерапией гемцитабином осуществлена в Канаде на 569 больных РПЖ (исследование РА3). Пациенты получали ежедневно внутрь эрлотиниб по 100–150 мг и 7 еженедельных доз гемцитабина по 1 г/м2, безрецидивная и общая выживаемость в группе с дуплетом была более продолжительной – 6,24 и 5,9 мес. (HR 0,76 (для БРВ) и 0,81 (для ОВ), p = 0,025), один год выжили 24% и 17%. На основании этого исследования FDA разрешило применение эрлотиниба при метастатическом раке поджелудочной железы.
Из особенностей этого исследования следует отметить, что не было замечено корреляции между уровнем экспрессии EGFR и ответом на терапию эрлотинибом, тем не менее, если у пациентов отмечалась сыпь выше 2-й степени, они жили значительно дольше, чем другие, – 10,5 и 5,8 мес. Таким образом, пока нет маркера, предсказывающего эффект эрлотиниба. Эрлотиниб вместе с капецитабином изучался во 2-й линии терапии РПЖ, резистентного к гемцитабину. Эффект и стабилизация зарегистрированы соответственно у 11% и 57% больных, медиана выживаемости у этой тяжелой группы больных составила 202 дня. Результаты применения других таргетных препаратов к настоящему времени разочаровывают специалистов. Подчеркнем огромную потребность в исследованиях новых генных мишеней и создании активных таргетных препаратов против них. В 2011 г. при РПЖ изучают более десятка новых молекул.
Заканчивая обзор комбинированной химиотерапии РПЖ, укажем, что ни один из перечисленных режимов не является эталоном химиотерапии. За последние годы было оценено 33 рандомизированных исследования (6026 больных). Сравнение симптоматического лечения и химиотерапии выявило преимущество последней с точки зрения продолжительности жизни. Риск смерти снизился на 36% (365 больных). Не получено достаточных доказательств, что 5-фторурацил в комбинации с другими препаратами может иметь преимущества в сравнении с монотерапией (700 больных). Доказано, что продолжительность жизни увеличивается при полихимиотерапии, включающей гемцитабин, в сравнении с монотерапией Гемзаром. Риск смерти снизился на 9% (14 исследований – 4060 больных). Анализ продолжительности жизни в подгруппах показал, что производные платины (3 исследования – 1077 больных) и капецитабин (3 исследования – 935 больных) увеличивают продолжительность жизни (HR 0,85 и HR 0,83), а комбинации с иринотеканом (2 исследования – 486 пациентов) и 5-фторурацилом (3 исследования – 879 больных) не влияют на сроки жизни (HR 1,01 и HR 1,11). Из препаратов целевой терапии для лечения РПЖ используется только эрлотиниб.
