Метаболический синдром у мужчин репродуктивного возраста
- Аннотация
- Статья
- Ссылки
Ниже публикуются результаты проведенного авторами исследования по изучению роли метаболических отклонений как возможных факторов риска нарушения половой функции и фертильности у мужчин с метаболическим синдромом и оценке эффективности применения метформина в сочетании с тестостеронзамещающей терапией при лечении мужчин репродуктивного возраста с МС.
Ниже публикуются результаты проведенного авторами исследования по изучению роли метаболических отклонений как возможных факторов риска нарушения половой функции и фертильности у мужчин с метаболическим синдромом и оценке эффективности применения метформина в сочетании с тестостеронзамещающей терапией при лечении мужчин репродуктивного возраста с МС.




Введение
В начале пути изучения метаболического синдрома ученые отметили, что сочетание повышенного артериального давления, ожирения, сахарного диабета и повышенного содержания холестерина в крови приводит к увеличению риска развития сердечно-сосудистой патологии. Определение этих четырех основных составляющих метаболического синдрома послужило основой возникновения еще одного названия МС – «смертельный квартет». Сегодня понятие МС включает гораздо больше, чем четыре признака, которые легко диагностируются с помощью лабораторных и инструментальных методов исследования в ходе рутинных методик лечебных учреждений.
Мужчины реже женщин пользуются услугами медицинских служб, предпочитают вообще не обращаться за медицинской помощью, часто умалчивают беспокоящие их проблемы, тем самым затрудняют своевременную диагностику метаболического синдрома. Для практической медицины важно раннее выявление МС, в связи с этим актуально выделение группы риска, среди которой высока вероятность выявления МС. К группе риска относят пациентов, у которых выявляются следующие нарушения: гипертония, абдоминальное ожирение, дислипидемия, сахарный диабет 2 типа, эректильная дисфункция, храп (симптом, который может сопровождать как минимум нарушение дыхания во сне, а также тяжелую форму синдрома апноэ во сне, что является угрожающим состоянием для жизни).
В целом метаболический синдром приводит к раннему старению мужского организма, к прогрессированию атеросклеротического процесса. Известные патофизиологические механизмы поражения сердечно-сосудистой системы точно так же относятся и к пенильной сосудистой системе. Сосудистые нарушения в сочетании с артериальной гипертензией приводят к эндотелиальной дисфункции сосудов, которая играет важную роль в патогенезе эректильной дисфункции. Кроме того, важную роль в патогенезе эректильной дисфункции у пациентов с метаболическим синдромом играет снижение уровня тестостерона в связи с его избыточной ароматизацией в жировой ткани.
Таким образом, метаболический синдром у мужчин приводит не только к высокому риску развития сердечно-сосудистых заболеваний, но и является фактором риска раннего возникновения эректильной дисфункции, стимулирует раннее наступление андропаузы, тем самым значительно ухудшая качество жизни данных пациентов.
Несмотря на огромное количество исследований в области изучения МС, до сих пор недостаточно изучено влияние метаболических нарушений на состояние мужской репродуктивной системы [6]. Нарушение фертильности у мужчин репродуктивного возраста с МС является важной медицинской и социальной проблемой, поскольку данное состояние часто приводит к ухудшению качества жизни пациентов, увеличению количества бесплодных браков, малодетных семей, что может способствовать разводам и ухудшению демографических показателей страны.
Целью проведенного авторами исследования явилось изучение роли метаболических отклонений как возможных факторов риска нарушения половой функции и фертильности у мужчин с метаболическим синдромом и оценка эффективности применения метформина в сочетании с тестостеронзамещающей терапией при лечении мужчин репродуктивного возраста с МС.
Материалы и методы
Под наблюдением находились 90 пациентов мужского пола с МС в возрасте от 22 до 59 лет (средний возраст 33,7 ± 5,6 лет). Контрольную группу составили 58 здоровых добровольцев. Проведена оценка корреляционных взаимосвязей между антропометрическими и лабораторными параметрами.
Обследование включало сбор анамнеза, анкетирование по вопросам питания и пищевого поведения, антропометрию (рост, масса тела, окружность талии и бедер); вычисление индекса массы тела и отношения окружности талии к окружности бедер; определение количества жировой ткани в организме с помощью анализатора жировых отложений в организме OMRON BF302 методом биоэлектрического сопротивления тканей; измерение артериального давления. Проводилось изучение углеводного обмена – уровень глюкозы определялся в капиллярной крови из пальца с помощью глюкометра «Глюкотренд» (фирма «Ф. Хоффманн – Ля Рош»), при проведении перорального глюкозотолерантного теста (ПГТТ) для нагрузки использовалось 75 г глюкозы, сахар крови измерялся натощак, а также на 60-й и 120-й минуте после нагрузки – для интерпретации результатов использовались диагностические критерии ВОЗ (1998). Определение липидного профиля выполнено на автоматическом биохимическом анализаторе SPECTRUM (фирма Ebbott); определение содержания лептина, С-пептида, ФНО-а проводилось методом иммуноферментного анализа с помощью стандартных наборов. Для определения индекса ИР использовалась методика расчета ИР-НОМА (Homeostasis Model Assessment) по формуле: глюкоза натощак (ммоль/л) х инсулин (мкЕД/мл) / 22,5. Расчет индекса Caro проводился по формуле глюкоза натощак (ммоль/л) / инсулин (мкЕД/мл). Уровень иммунореактивного инсулина определялся хемилюминесцентным методом на анализаторе Immulite. Определение уровня лютеинизирующего (ЛГ), фолликулостимулирующего (ФСГ) гормонов, пролактина (Прл), эстрадиола (Е2), тестостерона (Тобщ., св.) проводилось иммуноферментными методами в условиях лаборатории «Эфис». Особое внимание уделялось исследованию половой функции с изучением сексуального анамнеза анкетированием с помощью опросника МИЭФ (Международный индекс эректильной функции, International Index of Erectile Function – IIEF). Количественную оценку мужской копулятивной функции определяли по шкале МКФ О.Б. Лорана и А.С. Сегала, определение половой конституции мужчин – по шкале векторного определения (Г.С. Васильченко, 1977). Определение вибрационной и тактильной чувствительности полового члена – с использованием аппарата «Вибротестер ВТ-002М». Функцию пенильных сосудов оценивали методом регистрации постокклюзионных изменений диаметра периферических артерий (метод основан на использовании ультразвукового исследования полового члена с измерением диаметра кавернозных артерий у основания полового члена до и после 5 мин компрессии манжетой); спермиологическое исследование включало макро- и микроскопический анализ эякулята, осуществляемый согласно руководству ВОЗ (1992).
На втором этапе исследования для решения поставленных задач пациенты с МС методом случайной рандомизации были разделены на 3 группы: 1-я группа (сравнения) – пациенты, находящиеся на гипокалорийном питании в сочетании с умеренной физической нагрузкой, не получающие медикаментозную терапию; во 2-й группе проводилась терапия метформином; в 3-й группе проводилось лечение метформином в сочетании с тестостерон-замещающей терапией.
Математическая обработка полученных данных проводилась с использованием методов вариационной статистики, корреляционного и дискриминантного анализа. Доверительный интервал для средних величин вычислялся с заданным уровнем достоверности 0,95. Для оценки достоверности различий применялся параметрический критерий Стьюдента (t) и непараметрический критерий Пирсона (χ2), для корреляционного анализа – метод Спирмена.
Результаты и обсуждение
При сборе анамнеза было установлено, что наследственная отягощенность по составляющим кластер метаболического синдрома состояниям выявлялась у 91,1% мужчин. Чаще всего у ближайших родственников имела место артериальная гипертония (88,9%). На втором месте по частоте у родственников наблюдаемых пациентов встречалось ожирение (78,9%). Реже наследственный анамнез был отягощен заболеваемостью сахарным диабетом и МС (61,1 и 40,0% соответственно). У 36 (40%) мужчин имела место отягощенная наследственность по нескольким указанным состояниям.
Продолжительность заболевания у наблюдаемых пациентов колебалась от 4 до 18 лет и в среднем составляла 14 ± 8,1 года. Однако длительность течения метаболических и клинических нарушений, входящих в состав МС, была различной. Раньше всего проявлялось ожирение. Затем присоединялась артериальная гипертония, продолжительность которой в среднем составляла 9,1 ± 7,0 лет.
Масса тела у наблюдаемых пациентов колебалась от 85 до 148 кг и в среднем составляла 96,7 ± 13,9 кг. Индекс массы тела был значительно выше нормальных значений (p < 0,05). При этом у большинства мужчин (62,3%) ИМТ колебался от 30 до 39,9 кг/ м2, а у 18,9% был более 40,0 кг/м2.
Значимо отклонялись от нормальных значений средние показатели окружности талии и бедер (109,6 ± 11,5 и 121,6 ± 12,4 см соответственно), что приводило к увеличению индекса ОТ/ОБ до 0,94 ± 0,07 (p < 0,05). Такое соотношение окружности талии и бедер свидетельствовало о висцеральном типе ожирения.
Определение количества жировой ткани в организме методом измерения биоэлектрического сопротивления тканей также свидетельствовало о ее избыточном количестве. Масса в среднем составила 37,3 ± 9,6 кг, а удельный вес в общей массе тела в среднем составлял 38,8 ± 6,4%.
У больных МС было отмечено значимое повышение показателей содержания общего холестерина 5,70 ± 1,11 ммоль/л (норма 3,1–5,2 ммоль/л) и ТГ 2,42 ± 1,61 ммоль/л (норма 0,5–2,0 ммоль/л). Следует отметить снижение уровня ЛПВП и повышение уровня ЛПНП 1,22 ± 0,39 и 3,85 ± 1,18 ммоль/л соответственно (норма 0,9–1,9 и 1,5–3,5 ммоль/л соответственно).
Уровень глюкозы натощак колебался от 5,7 до 9,5 ммоль/л и в среднем составлял 6,42 ± 0,83 ммоль/л (норма < 6,1 ммоль/л). Выявлялся большой удельный вес мужчин (67,7%) с гликемией более 6,1 ммоль/л. Уровень гликированного гемоглобина составил в среднем 6,8 ± 0,7% при норме 4,7–6,4%.
Показатели концентрации инсулина в крови в среднем были в пределах нормы и составляли 14,5 ± 6,9 мкЕд/л. В связи с гипергликемией индекс НОМА превышал значения нормы – 4,32 ± 2,75 (N < 2,77). Наличие инсулинорезистентности было подтверждено у 82,2% больных МС.
Жировая ткань является не только пассивным источником энергии, но и вырабатывает вещества, обладающие разнообразным биологическим действием, которые могут влиять на активность метаболических процессов в тканях и различных системах организма либо непосредственно, либо опосредованно через нейроэндокринную систему. В связи с этим представляло интерес определение концентрации некоторых из этих цитокинов у наблюдаемых нами пациентов, а именно – определение концентрации лептина и ФНО-а.
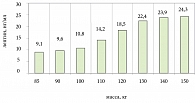
В результате исследования установлено, что уровень лептина прогрессивно увеличивался по мере нарастания массы тела (p < 0,05) (рис. 1).
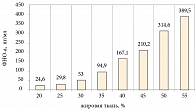
У наблюдаемых нами больных был выявлен высокий уровень ФНО-а – 398,43 ± 93,5 пг/мл, который коррелировал с массой тела (рис. 2) и инсулинорезистентностью (r = 0,91).
При анализе статистических взаимосвязей уровня ФНО-а наиболее значимые коэффициенты корреляции были выявлены с ОТ (r = 0,83), ОХС (r = 0,78), С-пептидом (r = 0,57).
Таким образом, для наблюдаемых больных МС были характерны абдоминальное ожирение, гипертриглицеридемия, нарушение толерантности к глюкозе или сахарный диабет 2 типа, артериальная гипертония.
Определялось содержание в крови наиболее важных в плане регуляции сексуальной функции гормонов эстрадиола, пролактина, тестостерона (общ., св.), лютеинизирующего и фолликулостимулирующего гормонов. Установлено, что средние значения указанных показателей у пациентов с МС находились в пределах нормы. Вместе с этим у половины (50%) мужчин содержание общего тестостерона в плазме крови было пониженным. По данным Европейского общества урологов (2006), уровень общего тестостерона менее 12 нмоль/л, свободного тестостерона менее 250 пмоль/л расценивается как признак гипогонадизма, что является показанием к проведению всех дальнейших диагностических этапов.
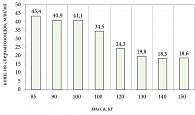
Было отмечено: по мере нарастания массы тела уменьшался уровень свободного и общего тестостерона (рис. 3).
Значимость зависимости между содержанием лептина, свободного и общего тестостерона была невысокой (r = 0,3565 и r = 0,4009 соответственно). Анализируя полученные данные, было отмечено наличие выраженной зависимости массы тела от уровня лептина и от уровня свободного и общего тестостерона у больных с МС.
Одной из жалоб у 90,1% пациентов была неудовлетворенность половой жизнью в связи со снижением возможности проведения полового акта с достаточной частотой и продолжительностью из-за нарушения эрекции различной степени выраженности, с быстрым наступлением эякуляции. Продолжительность нарушений половой функции у больных МС колебалась от 1,5 до 7 лет (в среднем 2,9 ± 1,5 года).
Чаще всего у наблюдаемых больных МС отмечалось нарушение эрекции – в 75,6% случаев. Анализ данных анкетирования по шкале МИЭФ показал, что средние значения суммарного балла составили 50,66 ± 6,04 и были ниже аналогичных показателей в группе контроля (57,36 ± 5,76). Эректильная функция у больных МС была оценена не выше 26 баллов – в среднем 21,57 ± 2,79 балла по сравнению с 32,51 ± 3,03 в контрольной группе. В связи с этим общая удовлетворенность составила 4,90 ± 1,51 балла, что также было ниже показателей в группе контроля (9,01 ± 1,38 балла). Указанные различия были статистически значимыми (р < 0,05).
В соответствии с категориями, определенными разделом «Эректильная функция» МИЭФ, 42,9% мужчин с МС имели легкую форму ЭД (18–25 баллов), 35,7% – умеренную ЭД (11–17 баллов) и 21,4% – тяжелую ЭД (10 баллов и менее). Было установлено: по мере увеличения ИМТ нарастает тяжесть ЭД и повышается уровень лептина и ФНО-а.
Доказано, что эрекция полового члена является прежде всего гемодинамическим явлением, где решающую роль играет вазодилатация под контролем нейроэндокринной системы. Центральную роль в обеспечении такой вазодилатации с последующим увеличением притока артериальной крови к кавернозным телам играет оксид азота (NO), синтез которого происходит в неадренергических нехолинергических нервных окончаниях и эндотелиальных клетках артериальных сосудов полового члена с участием нейрональной и эндотелиальной NO-синтазы (синтетазы).
Изучение эндотелиальной функции пенильных сосудов у мужчин с МС свидетельствовало о недостаточном увеличении диаметра кавернозной артерии после компрессии полового члена. У мужчин с метаболическим синдромом, страдающих нарушениями эрекции, он был значительно снижен и колебался в зависимости от тяжести ЭД от 21,5 до 35,6% (в среднем 28,0 ± 7,1%) при показателях в контрольной группе 83,6 ± 10,5%. Это подтверждает гемодинамический механизм эректильных нарушений. Следует также отметить, что дополнительный вклад в развитие и поддержание ЭД вносит снижение уровня тестостерона, что проявляется не только снижением полового влечения, но и ведет к уменьшению синтеза NO [7], выработка которого является андрогензависимым процессом.
У подавляющего большинства больных (в 83,3% случаев) отмечался средний тип половой конституции, в единичных случаях имел место слабый и сильный тип. Следует отметить, что при анализе эректильной функции по шкале МИЭФ у пациента со слабой половой конституцией (2,4%) были выявлены самые низкие показатели эректильной функции, оценки удовлетворения от полового акта, общего сексуального удовлетворения, сексуального желания. Слабая половая конституция может быть фоном для результирующего воздействия в плане формирования сексуальных нарушений [8].
С целью количественной оценки состояния копулятивной функции у всех пациентов с МС использовалась шкала МКФ (шкала количественной оценки мужской копулятивной функции). У больных с половыми расстройствами были выявлены нарушения всех составляющих (табл. 1).
Таким образом, получены данные, свидетельствующие об отчетливой тенденции снижения половой функции в целом или ее отдельных составляющих у больных МС.
С целью установления значения изменения чувствительности рецепторного аппарата головки пениса в генезе копулятивных нарушений при МС проведено определение порога чувствительности головки пениса к вибрационной и тактильной стимуляции, которое проводилось «Вибротестером ВТ-002М» и филаментом. Из 82 обследованных пациентов нарушение пенильной чувствительности отмечалось у 47 (57,3%) больных.
Проводилось сопоставление показателей мужской копулятивной функции (средний балл по МИЭФ и МКФ) с отдельными составляющими МС. Взаимосвязь была установлена с массой тела (коэффициент корреляции r = 0,72 и r = 0,68 соответственно), количеством жировой ткани в организме (r = 0,57 и r = 0,63), с концентрацией лептина (r = 0,55 и r = 0,6), ФНО-а (r = 0,4 и r = 0,43), индексом НОМА (r = 0,39 и r = 0,42) и Сaro (r = 0,41 и r = 0,40).
Показатели спермиологического обследования, не соответствующие нормативным показателям ВОЗ (2001), были выявлены у 67,8% мужчин. Уменьшение объема эякулята (менее 2 мл) отмечалось у одной трети пациентов. У половины наблюдаемых больных было изменение цвета и рН эякулята (7,3 ± 0,16). Довольно часто встречаемыми отклонениями были изменения концентрации и функциональных способностей сперматозоидов. Уменьшение концентрации сперматозоидов менее 20 млн/мл отмечалось в 27 (30,1%) случаев. Чаще всего это была олигозооспермия 1-й степени – у 16 (17,8%) больных. Олигозооспермия 2-й степени имела место у 9 (10%) пациентов, азооспермия выявлялась у 2 (2,2%) больных.
Содержание живых сперматозоидов менее 40% наблюдалось у одной десятой части больных МС. Следует отметить, что довольно часто выявлялось снижение подвижности сперматозоидов: у 58,3% обследованных.
Морфологические изменения сперматозоидов были у 10,7% мужчин. Высоким было содержание и незрелых форм сперматозоидов. Более 2% незрелых форм было зарегистрировано в 47,6% исследований.
Таким образом, полученные данные позволили оценить функциональное и морфологическое состояние зрелых сперматозоидов и степень их активности у мужчин при МС. Отклонения от нормы наблюдались в отношении таких показателей, как вязкость эякулята, концентрация, подвижность сперматозоидов.
Было установлено, что с увеличением массы тела наблюдаемых мужчин снижается концентрация сперматозоидов в эякуляте (рис. 4). При этом, если при массе тела до 120 кг концентрация сперматозоидов находится в пределах нормальных значений, по мере нарастания массы тела концентрация не превышает 20 млн/мл. Выявлена прямая корреляция между синтезом тестостерона и концентрацией – r = 0,39 и подвижностью сперматозоидов – r = 0,42.
На фертильность мужчин с МС оказывало влияние содержание в крови лептина и ФНО-а. Корреляция этих показателей с данными сперматогенеза также имела прямой характер. Коэффициент корреляции между уровнем лептина и концентрацией сперматозоидов составил r = 0,6 и их подвижностью r = 0,35, а между ФНО-а и указанными характеристиками сперматогенеза – r = 0,59 и r = 0,32 соответственно.
Вместе с этим влияние на сперматогенез уровня глюкозы и инсулина (индексы HOMA, Caro) у наблюдаемых больных не было установлено (r = 0,12 и r = 0,15).
При оценке эффективности лечения наблюдаемых больных с МС установлено, что положительные результаты (удовлетворительные – улучшение показателей – и хорошие – достижение показателей, приближенных к значениям нормы) имели место у подавляющего большинства пациентов – у 95,6%. Наилучшие результаты были получены при использовании метформина (2-я группа) и при сочетании метформина с тестостеронзамещающей терапией (3-я группа) – в 96,7% случаев. В группе сравнения (1-я группа) при отсутствии медикаментозной терапии на фоне гипокалорийного питания и умеренной физической активности результаты были несколько хуже – положительная динамика в состоянии здоровья отмечалась у 90% мужчин (рис. 5). Несмотря на одинаковый результат лечения во 2-й и 3-й группах наблюдения в целом, все же при сочетании метформина с тестостеронзамещающей терапией было больше хороших результатов.
Установлено, что у мужчин молодого и среднего возраста с МС лечение метформином на фоне мероприятий, направленных на снижение массы тела, ускоряет темп снижения массы тела, а также усиливает благоприятный эффект на углеводный и липидный обмен.
Снижение массы тела к концу наблюдения произошло во всех группах больных: в 1-й группе в среднем на 6,7 кг, во 2-й группе – на 9,6 кг и в 3-й группе на 11,5 кг (рис. 6). В зависимости от методов лечения различались темпы снижения массы тела. Наиболее интенсивное снижение массы тела наблюдалось у больных 2–3-й групп. Эти различия стали носить значимый характер к концу наблюдения (p < 0,05).
Аналогичные тенденции отмечались в динамике ИМТ. При лечении больных МС метформином ИМТ снизился с 35,9 до 34,2, при его сочетании с препаратами тестостерона – с 35,9 до 34,0. В группе сравнения при первом визите ИМТ составлял 36,0, при последнем – 34,7.
На фоне лечения изменилось соотношение пациентов с различной степенью ожирения. Уменьшилась доля пациентов со II и III степенями ожирения, соответственно увеличилось количество пациентов с избыточной массой тела (ИМТ до 30 кг/м2) и I степенью ожирения.
Изменения параметров ОТ и ОБ по отношению к исходным данным носили недостоверный характер. Вместе с тем окружность талии после двух лет терапии уменьшилась на 5,2 и 5,9 см во 2-й и 3-й группах, а среди мужчин, не получающих медикаментозную терапию, – только на 3,1 см.
На фоне медикаментозного снижения массы тела отмечалось снижение уровня среднедневных САД, ДАД и ЧСС. Целевой уровень АД (ниже 140/90 мм рт. ст.) был достигнут у 47 больных (52,2%), среди которых 12 из 18 пациентов не получали препараты по поводу АГ и 13 из 24 пациентов находились на гипотензивной терапии. У 6 больных было уменьшено количество препаратов на 1, у 8 пациентов уменьшены дозы или кратность приема одного или нескольких гипотензивных препаратов.
Применение медикаментозной терапии способствовало компенсации углеводного обмена. Во всех группах значимо снизилось содержание в крови глюкозы, а во 2-й и 3-й группах – до нормальных значений. Подобная тенденция наблюдалась и к концу 2-го года лечения. При этом суточная потребность в пероральных сахароснижающих препаратах у больных, получавших метформин, снизилась на 23,3% по сравнению с 10% у больных, находящихся только на диете.
Применение метформина сопровождалось снижением уровня инсулина на 17,5%, при его сочетании с тестостеронзаменяющими препаратами – на 19,3%. У пациентов, находящихся только на диете, снижение указанного показателя произошло на 8,6%. Соответственно изменился индекс HOMA при всех видах терапии. Его снижение было значимо только во 2-й и 3-й группах наблюдения.
Изучение липидного профиля свидетельствовало о снижении уровня холестерина, триглицеридов, липопротеина низкой плотности по сравнению с исходными данными, однако эти изменения не носили достоверный характер.
В процессе лечения отмечалось снижение уровня лептина, которое было значимым в основном при использовании в терапии метформина и его сочетания с тестостеронзамещающими препаратами. Этот процесс сопровождался значительным снижением (в несколько раз) содержания в крови пациентов ФНО-а. К концу наблюдения нормализовались показатели тестостерона.
Положительная динамика была получена и при анкетировании больных по шкале МИЭФ. Хотя повышение суммарного балла было статистически незначимым, возросла (до нормальных значений) оценка пациентами эректильной функции, особенно при сочетанном использовании метформина и препаратов тестостерона. В связи с восстановлением эрекции повысилась оценка полового влечения, общей удовлетворенности и других составляющих полового акта.
Полученные результаты подтверждают высокую эффективность, хорошую переносимость и целесообразность применения метформина в лечении пациентов с метаболическим синдромом. Наличие мужского гипогонадизма у пациентов с МС является показанием к тестостеронзамещающей терапии.
Выводы
- У мужчин репродуктивного возраста с МС в 90,1% случаев отмечаются нарушения половой функции в целом или ее отдельных составляющих (либидо, эрекция, эякуляция, оргазм). В структуре копулятивных нарушений основное место занимает эректильная дисфункция (75,6%).
- Нарушения копулятивной функции у больных МС сопровождаются в большинстве случаев изменениями сперматогенеза (концентрация и подвижность сперматозоидов), степень которых увеличивается с увеличением массы тела больных. Установлена прямая корреляционная зависимость уровня тестостерона с концентрацией и подвижностью сперматозоидов.
- На половую функцию и фертильность мужчин при МС оказывало влияние содержание в крови лептина, ФНО-а, а также состояние эндотелиальной функции пенильных сосудов, связанной с синтезом оксида азота, выработка которого является андрогензависимым процессом.
- При лечении мужчин репродуктивного возраста с МС положительные результаты были получены в 96,7% случаев на фоне комбинированного лечения гипокалорийной диетой, метформином и тестостеронзамещающей терапией. Метформин оказывает благоприятный эффект на углеводный и липидный обмен, способствует снижению массы тела, улучшает показатели артериального давления и половую функцию. Для предупреждения развития инфертильности мужчин с МС при наличии гипогонадизма алгоритм лечения должен включать тестостеронзамещающую терапию.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.