Роль печени и микрофлоры желудочно-кишечного тракта в патогенезе сахарного диабета 2 типа и ожирения
- Аннотация
- Статья
- Ссылки
- English
Закофальк NMX – первый пероральный препарат масляной кислоты и инулина в комплексной терапии метаболического синдрома для восполнения дефицита масляной кислоты (бутирата) и восстановления баланса кишечной микрофлоры.
Закофальк NMX – первый пероральный препарат масляной кислоты и инулина в комплексной терапии метаболического синдрома для восполнения дефицита масляной кислоты (бутирата) и восстановления баланса кишечной микрофлоры.
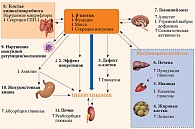
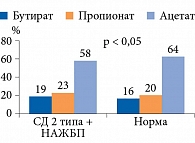


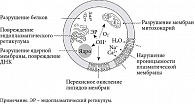

Нарушение состава кишечной микрофлоры имеет важное значение в патогенезе целого ряда заболеваний [1–6]. Так, дисбиоз толстой кишки является одним из важных патогенетических механизмов абдоминального ожирения и сахарного диабета (СД) 2 типа – основных компонентов метаболического синдрома (МС) (рис. 1). Установлено, что у экспериментальных животных при ожирении и СД количество Bacteroidetes снижается и соответственно увеличивается количество Firmicutes. Эти данные были подтверждены и у пациентов с МС. Ряд авторов полагают, что изменение в составе микробиоты кишечника можно рассматривать в качестве раннего диагностического маркера СД 2 типа [7, 8].
У пациентов с СД 2 типа наблюдается возрастание количества сульфатредуцирующих бактерий и снижение численности Аkkermansia muciniphila – бактерий слизистой, которые участвуют в регуляции барьерной функции кишечника [9]. При СД 2 типа и ожирении отмечается более высокий уровень так называемой метаболической инфекции (Desulfovibrio spp., Bacteroides spp. и Intestinibacter spp., Escherichia coli), ассоциированной с эндотоксемией, воспалением и инсулинорезистентностью.
Установлено, что нормальная микробиота кишечника способствует поддержанию оптимальной продукции гормонов инкретинового ряда в ответ на прием пищи, передачи сигнала по блуждающему нерву и контроля гликемии. Дисбиоз кишечника при СД 2 типа приводит к развитию резистентности к рецепторам глюкагоноподобного пептида (ГПП) 1 и 2, что во многом обусловливает последующее нарушение передачи сигнала через блуждающий нерв и инсулинового ответа [10]. Дисбаланс микробиоты также приводит к воспалению, секреции цитокинов (интерлейкина 6, фактора некроза опухоли α), инсулинорезистентности и микроциркуляторным поражениям слизистой оболочки толстой кишки (СОТК) [8, 11]. Нарушение функций кишечной микробиоты при СД 2 типа приводит к увеличению мембранного транспорта сахаров или разветвленных аминокислот, активности ферментов, участвующих в метаболизме ксенобиотиков и углеводов, и восстановлению сульфатов, а также нарушению синтеза бутирата и метаболизма витаминов [1–6].
Изменение кишечной микрофлоры вызывает повышенное поступление в кровь эндотоксина, который считается важным звеном формирования МС и атеросклероза. Дисбиотические нарушения в толстой кишке усиливают хронические циркуляторные расстройства. С последними ассоциируется ишемическое поражение толстой кишки. У больных СД 2 типа эти изменения в большинстве случаев остаются незамеченными, не проводится их своевременная диагностика и лечение. Так, микроишемический колит встречается у 54% больных СД. Дополнительным фактором его развития является нарушение тканевого метаболизма, обусловленное изменением микробиоты толстой кишки и метаболической дисфункцией короткоцепочечных жирных кислот (КЦЖК), являющихся метаболитами кишечной микрофлоры.
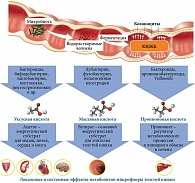
Короткоцепочечные жирные кислоты образуются при переработке неперевариваемых полисахаридов растительных волокон микроорганизмами, населяющими толстую кишку. К основным видам КЦЖК относят уксусную, пропионовую, масляную и валериановую кислоты. Каждая КЦЖК продуцируется анаэробными бактериями определенного вида, в частности уксусная кислота – бифидо- и лактобактериями, масляная кислота – бутират-продуцирующими Roseburia spp., Eubacterium hallii, Faecalibacterium prausnitzii.
Приблизительно 95% КЦЖК всасывается эпителием толстой кишки.
На продукцию КЦЖК микробиотой влияют такие факторы, как возраст, состав микробиоты, пищевой рацион, наличие сопутствующих заболеваний. Короткоцепочечные жирные кислоты должны продуцироваться в оптимальной пропорции. Так, соотношение ацетата, пропионата и бутирата должно составлять 60:20:20. Наиболее высокая концентрация КЦЖК в проксимальных отделах толстой кишки. По направлению к дистальным отделам она постепенно уменьшается из-за повышенного содержания токсичных и канцерогенных белковых субстанций [12–14] (рис. 2).
Лица с избыточным весом имеют более высокие уровни КЦЖК [15], в частности пропионата. Показано, что диетические добавки с КЦЖК могут способствовать улучшению гомеостаза глюкозы и чувствительности к инсулину, а также фактически препятствовать развитию ожирения. Так, Z. Gao и соавт. обнаружили, что диета с высоким содержанием жиров вместе с бутиратом предотвращает развитие резистентности к инсулину и ожирение у мышей [16]. H.V. Lin и соавт. установили, что добавление диеты с высоким содержанием жиров вместе с бутиратом или пропионатом нивелировало последствия высокожировой диеты [17]. Очевидные противоречия между этими и более ранними исследованиями могут быть связаны с тем, что КЦЖК действуют не только как источники энергии, но и как сигнальные молекулы. Они оказывают множество других воздействий на организм хозяина, включая влияние на гормональную систему и процессы воспаления [18].
На сегодняшний день активно изучается роль снижения пула бутират-продуцирующих бактерий и соответственно дефицита бутирата в толстой кишке у пациентов с СД и ожирением. Анализ образцов фекалий человека показал, что F. prausnitzii является основной бактерией, продуцирующей бутират. В эксперименте по трансплантации фекальных бактерий пациенты с инсулинорезистентностью получали фекальную микрофлору от инсулинчувствительных доноров, что приводило к значительному улучшению чувствительности к инсулину с увеличением количества бактерий, продуцирующих бутират [19]. Согласно результатам крупномасштабных исследований метагеномных ассоциаций в различных популяциях, численность F. prausnitzii и Roseburia в микрофлоре кишечника у пациентов с СД 2 типа оказалась ниже, чем у здоровых лиц. Кроме того, количество бактерий, продуцирующих бутират, было ниже и у пациентов с предиабетом [20], что может указывать на то, что отсутствие бактерий, продуцирующих бутират, является одним из предикторов заболевания.
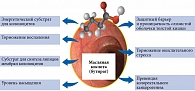
Масляная кислота (бутират, бутановая кислота) считается важным энергетическим субстратом для кишечного эпителия, тогда как пропионат и ацетат используются в качестве субстратов для липогенеза и глюконеогенеза в печени и периферических тканях [21]. Около 70% энергетической потребности эпителиоцитов кишечника удовлетворяется бутиратом, который преимущественно расходуется на синтез АТФ и фосфолипидов мембран клетки. Однако физиологические эффекты бутирата не ограничиваются только энергообеспечением колоноцитов. Бутират участвует практически во всех важнейших процессах поддержания кишечного гомеостаза: контролирует рост и нормальное развитие клеток кишечника, регулирует обмен воды и электролитов, поддерживает целостность слизистой оболочки кишечника, оказывает противовоспалительное действие, за счет регуляции рН (создает слабокислую среду) способствует созданию благоприятных условий для роста собственной полезной микрофлоры (рис. 3) [22].
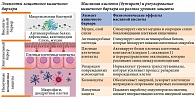
Важнейшим физиологическим эффектом масляной кислоты является регуляция барьерной функции кишечника и восстановление нормальной кишечной проницаемости. В настоящее время доказано, что повышение кишечной проницаемости играет ключевую роль в патогенезе как неалкогольной жировой болезни печени (НАЖБП) и неалкогольного стеатогепатита (НАСГ), так и СД 2 типа и ожирения. Известно, что у пациентов с СД 2 типа и ожирением повышенная кишечная проницаемость коррелирует с более высоким уровнем гликированного гемоглобина (HbA1c), гликемии, триглицеридов и биомаркеров воспаления В-лимфоцитов [23]. Установлено, что бутират может способствовать экспрессии белков плотных контактов и влиять на барьерную функцию слизистых оболочек [13, 24, 25]. Защитное воздействие бутирата в отношении кишечного барьера реализуется благодаря индуцированию синтеза муцина, он снижает проницаемость кишечника и предотвращает проникновение бактерий. Масляная кислота также уменьшает окислительный стресс и воспаление. Кроме того, бутират стимулирует выработку бокаловидными клетками слизи, противовоспалительных белков и др., по сути регулируя целостность кишечного барьера на всех уровнях защиты (рис. 4) [26].
Бутират также влияет на чувство насыщения путем стимуляции синтеза и секреции регулирующих аппетит пептидов (ГПП-1 и пептида YY (PYY)) [16]. Так, добавление в корм инулина и фруктоолигосахаридов – субстратов для образования КЦЖК, в том числе бутирата, приводило к ускорению насыщения, снижению массы тела и увеличению ГПП-1 и PYY у животных [16, 27].
В исследованиях in vitro и in vivo показано, что бутират увеличивал секрецию ГПП-1 и PYY [28–30]. ГПП-1 – гормон желудочно-кишечного тракта, который секретируется в основном энтероэндокринными L-клетками в дистальном отделе кишечника. Он оказывает множество биологических эффектов, включая глюкозозависимое инсулинотропное действие на β-клетки поджелудочной железы, снижение аппетита и замедление опорожнения желудка [30–32]. Используя систему культивирования клеток, H. Yadav и соавт. показали, что бутират стимулирует высвобождение ГПП-1 из L-клеток кишечника [28]. Однако в нескольких исследованиях на мышах с дефицитом FFAR3 установлено, что последний играет незначительную роль в стимуляции бутиратом ГПП-1. Полученные данные свидетельствуют о наличии дополнительных механизмов в опосредованной бутиратом стимуляции ГПП-1. PYY также синтезируется и высвобождается из эндокринных L-клеток. Данный пептид участвует в регуляции приема пищи, моторики кишечника и секреции инсулина. Как гормон кишечника, PYY может способствовать снижению ожирения [16, 27–36]. В многочисленных исследованиях продемонстрирована тесная связь между бутиратом и экспрессией PYY [37, 38]. На моделях in vitro P. Larraufie и соавт. установили, что бутират может увеличивать экспрессию PYY за счет усиления чувствительности микробов, которая зависит от Toll-подобных рецепторов [37].
Бутират также оказывает положительное влияние на секрецию и метаболическое действие гормона роста (GH) [39–42]. Используя линию опухолевых клеток гипофиза крысы, M.C. Miletta и соавт. показали, что бутират стимулировал синтез и секрецию GH, что улучшало липолиз и окислительный метаболизм [43].
Особый интерес могут представлять данные о том, что масляная кислота улучшает чувствительность гепатоцитов к ГПП-1 и, возможно, предотвращает прогрессирование НАЖБП [44].
Бутират влияет на инсулинорезистентность и обмен холестерина, что связано с усилением расхода энергии клетками, за счет усиления функции митохондрий [12].
Еще один из недавно открытых важных эффектов масляной кислоты – снижение повреждения эндотелия почечных клубочков при диабетической нефропатии. По-видимому, бутират подавляет пироптоз эндотелиальных клеток почечных клубочков, вызванный гипергликемией. Полагают, что масляная кислота блокирует индукцию каспазы 1, ингибируя тем самым высвобождение интерлейкина 1 и образование лизосом, что предотвращает повреждение клеток [45].
Как указывалось выше, нарушение тканевого метаболизма, обусловленное метаболической дисфункцией КЦЖК, является фактором риска развития микроишемического колита у пациентов с СД 2 типа. Масляная кислота, как основной источник энергии и регулятор клеточных функций эпителия кишечника, повышает способность слизистой кишечника к регенерации, предотвращает/уменьшает степень выраженности повреждений слизистой при обратимой ишемии кишечника, способствует ускорению ее восстановления [46].
Необходимо отметить, что применение КЦЖК при метаболическом синдроме не ограничивается рамками только экспериментальных исследований. Благодаря разработке новых лекарственных форм с доставкой активного вещества непосредственно в толстую кишку появились пероральные препараты, содержащие «чистый» бутират в эффективно заданной дозе. Данные лекарственные формы позволяют избежать всасывания бутирата в верхних отделах желудочно-кишечного тракта и обеспечить высвобождение в толстой кишке. К таким препаратам относится Закофальк (компания «Доктор Фальк Фарма»). Он содержит 250 мг готового бутирата и 250 мг пищевого волокна инулина.
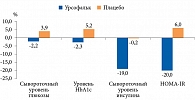
В пилотном рандомизированном двойном слепом плацебоконтролируемом исследовании, проведенном N. Roshanravan и соавт., оценивалась эффективность комбинации бутирата и инулина у пациентов с СД 2 типа в течение 45 дней [47]. На фоне такого лечения существенно снизились показатели системного воспаления (снижение уровня фактора некроза опухоли α) и окислительного стресса по сравнению с приемом плацебо (p < 0,05), а также достоверно увеличилось количество A. muciniphila в фекалиях. В другом двойном слепом плацебоконтролируемом исследовании комбинация бутирата и инулина положительно повлияла на показатели абдоминально-висцерального ожирения у пациентов с СД 2 типа. В данной группе достоверно уменьшались окружность талии, соотношение окружности талии к окружности бедер по сравнению с группой плацебо. У получавших комбинацию бутирата и инулина также наблюдалось достоверное снижение уровня глюкозы натощак и существенное повышение уровня сывороточного ГПП-1 [48].
В работе J.H. Burton и соавт. также доказана эффективность бутирата (в составе модуляторов микробиома) в комбинации с метформином в снижении побочных эффектов со стороны желудочно-кишечного тракта на фоне применения последнего и уровня глюкозы у пациентов с СД 2 типа [49].
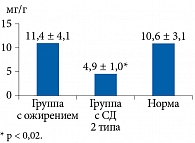
В Московском клиническом научно-практическом центре им. А.С. Логинова в 2019 и 2020 гг. авторами было проведено пилотное исследование по применению Закофалька в комплексной терапии у пациентов с СД 2 типа и ожирением. Обследовано 68 больных СД 2 типа и 28 – с ожирением (индекс массы тела более 30 кг/м2). Контрольную группу составили 20 человек. Группы были сопоставимы по возрасту, полу, сахароснижающей терапии. Кроме проведенного тщательного клинического обследования у всех участников исследования определялось содержание КЦЖК до и через четыре недели терапии Закофальком. У 45 пациентов с СД 2 типа при обследовании, включая капсульную эндоскопию, диагностированы эндоскопические и гистологические изменения СОТК, свойственные не диагностированному ранее микроишемическому колиту. У большинства пациентов с СД 2 типа и ожирением сопутствующим заболеванием был синдром раздраженного кишечника. Результаты исследования содержания КЦЖК представлены на рис. 5 и 6.
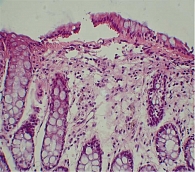
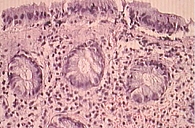
Суммарное определение КЦЖК нередко бывает малоинформативным и зависит от многих факторов. Информативным методом признан спектр качественного и количественного содержания основных КЦЖК. На рис. 7–10 представлены результаты гистологического исследования СОТК в сопоставлении с содержанием основных КЦЖК. Они свидетельствуют о признаках микроишемического поражения СОТК вследствие дефицита бутирата, который обладает протективным действием в отношении СОТК.
Кроме того, отмечалась тенденция к нормализации углеводного обмена и снижению уровня HbA1c (рис. 11).
Во многих исследованиях доказана тесная связь между СД 2 типа, НАЖБП и желчнокаменной болезнью (ЖКБ). Так, обнаружена корреляция индекса инсулинорезистентности (НОMA-IR) с ЖКБ (отношение рисков 2,25, p = 0,03). Распространенность ЖКБ выше среди пациентов с СД 2 типа. Сочетание жирового гепатоза (ЖГ) с СД 2 типа выявляется в 100% случаев, НАСГ и ЖКБ – в 42% случаев [50]. Проведенные собственные морфологические исследования печени и стенки желчного пузыря у больных СД 2 типа и ЖКБ свидетельствуют об однотипных изменениях в стенке желчного пузыря и сосудах эластического типа при атеросклерозе (рис. 12) [50].
Почти у 50% пациентов с СД 2 типа клинические проявления ЖКБ предшествуют диагностике НАЖБП [51]. Однако, согласно результатам собственных исследований, процессы камнеобразования, развития НАСГ и стеатоза печени протекают одномоментно, о чем свидетельствует пролиферация дуктул на фоне стеатоза печени (рис. 13 и 14) [52].
Сочетанное течение НАЖБП, ЖКБ и СД 2 типа обусловлено множеством однотипных патогенетических механизмов. В частности, эндотоксин-опосредованное увеличение свободнорадикального перекисного окисления липидов приводит к повреждению многих структурных компонентов клеток (рис. 15).
В основе формирования холестериновых камней при ЖКБ лежит перенасыщение желчи холестерином вследствие дислипидемии, нарушения энтерогепатической циркуляции желчных кислот и метаболической регуляции желчных кислот. Дефицит желчных кислот может приводить к синдрому избыточного бактериального роста, эндотоксин-опосредованному хроническому воспалению. Нарушение метаболической активности желчных кислот также играет важную роль в патогенезе НАЖБП, которая является основной причиной неэффективности лечения многих метаболических болезней, в том числе СД 2 типа.
В связи с этими данными обоснованным и оправданным становится применение препаратов урсодезоксихолевой кислоты (УДХК) в комплексной терапии СД 2 типа и ожирения.
Согласно представленному ниже метаанализу, УДХК может не только безопасно применяться у пациентов с СД 2 типа, но и обеспечивать снижение HbA1c на 0,5% за счет лечения НАСГ (рис. 16) [53].
В исследовании, проведенном V. Ratziu и соавт., продемонстрированы дополнительные эффекты высоких доз УДХК (25–30 мг/кг) при НАСГ, в частности улучшение показателей углеводного обмена при СД 2 типа и нарушении толерантности к глюкозе (рис. 17) [54].
Кроме того, УДХК является единственным препаратом, разрешенным к применению для растворения сладжа и желчных камней и профилактики их образования. Согласно данным метаанализа, применение УДХК при снижении массы тела на низкокалорийной диете и после бариатрической хирургии привело к более выраженному результату во втором случае (медиана – 10 кг, диапазон – от 6 до 25 кг против медианы 41 кг, диапазона от 25 до 51 кг). Однако профилактическое действие УДХК было более отчетливым у пациентов после низкокалорийной диеты, чем после бариатрической хирургии [55].
Оптимальным препаратом УДХК является Урсофальк (компания «Доктор Фальк Фарма»), который признан референтным препаратом УДХК в Российской Федерации и Евросоюзе. Выбор Урсофалька среди препаратов УДХК различных производителей определяется тем, что концентрация УДХК в желчи, по данным различных исследований с использованием одинаковых доз у пациентов, существенно различается [56]. Самая высокая концентрация УДХК в желчи определяется при лечении Урсофальком.
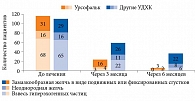
Высокая эффективность Урсофалька продемонстрирована в целом ряде клинических исследований. Так, в исследовании Л.И. Буторовой и соавт. доказана более высокая эффективность Урсофалька по сравнению с другими препаратами УДХК в растворении билиарного сладжа (рис. 18) [57]. Урсофальк оказался более эффективным и при выраженной стадии сладжа – замазкообразной желчи в виде подвижных или фиксированных сгустков.
Таким образом, перспективным подходом, позволяющим повысить эффективность лечения пациентов с СД 2 типа и ожирением, представляется назначение бутирата. Применение бутирата (Закофалька) в комплексной терапии приводит к снижению системного и местного воспаления, регуляции выработки ГПП-1 и ГПП-2, PYY, перепрофилированию микробиоты с лактата на бутират, снижению инсулинорезистентности, улучшению гликемического профиля, восстановлению целостности кишечного барьера, висцеральной чувствительности кишечника, стимуляции собственной бутират-продуцирующей микробиоты. При лечении микроишемического колита препарат способствует уменьшению метеоризма, болевого абдоминального синдрома, нормализации стула, модификации пищевого поведения.
В настоящее время продемонстрирована сильная патофизиологическая связь между СД 2 типа, НАЖБП и ЖКБ. Препаратом выбора при СД 2 типа и НАЖБП является Урсофальк.
L.A. Zvenigorodskaya, MD, PhD, Prof., M.V. Shinkin, A.M. Mkrtumyan, MD, PhD, Prof., A.O. Akopova, I.A. Morozova, PhD, S.Yu. Silvestrova, PhD
A.S. Loginov Moscow Clinical Scientific and Practical Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Mikhail V. Shinkin, jendis@yandex.ru
The gut microbiome can interact with food components, affecting the body's insulin sensitivity, intestinal permeability, glucose, and fat metabolism. Obesity and type 2 diabetes mellitus (T2DM) are often characterized by changes in the intestinal microflora, inflammation and violation of the intestinal barrier. Thus, in patients with T2DM, there is the increase in the number of sulfate-reducing bacteria and the decrease in the number of Akkermansia muciniphila – mucosal bacteria that are involved in the barrier function of the intestine. The decrease in the number of butyrate-producing bacteria may be the cause of impaired glucose metabolism. That is why, microbiota modification is considered as the therapeutic approach in patients with diabetes and obesity. This can be facilitated by the functional diet and use of prebiotics.
Zakofalk NMX is the first oral preparation of butyric acid and inulin in the complex therapy of metabolic syndrome to fill the deficiency of butyric acid (butyrate) and restore the balance of intestinal microflora.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.