Международные рекомендации по терапии ЛОР-инфекций: что применимо в российской действительности. XIX съезд оториноларингологов России
- Аннотация
- Статья
- Ссылки

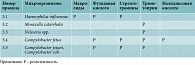



Резистентность основных возбудителей к антибиотикам первой, второй и третьей линий, применяемым в ЛОР-практике
Основные источники возбудителей инфекций – нестерильные отделы дыхательных путей – ротоглотка и носоглотка, микробиота которых представляет собой совокупность разнообразных микроорганизмов. До настоящего времени в микробиоте носоглотки не обнаружено ни одного универсального вида. Наиболее распространенные виды, такие как Moraxella, Haemophilus influenzae, Enhydrobacter (Proteobacteria), Streptococcus, Dolosigranulum (Firmicutus), Corynebacterium (Actinobacteria), выявляются лишь у 50% обследованных.
Риск развития острого среднего отита четко связан с колонизацией Moraxella, H. influenzae и другими более редкими патогенами1.
Докладчик уточнил, что вирусы являются проводниками всех последующих бактериальных инфекций. Однако единого представления о характере взаимодействия вирусов и бактерий в дыхательных путях (синергизм или конкуренция) до сих пор нет.
В верхних дыхательных путях присутствует достаточно большая группа традиционных (S. pneumoniae, H. influenzae, M. catarrhalis, S. pyogenes, Enterobacteriaceae), а также новых (Alloicoccuss otitidis, Pseudomonas otitidis, Turicella otitidis и Corinebacterium mucifaciens) патогенов, роль которых изучается.
Во всем мире наблюдается тенденция к распространению штаммов микробов, устойчивых к основным классам антимикробных препаратов. Из-за высокого уровня приобретенной резистентности о клинической значимости многих антибактериальных препаратов говорить не приходится. В связи с этим была предпринята попытка ранжирования антибиотиков на три линии этиотропной терапии ЛОР-патологий.
«В настоящее время мы переходим на европейскую систему оценки антибиотикочувствительности, на основании которой разработаны и утверждены отечественные клинические рекомендации по определению чувствительности микроорганизмов к антимикробным препаратам», – констатировал докладчик.
Для клиницистов оценка чувствительности – это прогнозирование эффективности лечения. Так, S. pneumoniae не вырабатывает бета-лактамазы, но способен изменять пенициллин-связывающие белки (ПСБ). Модификация ПСБ S. pneumoniae коррелирует с микробиологической устойчивостью микроба и снижением чувствительности к бета-лактамам. Устойчивость S. pneumoniae к антибиотикам в регионах России различна и имеет тенденцию к увеличению. Устойчивость S. pneumoniae в регионах к пенициллину за последние пять лет увеличилась: согласно европейским критериям оценки (European Committee for Antimicrobial Susceptibility Testing – EUCAST) (> 0,06 мг/л) – с 11,2 (2006–2009 гг.) до 19,8% (2014 г.), согласно североамериканским критериям (Clinical and Laboratory Standards Institution – CLSI) (> 2,0 мг/л) – с 1,4 до 3,7%2, 3. Наиболее высокий аффинитет к ПСБ и наиболее низкий показатель роста устойчивости S. pneumoniae демонстрирует амоксициллин.
Задачей антибиотикотерапии является эрадикация возбудителя, а также ликвидация его персистенции. Для этого требуется поддержание необходимой концентрации антибиотика в очаге инфекции на протяжении достаточного для причинно-значимого патогена времени.
Как показывает фармакодинамический расчет, чем больше отрезок времени, в течение которого концентрация препарата группы бета-лактамов в очаге инфекции превышает минимальную подавляющую концентрацию (МПК) (не менее 40–50% интервала дозирования), тем эффективнее результат. С этой целью следует применять оптимальные дозы препарата. Чем выше доза, тем эффективнее снижается уровень устойчивости патогена. «Использование высоких доз препарата амоксициллина/клавуланата как у взрослых, так и у детей позволяет создать оптимальную концентрацию активных компонентов в очаге инфекции и получить эффект даже в отношении микробов с МПК, равной четырем», – пояснил профессор С.В. Сидоренко.
Гемофильная палочка (H. influenzae) обладает способностью вырабатывать бета-лактамазы, уровень продукции которых с 2006–2007 гг. неуклонно растет, равно как и устойчивость H. influenzae к ампициллину. Именно поэтому для эрадикации гемофильной палочки, способной вырабатывать бета-лактамазы и модифицировать ПСБ, нужно использовать защищенные аминопенициллины (амоксициллин/клавуланат) или цефалоспорины третьего поколения (цефиксим).
Профессор С.В. Сидоренко кратко охарактеризовал основные механизмы устойчивости микробов к макролидам – лекарственным средствам, в большинстве своем антибиотикам, основой химической структуры которых является макроциклическое 14-, 15- или 16-членное лактонное кольцо с присоединенными к нему одним или несколькими углеводными радикалами. У микроорганизма могут развиться специальные приспособления, с помощью которых он словно насосом выкачивает антибиотик из своей внутренней среды или «прикрывает мишень от антибиотика щитом». Наиболее эффективно его насос выкачивает 14- и 15-членные макролиды4.
В Юго-Восточной Азии устойчивость S. pneumoniae к макролидам достигает 80–90%. Во Франции благодаря политике, направленной на сокращение применения антибиотиков, устойчивость S. pneumoniae резко снизилась. В российских регионах, как и в столице, за последние пять-шесть лет устойчивость S. pneumoniae к макролидам возросла в 2–2,5 раза.
В проекте экспертных правил, опубликованном EUCAST в текущем году, впервые указано, что H. influenzae обладает природной устойчивостью к макролидным антибиотикам (см. таблицу).
Фармакодинамические данные, совпадающие с клиническими, продемонстрировали минимальную роль макролидов в лечении гемофильной инфекции. Результаты исследования показали, что самая низкая частота персистенции H. influenzae у детей отмечалась на фоне терапии амоксициллином/клавуланатом в высокой дозе, цефиксимом, цефтриаксоном5.
Резюмируя сказанное, профессор С.В. Сидоренко представил следующую схему этиотропной терапии ЛОР-патологий:
- первая линия – амоксициллин;
- вторая линия – амоксициллин/клавуланат, пероральные цефалоспорины (цефиксим);
- третья линия – 16-членные макролиды (джозамицин), респираторные фторхинолоны.
Бремя выбора антибактериальной терапии тонзиллофарингитов в условиях нарастающей резистентности
БГСА сохраняет 100%-ную чувствительность к бета-лактамам. Препараты группы бета-лактамов остаются единственным классом антибиотиков, к которым у S. pyogenes не развилась резистентность. Устойчивость S. pyogenes к макролидам в ряде стран превышает 30%. Согласно данным за 2006–2009 гг., в крупных городах России, в частности в Москве, на фоне сохраняющейся высокой чувствительности S. pyogenes к бета-лактамам отмечается негативная тенденция к росту устойчивости (в несколько раз) данного микроорганизма к макролидным антибиотикам6.
Многоцентровое исследование резистентности клинических штаммов S. pyogenes позволило изучить их устойчивость, прежде всего к макролидам, в различных регионах. Частота резистентности к эритромицину достигала 11,4%. Почти в 90% случаев резистентность была обусловлена метилированием рибосом, в 10% – активным выведением антибиотика из клетки (эффлюксом)6.
БГСА – экстрацеллюлярный патоген. Однако доказано, что, продуцируя многочисленные инвазивные факторы, он может проникать в тонзиллярные эпителиальные клетки. Данное явление называется интернализацией. Именно внутриклеточное расположение БГСА становится резервуаром для рецидивирующих стрептококковых инфекций на небных миндалинах. Но, принимая во внимание, что БГСА находится во внутриклеточном пространстве в персистирующем состоянии, макролиды как бактериостатические антибиотики не активны в отношении данного возбудителя.
Врачи при назначении антибиотиков используют эмпирический подход, поскольку сразу идентифицировать возбудителя сложно. По мнению профессора Г.Н. Никифоровой, при назначении эмпирической антибактериальной терапии пациентам с инфекциями ротоглотки врачи допускают следующие ошибки: применение антимикробных препаратов для эрадикации диагностически незначимых возбудителей, назначение ампициллина внутрь, а также фторхинолонов, аминогликозидов, ко-тримоксазола, антимикробных препаратов с антианаэробной активностью, нистатина и рутинное назначение противогрибковой терапии.
Если говорить о сроках и продолжительности антибиотикотерапии, то основными ошибками являются ее позднее начало и частая смена антимикробного препарата. Между тем для замены последнего установлены четкие критерии: клиническая неэффективность, о которой можно судить через 24–72 часа от начала использования лекарственного средства, развитие тяжелых нежелательных реакций, высокая потенциальная токсичность, выделение возбудителя, резистентного к используемому препарату.
При нетяжелых респираторных инфекциях пенициллины демонстрируют низкую токсичность и предсказуемый профиль безопасности: нежелательные эффекты проявляются обычно в виде аллергических реакций и диспепсических расстройств7. При инфекционном мононуклеозе может наблюдаться ампициллиновая сыпь, у пожилых пациентов – холестатический гепатит. Все осложнения, как правило, протекают легко.
Почему же пенициллины, несмотря на отсутствие у S. pyogenes устойчивости к ним, не всегда эффективны при тонзиллофарингитах? По словам докладчика, это может быть связано с недостаточной приверженностью пациентов лечению и инактивацией незащищенных пенициллинов бета-лактамазами колонизирующих ротоглотку сопутствующих микроорганизмов – S. aureus, M. catarrhalis, H. influenzae.
Самым распространенным антибиотиком, применяемым при инфекциях ЛОР-органов, считается амоксициллин. Его преимущества, в частности при стрептококковой ангине, заключаются в высокой активности в отношении штаммов ключевых возбудителей (S. pneumoniae, S. pyogenes, H. influenzae), не продуцирующих бета-лактамазу, а также в низком уровне вторичной резистентности, хорошем профиле безопасности и удобстве приема. Амоксициллин отличается доказанной в контролируемых клинических исследованиях эффективностью и оптимальным соотношением «стоимость – эффективность».
Амоксициллину/клавуланату отдают предпочтение при обострении хронических, рецидивирующих, осложненных, бактериальных инфекций ЛОР-органов и после предшествующей терапии аминопенициллинами в течение месяца.
Макролиды – альтернатива пенициллинам при непереносимости и «атипичной» этиологии инфекции8. По клинической и микробиологической эффективности при стрептококковых инфекциях они сопоставимы с пенициллинами, если не принимать во внимание рост устойчивости патогенов. Однако при инфекциях, вызванных гемофильной палочкой и анаэробами, макролиды уступают амоксициллину/клавуланату в микробиологической эффективности. Показаниями к применению макролидов при остром тонзиллофарингите являются аллергия на препараты пенициллинового ряда, фармакодинамическая неэффективность бета-лактамов, низкая приверженность пациентов терапии.
Следует отметить, что применение традиционных форм амоксициллина/клавуланата может сопровождаться негативными явлениями, связанными с воздействием клавулановой кислоты на слизистую оболочку органов пищеварения, что провоцирует развитие диарейного синдрома у 24% больных. Использование пероральных антибиотиков в форме диспергируемых таблеток Солютаб позволяет решить данную проблему9, 10.
Принципиальным отличием формы диспергируемых таблеток Солютаб является заключение активного вещества в микрогранулы в целях защиты от неблагоприятного воздействия кислот и ферментов в желудке. Диспергируемые таблетки Солютаб отличаются от обычных лекарственных форм предсказуемой клинической эффективностью, снижением риска развития нежелательных явлений со стороны желудочно-кишечного тракта, повышением приверженности пациентов лечению, профилактикой рецидивов и уменьшением потребности в дополнительных курсах лечения.
В арсенале оториноларинголов имеются четыре антибиотика в форме Солютаб: Флемоксин Солютаб (амоксициллин), Флемоклав Солютаб (амоксициллин/клавуланат), Супракс Солютаб (цефиксим), Вильпрафен Солютаб (джозамицин).
В клиническом исследовании Флемоклав Солютаб продемонстрировал преимущество перед стандартной формой амоксициллина/клавуланата в уменьшении боли в горле и снижении температуры тела. Частота нежелательных явлений у больных паратонзиллярным абсцессом при использовании препарата Флемоклав Солютаб также была ниже, чем у пациентов, принимавших амоксициллин/клавуланат11.
Супракс Солютаб (цефиксим) относится к цефалоспоринам третьего поколения и характеризуется широким антимикробным спектром с высокой активностью в отношении M. catarrhalis, H. influenzae, Enterobacteriaceae. В отличие от аминопенициллинов цефиксим может применяться при моноцитарной ангине, когда нельзя исключить инфекцию, вызванную вирусом Эпштейна – Барр.
Природный 16-членный антибиотик из группы макролидов Вильпрафен Солютаб (джозамицин) активен в отношении многих типичных и атипичных возбудителей. Важно, что Вильпрафен Солютаб сохраняет активность в отношении ряда штаммов, устойчивых к эритромицину, кларитромицину, азитромицину. Кроме того, препарат разрешен к применению у беременных и детей.
В заключение профессор Г.Н. Никифорова предложила придерживаться следующих рекомендаций по терапии тонзиллофарингита:
- препарат выбора – феноксиметилпенициллин, амоксициллин;
- предшествующая антибактериальная терапия – амоксициллин/клавуланат, цефалоспорины второго и третьего поколений;
- при аллергии на бета-лактамы – макролиды;
- препараты глубокого резерва – линкозамиды.
Сложности выбора оптимального дозирования антибиотиков в терапии отитов
При воспалении нарушается мукоцилиарное очищение среднего уха, полости среднего уха заполняются экссудатом, иногда гнойным. В нашей стране 90% детей в возрасте до трех лет однократно переносят экссудативный средний отит, 50% – несколько эпизодов заболевания.
Неадекватная терапия острых респираторных вирусных инфекций (ОРВИ), несвоевременное дренирование барабанной полости у детей с острым средним отитом (ОСО), пренебрежение контролем восстановления слуховой функции привели к изменению его клинических исходов. Увеличилось число детей с бессимптомным, затянувшимся экссудативным процессом в среднем ухе и развившейся тугоухостью.
Предрасполагающими факторами развития среднего отита у детей младшего возраста считаются относительно короткая, широко и горизонтально расположенная слуховая труба, обструкция ее глоточного устья гиперплазированной глоточной миндалиной, физиологический отек слизистой оболочки задних отделов полости носа у новорожденных, усиление отека слизистой оболочки полости носа при прорезывании и смене зубов. Зачастую низкие уровни иммуноглобулина А способствуют присоединению вторичной микробной инфекции.
ОСО – заболевание с выраженной стадийностью течения. Выделяют стадию острого евстахиита, стадию катарального воспаления, доперфоративную стадию гнойного воспаления и постперфоративную стадию, репаративную стадию. Независимо от стадии интраназальная топическая терапия и системная терапия признаны основными.
Согласно клиническим рекомендациям Ассоциации оториноларингологов России (2014 г.), лечение ОСО включает патогенетическую (интраназальную) терапию для восстановления функции слуховой трубы, симптоматическую терапию для купирования болевого синдрома, предусматривающую применение системных нестероидных противовоспалительных препаратов (парацетамол, ибупрофен), местное лечение (лидокаин- и спиртсодержащие ушные капли) и парацентез барабанной перепонки, а также антибактериальную терапию.
С одной стороны, острое воспаление среднего уха чаще является осложнением ОРВИ и не все формы ОСО требуют назначения антибиотиков. С другой – лечение антибиотиками снижает риск развития мастоидита и ряда осложнений. Отечественные и зарубежные рекомендации указывают на обязательное назначение антибиотиков во всех случаях ОСО детям младше двух лет, а также пациентам со среднетяжелым и тяжелым течением заболевания. Выжидательную тактику можно использовать у детей старше двух лет при нетяжелом отите только в том случае, когда дети находятся под интенсивным наблюдением педиатра или ЛОР-врача с выполнением повторной отоскопии.
Согласно отечественным и американским рекомендациям по выбору антибиотика для эмпирической терапии инфекций верхних дыхательных путей, стартовым антибактериальным препаратом является амоксициллин12, 13. При аллергии на бета-лактамные антибиотики немедленного действия назначают макролиды, при аллергии на бета-лактамные антибиотики замедленного действия – цефалоспорины второго и третьего поколений.
При выборе антибиотика для детей учитывается не только его эффективность и максимальная безопасность, но и наличие детской лекарственной формы. Удивительными свойствами обладают таблетки Солютаб. Под воздействием жидкости таблетка распадается на микросферы, каждая из которых имеет защитную оболочку. Она становится проницаемой только под воздействием бикарбонатов в кишечнике. После этого действующее вещество высвобождается в зоне максимального всасывания. С клинической точки зрения сказанное означает, что диспергируемая лекарственная форма обеспечивает стабильное терапевтическое действие и снижает вероятность побочных реакций. Флемоксин Солютаб в отличие от амоксициллина в капсулах всасывается на 93% независимо от приема пищи, обеспечивая высокую эффективность терапии. На фоне применения Флемоклава Солютаб риск развития нежелательных реакций в три раза ниже, чем при использовании традиционных форм амоксициллина/клавуланата14, 15.
«В декабре 2012 г. была зарегистрирована новая форма препарата Супракс в виде диспергируемой таблетки Солютаб, которая существенно отличается от стандартной формы повышенной биодоступностью и эффективностью. Сегодня мы имеем всю панель формы Солютаб, которая обладает высокой биодоступностью. Биодоступность формы Солютаб сопоставима с инъекционными формами введения антибактериальных препаратов», – пояснила О.В. Карнеева.
Стартовым антибактериальным препаратом для лечения ОСО считается амоксициллин. В связи с угрозой роста лекарственной устойчивости пневмококков и других патогенов обсуждается вопрос о повышении дозы амоксициллина, в том числе амоксициллина/клавуланата. Американской академией педиатрии рекомендованы высокие стартовые дозы амоксициллина и амоксициллина/клавуланата, которые ориентированы на широкую распространенность пенициллин-резистентных штаммов пневмококка. Аналогична рекомендованная российским Альянсом клинических химиотерапевтов и микробиологов стартовая доза амоксициллина – препарата первой линии терапии ОСО у детей.
Как отметила О.В. Карнеева, между отечественными и зарубежными рекомендациями не существует значимых различий в критериях диагностики, оценке клинического течения, стадийности заболевания, подходах к лечению ОСО16. Существующая распространенность резистентности пневмококков к пенициллину в России позволяет в качестве стартовой стратегии антибактериальной терапии рассматривать средние дозы амоксициллина и амоксициллина/клавуланата 45–50 мг/кг/сут, сохраняя высокодозную терапию на позиции второй линии.
Стратегия национальных рекомендаций по антибактериальной терапии синуситов
Отечественные рекомендации разрабатывались с учетом как европейского, так и традиционного российского опыта лечения синуситов. Принципиальные отличия в антибиотикотерапии между EPOS и российскими стандартами отсутствуют.
Согласно европейским и отечественным рекомендациям, острый синусит – это воспаление слизистой оболочки околоносовых пазух и полости носа длительностью менее 12 недель. При хроническом синусите этот период превышает 12 недель.
Бактериальная этиология синусита имеет место в 55–65% случаев. Основными возбудителями острого бактериального риносинусита (ОБРС) являются так называемые респираторные патогены S. pneumoniae (19–47%), H. influenzae (26–47%), ассоциация этих возбудителей (7%), реже – бета-гемолитические стрептококки не группы А (1,5–13%), S. pyogenes (5–9%), не бета-гемолитические стрептококки (5%), S. aureus (2%), M. catarrhalis (1%), грамотрицательные патогены – редко17.
Профессор С.В. Рязанцев высказал предположение, что вакцинация российских детей пневмококковой конъюгированной вакциной, закрепленная в национальном календаре прививок с 1 января 2014 г., будет способствовать снижению роли резистентных пневмококков и изменению структуры возбудителей инфекций дыхательных путей: «На фоне снижения частоты инвазивных пневмококковых инфекций произойдет смещение в сторону H. influenzae. В этом случае на первое место в терапии синуситов выйдут цефалоспорины третьего поколения, более эффективные в отношении гемофильной палочки».
Основной целью лечения ОБРС является эрадикация возбудителя. Наиболее эффективны антибиотики, но назначать их нужно рационально, в соответствии с клиническими рекомендациями. В согласительных международных документах по лечению ОБРС, в частности в рекомендациях Американского общества по инфекционным болезням (Infectious Diseases Society of America – IDSA) 2012 г., зафиксированы более строгие показания к назначению антибиотиков. Так, в США не рекомендуется назначать любые макролиды и цефалоспорины третьего поколения18.
«Наш микробиологический пейзаж значительно отличается от американского и европейского, поэтому в клинической практике необходимо учитывать назначения, закрепленные в отечественных рекомендациях», – уточнил докладчик. Согласно последним российским рекомендациям по лечению синуситов, амоксициллин является препаратом первой линии19. В случае риска развития резистентности возбудителей – активных продуцентов бета-лактамаз в качестве стартовой терапии назначают защищенные аминопенициллины – амоксициллин/клавуланат. К препаратам второй линии терапии помимо амоксициллина/клавуланата относятся цефиксим, цефуроксим ацетил, цефдиторен. При непереносимости бета-лактамов препаратом выбора является 16-членный макролид джозамицин.
Детям с ОБРС в качестве стартовой терапии назначают амоксициллин внутрь 40–60 мг/кг/сут в три приема. При IgE-опосредованной анафилаксии на бета-лактамы таким пациентам рекомендуют джозамицин 40–50 мг/кг/сут в два-три приема.
Безусловно, выбор антибиотика конкретному больному должен быть основан на степени тяжести заболевания и сопутствующих факторах риска. Существуют категории пациентов, у которых обосновано использование ингибитор-защищенного аминопенициллина. Например, к факторам, обеспечивающим приоритет амоксициллина/клавуланата перед амоксициллином, относятся симптомы среднетяжелой или тяжелой формы бактериального риносинусита, сопутствующие патологии (сахарный диабет, хроническая сердечная, печеночная или почечная недостаточность, иммуносупрессия), возраст старше 65 лет.
В последнее время актуальной становится проблема антибиотик-ассоциированной диареи. Ее наличие подтверждается, если в течение двух или более последовательных дней имели место три или более эпизода неоформленного стула на фоне применения антибактериальных препаратов или в течение двух месяцев после его окончания. Установлено, что после терапии амоксициллином/клавуланатом постантибиотическая диарея у детей развивается в 18–24% случаев, у взрослых – в 12–16%. Это может быть обусловлено раздражающим действием клавуланата на слизистую оболочку кишечника и негативным влиянием на сапрофитную флору10, 11.
Фармакологические и клинические преимущества диспергируемых таблеток Солютаб предоставляют врачам и пациентам новые возможности в повышении эффективности и безопасности терапии синуситов. Помимо высокой биодоступности и эффективности таблетки Солютаб демонстрируют хороший профиль безопасности вследствие минимального влияния на микрофлору желудочно-кишечного тракта и уменьшения раздражающего действия на слизистую оболочку кишечника.
«В 2006 г. в детской клинике нашего института было проведено сравнительное исследование эффективности Флемоклава Солютаб и традиционного амоксициллина/клавуланата. Флемоклав Солютаб продемонстрировал существенно меньшую частоту диспепсических явлений и диареи, которая была в 2,5 раза ниже по сравнению с традиционным амоксициллином/клавуланатом11», – констатировал профессор С.В. Рязанцев.
Способность Флемоклава Солютаб снижать риск антибиотик-ассоциированной диареи подтверждена результатами исследования с участием взрослых пациентов с синуситом. На фоне применения Флемоклава Солютаб диарея или диспепсические расстройства наблюдались у 10% больных, а при использовании традиционного препарата амоксициллин/клавуланат – у 26,7%10.
Как уже отмечалось, в ближайшее время могут произойти изменения в структуре бактериальных возбудителей инфекций дыхательных путей. По мнению зарубежных авторов, терапия должна быть ориентирована на H. influenzae, M. catarrhalis, пенициллин-чувствительные штаммы S. pneumoniae. Для лечения заболевания, вызванного H. influenzae, рекомендуется использовать Супракс Солютаб, обладающий 100%-ной активностью в отношении гемофильной палочки.
В нашей стране возрастает устойчивость S. pneumoniae к макролидам, в первую очередь к 14- и 15-членным, которая в 2 раза выше, чем к 16-членным макролидам. В связи с этим весьма актуальны результаты исследования ПеГАС, продемонстрировавшие, что активность (96,0%) джозамицина, или Вильпрафена Солютаб, в отношении S. pneumoniae превышает таковую других макролидов20.
Антибиотики в форме диспергируемых таблеток Солютаб – это современные и высокотехнологичные совместные разработки голландских и японских ученых. По словам профессора С.В. Рязанцева, именно благодаря такой высокотехнологичной форме в России не было зарегистрировано ни одного случая фальсификации подобных препаратов. Способность таблеток Солютаб легко образовывать жидкие формы обеспечивает максимальное всасывание, что в ряде случаев эквивалентно инъекционной форме введения. В заключение докладчик выразил надежду, что применение инновационных форм позволит преодолеть микробную резистентность и повысить эффективность и безопасность лечения риносинусита.
Заключение
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.