Миофасциальный болевой синдром в практике клинициста: диагностика и лечение
- Аннотация
- Статья
- Ссылки
- English

Этиология
В настоящее время среди причин формирования миофасциального болевого синдрома (МБС) выделяют следующие [1]:
- аномалии развития костно-мышечного скелета, при которых нарушается положение тела с постоянным избыточным напряжением ряда групп мышц, например укороченная нога, плоскостопие, классическая греческая стопа;
- перенапряжение мышц при физиологических положениях тела, чаще связанное с особенностями профессиональной деятельности (работа за компьютером, вождение автомобиля и т.д.);
- длительная иммобилизация мышц, например долгое сохранение одной позы во время глубокого сна, иммобилизация конечности по поводу оперативных вмешательств, вывихов и переломов;
- непосредственное сдавление трапециевидных мышц, широчайшей мышцы спины, грудино-ключично-сосцевидной мышцы и др.;
- переохлаждение;
- психические нарушения;
- болезни внутренних органов и суставов. Болевая импульсация с пораженного висцерального органа или сустава приводит к защитному напряжению соответствующих мышц. Так, ишемическая болезнь сердца с приступами стенокардии или инфарктом миокарда, как правило, сопровождается МБС в лестничных, малой и большой грудных, подключичной и трапециевидной мышцах. От триггеров, активирующихся в перечисленных мышцах, боль иррадиирует в соответствующие зоны отраженных болей. Например, при поражении лестничной мышцы боль может ощущаться в спине, в частности в над-, под- и межлопаточной областях. Заболевания желудочно-кишечного тракта, например язвенная болезнь желудка, часто сопровождаются МБС с вовлечением паравертебральных мышц. Нередкой причиной МБС с вовлечением мышц тазового дна является гинекологическая патология. При последнем варианте хронические боли локализуются внизу живота, пояснице, области крестца. МБС, сопровождающий висцеральную патологию, меняет рисунок соответствующей соматической болезни, что может значительно затруднять ее диагностику;
- перегрузка нетренированных мышц;
- растяжение мышц с последующим спазмом при внезапном, неудачном повороте, броске, прыжке, чаще всего из-за значительной нагрузки на неподготовленные и неразогретые мышцы;
- прямой ушиб мышцы.
Патогенез
В отношении патогенеза МБС выдвинуто несколько гипотез.
Важное место отводится ишемическому спазму в результате физической травмы, например непосредственное повреждение или хроническое напряжение. Физическая травма приводит к стойкому высвобождению внутриклеточного кальция и пролонгированному сокращению части мышцы. Боль также может возникнуть из-за высвобождения серотонина, простагландинов и других медиаторов воспаления, которые в свою очередь приводят к последующему рефлекторному спазму мышцы. Продолжительное сокращение мышцы способно вызвать ишемию за счет уменьшения локального кровоснабжения. В результате возникает локализованный фиброз [2, 3]. Мышечный спазм как проявление неврологических осложнений остеохондроза или миофасциальных болей представляет собой базовый патогенетический механизм болевого синдрома. Он поддерживает и усиливает болевой синдром по принципу замкнутого круга. Эту модель энергетического кризиса подтверждают патологические изменения в биоптатах триггерных точек [4, 5]. Ею объясняется локальное напряжение, наблюдающееся в отсутствие двигательной активности соответствующей мышцы.
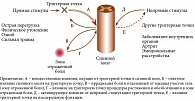
Другая гипотеза связывает возникновение МБС с гиперактивностью мышечных волокон. Одним из возможных механизмов, поддерживающих мышечный спазм в этом случае, является искаженная активность аномально функционирующих структурных единиц мышцы (рис. 1) [5].
Доказательством тому служит регистрация в области триггерных точек низкоуровневой биоэлектрической активности по результатам электромиографии. Повреждение мышечных веретен может приводить к боли, реализуемой симпатическими волокнами.
Согласно еще одной гипотезе, МБС развивается вследствие гиперактивности концевых двигательных пластинок. Именно поэтому считается, что у пациентов с МБС можно ожидать продолжительный эффект от применения ботулинического токсина, блокирующего аномальные концевые двигательные пластинки, поскольку подобная химическая денервация может быть устранена лишь при разветвлении и росте новых двигательных терминалей, а также при развитии новых нормальных концевых двигательных пластинок.
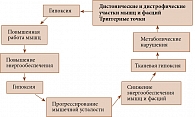
Наиболее убедительной представляется гипотеза о патофизиологии триггерных точек и опосредованном ими МБС, выдвинутая А.А. Лиевым и Г.А. Иваничевым [6]. Так, длительное статическое напряжение мышц (или групп мышц) влечет за собой увеличение их работы с целью компенсировать возникшую клеточно-тканевую гипоксию (рис. 2) [6].
Синдром клеточно-тканевой гипоксии неизбежно увеличивает работу мышц, которые в условиях развивающегося физиологического утомления требуют повышенного энергообеспечения (притока кислорода), что усугубляет гипоксию, способствует снижению оптимального энергетического обмена и в конечном итоге приводит к прогрессированию усталости. Метаболические нарушения в мышцах являются результатом несоответствия потребности в кислороде и его поступления.
Клиническая картина
Течение МБС характеризуется периодами обострений и ремиссии.
В период ремиссии жалобы на боль отсутствуют, однако может сохраняться незначительное напряжение мышц, в которых определяются латентные триггерные точки. Наиболее часто они локализуются в трапециевидной, лестничной, грудино-ключично-сосцевидной мышцах, а также в мышце, поднимающей лопатку, и квадратной мышце поясницы. Так, при обследовании 200 лиц молодого возраста, не имеющих каких-либо клинических симптомов МБС, локальную болезненность в мышцах плечевого пояса, вызванную латентными триггерными точками, при надавливании на которые не наблюдается симптома прыжка, обнаружили у 54% девушек и 45% юношей.
Под воздействием неблагоприятных факторов (охлаждение, перегрузка, сдавление, иммобилизация и т.д.) латентные триггерные точки могут перейти в активное состояние и сформировать картину МБС. Боль, отраженная от миофасциальных триггерных точек, обычно тупая и носит продолжительный характер. Часто ощущается в глубине тканей. Ее интенсивность может варьироваться в широких пределах – от незначительного дискомфорта до мучительной боли. Боль возникает в покое или при движении. Обычно отраженная боль может быть вызвана или усилена нажатием пальца на триггерную точку или ее пенетрацией инъекционной иглой. Чем чувствительнее триггерная точка, тем более интенсивна и устойчива отраженная боль, а также более обширно ее распространение, хотя боль редко отражается в симметричные участки тела [5].
При обследовании следует обратить внимание на следующие симптомы:
- пассивное растяжение мышцы усиливает боль в активных триггерных точках. Появление боли во время растяжения сопровождается защитным спазмом, который усиливает напряжение мышечных волокон и увеличивает болезненность при дальнейшем растяжении;
- боль усиливается при преодолении сокращающейся мышцей силы внешнего физического воздействия, она более выражена, если перед силовым сокращением мышца была в пассивном состоянии;
- максимальная сократительная сила пораженной мышцы ослаблена, и это не связано с атрофией мышцы или болью, которая появляется только при максимальных сократительных усилиях;
- в зоне отраженной от триггерной точки наблюдаются болезненность и нарушение чувствительности;
- в зоне отраженной боли могут возникать вазомоторные симптомы, например побледнение при стимуляции миофасциальных триггерных точек с последующей гиперемией, слезотечение и насморк, потливость и гусиная кожа;
- напряженность при пальпации части мышцы, находящейся в непосредственной близости от триггерной точки;
- триггерная точка при пальпации ощущается как четко ограниченная область с острой болезненностью, которая значительно менее выражена в нескольких миллиметрах от нее;
- нажатие пальцем на активную триггерную точку обычно вызывает симптом прыжка;
- щипковая пальпация вызывает локальную судорогу мышцы, что наиболее выражено при поражении таких мышц, как грудино-ключично-сосцевидная, большая грудная, дельтовидная, широчайшая мышца спины, мышца-разгибатель третьего пальца, плечелучевая, медиальная широкая мышца бедра и большая ягодичная мышца;
- умеренное непрерывное давление на активную триггерную точку вызывает или усиливает боль в отраженной зоне;
- выраженный дермографизм, легко определяется в верхней грудной и пояснично-крестцовой областях.
Лабораторное и инструментальное обследование
При проведении клинического анализа крови показатели С-реактивного белка, фибриногена, креатинфосфокиназы, лактатдегидрогеназы, циркулирующих иммунных комплексов и ревматоидного фактора находятся в пределах нормы, что характеризует отсутствие воспалительного процесса. Рентгенография позвоночника, специальная съемка мягких тканей и компьютерная томография позвоночника не выявляют каких-либо признаков, обусловленных действием миофасциальных триггерных точек. При электромиографическом обследовании пораженной мышцы в покое также не обнаруживаются патологические отклонения. Возможно выявление увеличенного количества полифазных потенциалов в мышце, имеющей триггерные точки. При термографическом исследовании кожи над активными триггерными точками определяется зона диаметром от 5 до 10 см с повышенной температурой. Кожная проводимость над триггерными точками может быть увеличена.
Диагностические критерии
Диагноз МБС ставится на основании клинического обследования и требует систематизированного подхода, включающего тщательное изучение анамнеза, целенаправленное выявление триггерных точек и сопутствующих соматических, психологических и поведенческих нарушений.
Диагностические критерии подразделяют на большие и малые [7, 8].
Большие критерии:
- жалобы на региональную боль;
- пальпируемый тугой тяж в мышце;
- участок повышенной чувствительности в пределах тугого тяжа;
- характерный паттерн отраженной боли или чувствительных расстройств;
- ограничение объема движений.
Малые критерии:
- воспроизводимость боли или чувствительных нарушений при стимуляции триггерных точек;
- локальное вздрагивание заинтересованной мышцы при пальпации триггерной точки или при инъекции в нее;
- уменьшение боли при растяжении или инъекции в мышцу.
Необходимо отметить, что для установления диагноза необходимо наличие пяти больших критериев и одного из трех малых.
Дифференциальная диагностика
Для дифференциальной диагностики выделяют три группы заболеваний, которые имеют сходные проявления с синдромами миофасциальных триггерных точек: миопатии, артриты, локальное воспаление тканей скелетной мускулатуры (тендинит и бурсит).
Патологические состояния, сопровождающиеся мышечными болями, в первую очередь связаны с ревматической полимиалгией и фибромиалгией [9, 10].
Диагностика ревматической полимиалгии проводится на основании следующих критериев: возраст старше 50 лет, двустороннее поражение двух из трех перечисленных областей (шея, плечевой или тазовый пояс) как минимум в течение одного месяца, скорость оседания эритроцитов более 40 мм/ч.
Фибромиалгия характеризуется хроническим течением с вовлечением множественных групп мышц, распространением боли на большую часть тела и наличием болезненных при пальпаторном воздействии точек, вызывающих только локальную боль. В отличие от фибромиалгии при МБС наблюдается тенденция к более выраженной острой боли с вовлечением меньшего количества мышц, а также триггерные точки со всеми признаками, перечисленными в таблице.
Нередко МБС приходится дифференцировать от полимиозита и дерматомиозита.
Известно, что в дебюте полимиозита у 85% больных имеет место отчетливая болезненность проксимальных мышц конечностей. В 15% случаев полимиозит проявляется в виде тупой боли в ягодицах, суставах и икрах, боль часто указывает на наличие артрита как проявления полимиозита или на комбинацию полимиозита с другими заболеваниями соединительной ткани. При полимиозите увеличена активность креатинфосфокиназы и лактатдегидрогеназы, при миофасциальных триггерных точках она не изменена.
Дерматомиозит включает полимиозит и кожные изменения – эритему, макулопапулезную сыпь и чешуйчатый экзематозный дерматит. Важным диагностическим признаком патологии является лабораторная и иммунологическая активность: синдром увеличенной скорости оседания эритроцитов, повышение уровня С-реактивного белка, фибриногена, гипергаммаглобулинемия, высокий уровень циркулирующих иммунных комплексов, выявление миозит-специфических антител. Боль, отраженная от миофасциальных триггерных точек в суставы, может имитировать боль при остеоартрите, ревматоидном, подагрическом и псориатическом артритах. Поскольку миофасциальные триггерные точки отражают боль в область связок и суставных сумок, ее часто ошибочно относят к проявлениям тендинита или бурсита.
Неврологические заболевания, как правило, диагностируются по наличию двигательных и сенсорных нарушений в области, иннервируемой пораженным нервом. Двигательные нарушения проявляются в виде мышечной слабости и мышечной атрофии, снижения или отсутствия рефлексов, а также в виде признаков острой или хронической невропатии. Сенсорные изменения обычно описываются больными как онемение, покалывание, жжение и т.д. Боль, отраженная от миофасциальных триггерных точек, обычно ощущается как глубокая и тупая и очень редко носит внезапный или молниеносный характер. В редких случаях пациенты с триггерными точками жалуются не на боль, а на потерю чувствительности (онемение), еще реже – на пульсирующую боль, имеющую сосудистое происхождение. Сенсорная невропатия легко выявляется при исследовании проводимости нерва. Необходимо отметить, что, с одной стороны, активные миофасциальные триггерные точки в мышцах стенки живота могут нарушать функционирование внутренних органов через вегетативные волокна (соматовисцеральный эффект), с другой – заболевания внутренних органов могут обусловливать висцеросоматический эффект, который проявляется в том, что боль, отраженная от больного органа в скелетную мускулатуру, активирует в ней сателлитные триггерные точки.
Инфекционные миалгии, которые ошибочно могут быть приняты как боли от миофасциальных триггерных точек, имеют вирусную, бактериальную и протозойную природу. Как правило, кроме боли, инфекции и инвазии они вызывают другие симптомы, которые не характерны для миофасциальных триггерных точек, но могут их активировать. Для инфекции также характерна истинная миалгия (диффузная болезненность мышцы) и лихорадка. Миалгия и активация триггерных точек могут сопровождать фебрильные инфекционные заболевания, например бактериальный эндокардит. У ослабленных больных стафилококковая или стрептококковая инфекция, как правило, сочетается с локальной миалгией. При стрептококковом миозите имеет место выраженная локальная отечность, боль и крепитация. Для анаэробной инфекции (клостридиальный миозит) характерна внезапная, сильная, локальная боль, которая возникает через несколько часов или даже недель после проникающего ранения.
Трихинеллез – хроническая инвазия скелетной мускулатуры личинками гельминта трихинеллы – характеризуется генерализованными мышечными болями и нередко сильной слабостью.
Малярия обычно вызывает головные и мышечные боли, связанные с перемежающимися лихорадками и ознобами.
Инициировать упорный МБС могут психические заболевания. У пациентов с психическими расстройствами болезненность мышц встречается значительно чаще, чем у здоровых лиц. Если после эффективного лечения боль от миофасциальной триггерной точки рецидивирует и продолжается даже при устранении болезненности и признаков ее активности, следует искать другие причины и проводить онкопоиск.
Лечение
Необходимым условием при лечении мышечной боли в период обострения является покой пораженной мышцы, исключение ее активной работы и длительных позных перенапряжений. При сильных болях рекомендуется соблюдать постельный режим в течение первых двух-трех дней.
При МБС часто применяют нестероидные противовоспалительные препараты (НПВП). Согласно современным стандартам, НПВП назначают в минимальных дозах и короткими курсами (7–14 дней). Данная рекомендация базируется на неблагоприятном спектре побочных эффектов НПВП. Наибольшее значение имеют гастроинтестинальные симптомы, которые потенциально могут привести к фатальной пептической язве и кровотечению. Поражение желудочно-кишечного тракта, пожалуй, одно из наиболее распространенных и ярких осложнений терапии НПВП. Таковое наблюдается у 10–20% пациентов. Установлено, что на частоту и выраженность гастропатий влияют длительность применения НПВП, их дозы и другие факторы. Однако эндоскопически выявляемые язвы желудка отмечаются приблизительно у 20% больных после кратковременного (семь дней) приема НПВП. Поэтому даже при кратковременном курсе нельзя пренебрегать спектром безопасности препарата.
Селективные ингибиторы циклооксигеназы (ЦОГ) 2 от традиционных НПВП отличает лучший профиль безопасности, что было подтверждено многочисленными клиническими исследованиями, включавшими несколько десятков тысяч больных. К таким препаратам относится нимесулид (Нимесил®). Хороший профиль гастроинтестинальной толерантности нимесулида доказан в ряде клинических исследований.
Фармакокинетической особенностью нимесулида является быстрая абсорбция.
Прием пищи, пол, возраст не оказывают значимого влияния на фармакокинетику нимесулида.
Кроме того, нимесулид обладает хорошим обезболивающим потенциалом. Так, нимесулид в дозе 100 мг реализует мощный анальгетический эффект уже через 10–15 минут после приема.
Более высокий анальгетический эффект нимесулида обеспечивается уникальным механизмом действия. Известно, что помимо ЦОГ-2-зависимого воздействия некоторые НПВП влияют на синтез и активность других нейроактивных веществ, участвующих в восприятии болевого раздражения центральной нервной системы (ЦОГ-независимый эффект) [11]. Нимесил® обладает такой ЦОГ-независимой модуляцией болевого восприятия, что вносит значительный вклад в его анальгетическую активность.
Помимо ингибирования ЦОГ-2 Нимесил® подавляет синтез свободных радикалов, протеолитических энзимов, цитокинов и гистамина. Влияние нимесулида на цитокины отличает его от других НПВП. Этим также объясняется быстрота и сила анальгетического эффекта.
Длительность действия (в течение 12 часов) препарата Нимесил® способствует стойкому блокированию первичного источника боли, что нивелирует риск ее хронизации.
Стандартный режим дозирования нимесулида (Нимесил®) – 100 мг/сут в два приема.
В России оценка терапевтического потенциала и безопасности нимесулида проводится на протяжении последних 20 лет. Сделан обзор этих исследований [12]. Так, в нашей стране проведено 21 исследование. Нимесулид назначали в дозе от 200 до 400 мг/сут на срок от семи дней до 12 месяцев. Общее количество пациентов – 1590. Помимо пациентов с ревматическими заболеваниями в исследования включали лиц с острыми травмами, а также перенесших стоматологические операции и страдающих урологической патологией. Активным контролем были пациенты, получавшие другие НПВП, в основном диклофенак, а также парацетамол, трамадол и гомеопатический препарат Артрофоон (n = 526) [12]. Установлено, что нимесулид не только не уступал препаратам сравнения, но даже превосходил их. При этом у 40–90% больных отмечалось значимое улучшение. Профиль безопасности нимесулида также оказался более высоким. Такая терапия существенно реже вызывала развитие язвы желудка и/или двенадцатиперстной кишки, повышение артериального давления, а также уровня аланинаминотрансферазы. При использовании нимесулида реже возникала потребность в прерывании терапии [12].
Проблема развития опасных сердечно-сосудистых осложнений при использовании нимесулида изучена недостаточно. Риск инфаркта миокарда при приеме этого препарата оценивался только в одном эпидемиологическом исследовании [13]. Финские ученые проанализировали 33 309 эпизодов инфаркта миокарда. Контрольная группа, сопоставимая по полу и возрасту, включала 138 949 человек. Относительный риск инфаркта миокарда для нимесулида составил 1,69. Это значение приближалось к соответствующему показателю для мелоксикама, набуметона, этодолака и неселективных НПВП.
Рассматривая вопрос безопасности нимесулида, необходимо уделить особое внимание проблеме гепатотоксичности. Согласно данным клинических испытаний, негативная динамика лабораторных биохимических показателей, свидетельствующая о развитии патологии печени, отмечается при использовании нимесулида с такой же частотой, что и при приеме других НПВП. При назначении нимесулида коротким курсом (не более 30 дней) повышение уровня аланинаминотрансферазы и аспартатаминотрансферазы в два раза и более отмечалось у 0,4% больных и не превышало 1,5% при длительном лечении (несколько месяцев) [14].
Длительность терапии НПВП при МБС обычно составляет 10–14 дней. Возможно местное применение НПВП в виде гелей и мазей.
Однако эффективная борьба с болью невозможна без психотропных средств. В острый период следует назначать транквилизаторы с мышечным релаксирующим эффектом (диазепам, хлордиазепоксид) по одной-две таблетки в день.
При рецидивирующем хроническом болевом синдроме, стойкий характер которого обычно связан с маскированной депрессией, назначают антидепрессанты, такие как амитриптилин в дозе 75 мг/сут, миансерин в дозе 30 мг/сут, пароксетин в дозе 20 мг/сут, флуоксетин в дозе 20 мг/сут. Анальгетический эффект антидепрессантов обычно наступает в начале второй недели терапии. Такое лечение должно быть длительным – не менее шести недель.
При МБС оправданно применение мышечных релаксантов, которые позволяют разорвать порочный круг «боль – мышечный спазм – боль». К данной группе препаратов относят баклофен, тизанидин, толперизон. Они уменьшают мышечный спазм, улучшают двигательную активность, облегчают проведение постизометрической релаксации мышц, массажа, лечебной физкультуры. В настоящее время чаще назначается тизанидин, который обладает мышечно-релаксирующим и анальгетическим эффектами. Его назначают в дозе 4–8 мг/сут в течение двух недель.
Хорошо себя зарекомендовали новокаиновые блокады. Инъекции желательно проводить непосредственно в болезненные мышечные уплотнения. При невозможности проведения блокады рекомендуется введение новокаина в болезненную спазмированную мышцу. Используются смеси новокаина с метамизолом, гидрокортизоном.
Эффективны также аппликации с димексидом на пораженные мышцы. Димексид рекомендуется использовать в виде 40%-ного раствора с добавлением новокаина, диклофенака, гидрокортизона. Аппликации накладывают не более чем на полтора часа в день. На курс рекомендуется десять аппликаций.
В последние годы появились данные об успешном применении ботулинического токсина типа А при состояниях, сопровождающихся мышечным напряжением.
Существенную роль в лечении МБС играют нефармакологические методы: постизометрическая релаксация, мануальная терапия, массаж, иглорефлексотерапия, физиотерапия и лечебная физкультура.
Приоритетной является постизометрическая релаксация. Ее проведение облегчается при предварительном согревании мышц легким массажем с втиранием мазей и гелей с обезболивающим и согревающим эффектами или лечении мышечными релаксантами.
Рекомендуется обучение больного приемам самопостизометрической релаксации.
Лечебную физкультуру следует начинать после исчезновения боли в покое. Комплекс упражнений должен быть подобран индивидуально, нагрузки наращиваться постепенно. Курс лечебной физкультуры проводится постоянно, без перерывов. Комплекс упражнений корректируется через несколько месяцев.
Для профилактики рецидивов МБС необходимы правильная осанка и положение тела за рабочим столом, а также оптимальный режим работы с периодическим расслаблением мышц через каждые 30 минут.
Заключение
Современные методы диагностики и дифференциальной диагностики позволяют установить диагноз МБС и начать эффективную медикаментозную и немедикаментозную терапию, что способствует улучшению прогноза у больных.
I.B. Belyayeva, MD, PhD, Prof., V.I. Mazurov, MD, PhD, Prof.
North-Western State Medical University named after I.I. Mechnikov
Contact person: Irina B. Belyayeva, belib@mail.ru
Myofascial pain syndrome (MPS) is considered as one of the most common pathological states. According to various authors, it occurs in 30-85% of the population. MPS is characterized by muscle spasm and the formation of painful compactions (trigger points) in them. In this case, the pain can be either local or segmental. This syndrome often causes pain in the shoulder, neck, lower back, and headache. It is associated not only with a decrease in the quality of life, but also with disability.
Sometimes the episodes of the disease last up to 12 months. Myofascial trigger points are the main source of skeletal muscle pain in children. Over the years, the frequency of active trigger points increases and reaches the maximum in middle age. In the later period of life, as motor activity decreases, muscle rigidity and limited movement caused by the presence of latent trigger points can be more often observed. Non-steroidal anti-inflammatory drugs, muscle relaxants, antidepressants, novocain blockades, and botulinum toxin type A are widely used for drug therapy of MPS. Among non-steroidal anti-inflammatory drugs, the preference should be given to nimesulide (Nimesil). It is highly effective and relatively safe in relation to the risk of serious complications from the gastrointestinal tract and cardiovascular system compared to traditional drugs of this group.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.