Рациональное применение нестероидных противовоспалительных препаратов у коморбидных пациентов с ревматическими заболеваниями: акцент на нимесулиде
- Аннотация
- Статья
- Ссылки
- English
Одним из наиболее предпочтительных нестероидных противовоспалительных препаратов для таких больных признан нимесулид. Он характеризуется не только высокой эффективностью, но и высоким профилем безопасности в отношении желудочно-кишечного тракта, почек и сердечно-сосудистой системы.
В статье представлены данные когортных международных и российских исследований эффективности и безопасности нимесулида в качестве длительной анальгетической терапии у коморбидных пациентов с ревматическими заболеваниями.
Одним из наиболее предпочтительных нестероидных противовоспалительных препаратов для таких больных признан нимесулид. Он характеризуется не только высокой эффективностью, но и высоким профилем безопасности в отношении желудочно-кишечного тракта, почек и сердечно-сосудистой системы.
В статье представлены данные когортных международных и российских исследований эффективности и безопасности нимесулида в качестве длительной анальгетической терапии у коморбидных пациентов с ревматическими заболеваниями.





Большая распространенность ревматических заболеваний, особенно среди лиц пожилого и старческого возраста, прогрессирующее первично-хроническое течение и ранняя инвалидизация больных представляют серьезную медико-социальную проблему [1].
Кроме того, у пациентов с ревматическими заболеваниями отмечается развитие сопутствующей патологии. Наиболее часто встречаются артериальная гипертензия, ишемическая болезнь сердца, ожирение, сахарный диабет 2 типа и гастропатии, ассоциированные с приемом нестероидных противовоспалительных препаратов (НПВП) [2]. Так, при остеоартрите ишемическая болезнь сердца развивается в 1,73 раза чаще, чем в отсутствие этой патологии [3, 4]. При ревматоидном артрите артериальная гипертензия диагностируется в 83,1% случаев, ишемическая болезнь сердца – в 10,2% [5–7].
У пациентов с ревматическими заболеваниями развитие инфаркта миокарда, сердечной недостаточности, острого нарушения мозгового кровообращения, внезапная смерть на десять лет опережают наступление указанных событий в общей популяции.
Замедление прогрессирования атеросклеротического поражения сосудов и дальнейшее снижение сердечно-сосудистого риска возможны в случае достижения медикаментозной ремиссии основного заболевания, при сочетанном применении противоревматических препаратов и статинов.
При ревматоидном артрите, остеоартрите, анкилозирующем спондилите и неспецифической боли в спине в качестве анальгетиков, как правило, назначают нестероидные противовоспалительные препараты [8].
Так, показаниями для применения пероральных форм НПВП у больных остеоартритом являются [10, 11]:
- сильная боль в суставе при клинических признаках локального синовита (боль, припухлость, повышение местной температуры);
- отсутствие адекватного ответа на применение локальных трансдермальных форм НПВП и парацетамола.
Необходимо отметить, что при выборе НПВП необходимо учитывать ряд факторов: эффективность, переносимость и безопасность [9].
Действие большинства НПВП реализуется за счет подавления активности циклооксигеназы (ЦОГ) – фермента, регулирующего биотрансформацию арахидоновой кислоты в простагландины, простациклин, тромбоксан.
На сегодняшний день идентифицированы две основные изоформы ЦОГ – ЦОГ-1 и ЦОГ-2. Они играют разную роль в регуляции многих физиологических адаптационных и патофизиологических процессов. В частности, установлена протективная роль ЦОГ-1 в поддержании физиологических процессов и роль ЦОГ-2 в индукции и поддержании воспаления.
Данные об участии ЦОГ-2 в индукции и поддержании воспалительного процесса стали предпосылкой для разработки новых НПВП – селективных ингибиторов ЦОГ-2, ассоциирующихся с меньшим риском развития желудочно-кишечных осложнений.
В настоящее время НПВП подразделяют на три группы:
- неселективные ингибиторы ЦОГ-1 и ЦОГ-2;
- селективные ингибиторы ЦОГ-2, которые в меньшей степени оказывают влияние на ЦОГ-1;
- высокоселективные ингибиторы ЦОГ-2, практически не действующие на ЦОГ-1.
Неселективные ингибиторы ЦОГ, или традиционные НПВП, такие как диклофенак, ибупрофен, кетопрофен, пироксикам, оказывают обезболивающий, жаропонижающий и противовоспалительный эффекты. Однако на фоне их применения могут развиться нежелательные явления вследствие блокады синтеза ЦОГ-1. Простагландины E2 и I2, которые синтезируются с участием ЦОГ-1 в желудочно-кишечном тракте, признаны цитопротекторами слизистой оболочки за счет снижения секреции париетальными клетками желудка соляной кислоты, улучшения кровотока и стимуляции выработки слизи. С участием ЦОГ-1 также происходит синтез тромбоксана A2 в тромбоцитах, обладающего вазоконстрикторным и проагрегантным свойствами.
НПВП, блокируя синтез ЦОГ-1, могут повреждать слизистую оболочку желудка и кишечника и нарушать агрегацию тромбоцитов. В связи с этим наиболее частыми побочными эффектами на фоне их приема являются НПВП-гастропатии (эрозивно-язвенные поражения желудочно-кишечного тракта, в первую очередь антрального отдела желудка и/или двенадцатиперстной кишки) и их осложнения (перфорации, кровотечения) (рис. 1, табл. 1) [9, 10].
К факторам риска развития желудочно-кишечных побочных эффектов относятся пожилой возраст (старше 75 лет), язвенный анамнез, сочетанное применение глюкокортикостероидов, тяжелые сопутствующие заболевания, прием высоких доз НПВП или одномоментное применение нескольких НПВП.
Для профилактики и лечения НПВП-индуцированных гастропатий используются ингибиторы протонной помпы (Омез в дозе 20–40 мг/сут, рабепразол в дозе 20–40 мг/сут, Ланзап в дозе 30–60 мг/сут), синтетические аналоги простагландина Е, мизопростол и др. Блокаторы H2-гистаминовых рецепторов (ранитидин, фамотидин) применяются редко из-за низкой эффективности.
Селективные ингибиторы ЦОГ-2 достоверно реже вызывают развитие НПВП-гастропатий. При этом по противовоспалительному и обезболивающему эффектам они сопоставимы с неселективными НПВП. Согласно современным рекомендациям, ингибиторы ЦОГ-2 следует назначать в следующих случаях [12, 13]:
- необходимость длительного приема НПВП;
- возраст пациентов старше 65 лет при наличии язвенных осложнений в анамнезе;
- одновременный прием глюкокортикостероидов и/или антикоагулянтов при наличии сопутствующих тяжелых заболеваний.
Способность НПВП повышать риск развития острого панкреатита была подтверждена в многочисленных исследованиях [14]. Прием НПВП увеличивал вероятность развития острого панкреатита. Так, отношение шансов (ОШ) составило 2,7 при 95%-ном доверительном интервале (ДИ) 2,4–3,0. При этом риск оказался максимальным при использовании диклофенака – ОШ 5,0 (95% ДИ 4,2–5,9).
Другой нежелательной реакцией на фоне длительного применения НПВП является нефропатия. Установлено, что ингибирование ЦОГ-1 приводит к снижению клубочковой фильтрации, а ингибирование ЦОГ-2 – замедлению реабсорбции натрия у здоровых добровольцев и лиц пожилого возраста. Это обусловливает нарушение электролитного баланса. НПВП-индуцированный электролитный дисбаланс встречается почти у четверти больных. В сочетании со снижением уровня сосудорасширяющего простациклина он способствует увеличению артериального давления и, следовательно, риска развития осложнений со стороны сердечно-сосудистой системы. Снижением уровня простациклина, участвующего в регуляции ренин-ангиотензин-альдостероновой системы, также объясняется возникновение гиперкалиемии на фоне длительного применения НПВП [9].
Опасность развития осложнений со стороны сердечно-сосудистой системы, вплоть до катастрофических – инфаркта и инсульта, не всегда принимается во внимание в должной степени. Многолетний опыт применения разных НПВП свидетельствует, что они неблагоприятно влияют на артериальное давление, повышают риск развития тромботических осложнений и фибрилляции предсердий.
Риск развития тромботических осложнений при использовании различных НПВП представлен в табл. 2 [13]. В основе повышения такового на фоне применения селективных ингибиторов ЦОГ-2 лежит нарушение баланса между тромбоксаном и простациклином, регулирующими эндотелиальную функцию и агрегацию тромбоцитов.
Среди неселективных ингибиторов ЦОГ-2 самый высокий риск развития осложнений со стороны сердечно-сосудистой системы демонстрирует диклофенак. Наиболее безопасным из группы неселективных ингибиторов ЦОГ-2 признан напроксен [13].
Доказано, что НПВП снижают эффективность антигипертензивной терапии [11, 12].
Кроме того, установлено, что одни НПВП (индометацин и ибупрофен) обладают способностью отменять антитромботический эффект низких доз аспирина, другие (кетопрофен, диклофенак, а также селективные ингибиторы ЦОГ-2) – не оказывают указанного воздействия.
Взаимодействие лекарственных средств имеет существенное клиническое значение не только в отношении уровня их эффективности, но и в отношении риска возникновения нежелательных явлений и осложнений. Взаимодействие НПВП с препаратами других групп, применяемых в ревматологии, представлено в табл. 3 и 4 [4].
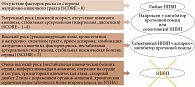
Тактика применения НПВП при наличии риска развития осложнений со стороны желудочно-кишечного тракта и сердечно-сосудистой системы представлена на рис. 2 [3].
При назначении НПВП коморбидным пациентам необходимо помнить следующее:
- применение пероральных НПВП ассоциируется с трех-пятикратным увеличением риска осложнений со стороны верхних отделов желудочно-кишечного тракта, в том числе перфорации пептической язвы, обструкции и кровотечения;
- использование гастропротекторных средств, таких как ингибиторы протонной помпы, может снизить риск развития осложнений со стороны верхних отделов желудочно-кишечного тракта на 50–60%;
- повышению риска осложнений со стороны верхних отделов желудочно-кишечного тракта способствуют такие факторы, как пожилой возраст, пептическая язва в анамнезе, сопутствующее лечение глюкокортикостероидами, аспирином или антикоагулянтами;
- назначения пероральных НПВП следует избегать у пациентов с высоким сердечно-сосудистым риском (артериальная гипертензия, ишемическая болезнь сердца и другие проявления атеросклероза, атерогенные дислипопротеинемии, сахарный диабет, хроническая сердечная недостаточность, курение);
- ибупрофен нельзя применять одновременно с низкими дозами аспирина в связи с клинически значимым фармакологическим взаимодействием;
- применения пероральных НПВП надо избегать при повышенном риске развития почечных нежелательных явлений (хроническая болезнь почек, скорость клубочковой фильтрации менее 30 мл/мин/1,73 м2 и т.д.).
Нестероидные противовоспалительные препараты противопоказаны следующим категориям пациентов:
- перенесшим аортокоронарное шунтирование, стентирование или другие чрескожные коронарные вмешательства, реконструктивные операции на сонных, мозговых и позвоночных артериях;
- с фибрилляцией предсердий (на протяжении всей жизни);
- с дестабилизированной хронической сердечной недостаточностью.
У перенесших острое нарушение мозгового кровообращения, инфаркт миокарда и аортокоронарное шунтирование следует рассмотреть целесообразность применения парацетамола и/или малых доз опиоидов, НПВП либо глюкокортикостероидов в виде параартикулярных или внутрисуставных инъекций.
Абсолютным противопоказанием для применения НПВП также является совместное применение ацетилсалициловой кислоты и клопидогреля, прямых оральных антикоагулянтов.
Одним из самых часто назначаемых нестероидных противовоспалительных препаратов, содержащих нимесулид, является Нимесил®. Нимесулид оказывает выраженный противовоспалительный и анальгетический эффекты при воспалительных ревматических заболеваниях. Кроме того, он обладает хорошим профилем гастродуоденальной переносимости.
Нимесулид относится к производным сульфонаниламида и преимущественно ингибирует ЦОГ-2, прежде всего в очаге воспаления.
Основной механизм действия нимесулида (Нимесила) заключается в ингибировании синтеза простагландинов, при этом в зоне воспаления оно интенсивнее.
Метаболизируется препарат в печени при помощи изофермента цитохрома Р450 CYP2С9.
Около 50% дозы нимесулида выводится почками.
Важно, что у лиц пожилого возраста фармакокинетический профиль нимесулида не изменяется при назначении как однократных, так и многократных (повторных) доз.
Установлено, что скорость элиминации нимесулида не зависит от возраста и пола пациента. Она не уменьшается при умеренно выраженном нарушении функции почек.
При повторном приеме препарата кумуляции не наблюдается [15].
Период полураспада нимесулида колеблется от 1,8 до 4,7 часа, но ингибиция ЦОГ-2 сохраняется по меньшей мере в течение восьми часов, а в синовиальной жидкости – 12 часов после недельного перорального приема в суточной дозе 200 мг [5].
Помимо основного механизма действия нимесулид и его активный метаболит 4-гидроксинимесулид обладают антиоксидантной активностью. Они подавляют образование свободных радикалов, угнетая экспрессию миелопироксидазы и тормозя экспрессию протеиназ, что позволяет прогнозировать высокую эффективность при поражении суставов, сопровождающемся острым синовитом [15].
В отличие от других НПВП нимесулид оказывает хондропротективный эффект. В исследованиях in vitro нимесулид продемонстрировал способность снижать уровень матриксных металлопротеиназ [16].
Кроме того, установлено, что нимесулид может ингибировать свободные радикалы, сформированные хондроцитами во время артритического процесса, а также интерлейкины 1, 5, 6 и фактор апоптоза хондроцитов, что в совокупности определяет выраженное протективное действие в отношении хрящевой ткани [16].
В многочисленных исследованиях подтверждена эффективность нимесулида в лечении острой боли любой этиологии [10–23], в частности острой боли в спине и пояснице [24, 25], при остеоартрите [26, 27], ревматоидном артите [28, 29], подагрическом артрите [30] и анкилозирующем спондилите [31–32].
При этом у пациентов с ревматическими заболеваниями, получавших нимесулид, риск развития осложнений со стороны желудочно-кишечного тракта был ниже, чем у применявших другие НПВП. Так, в когортном исследовании, включавшем 588 827 пациентов, которым были назначены НПВП с 2001 по 2008 г., продемонстрирован более низкий относительный риск поражения верхних отделов желудочно-кишечного тракта при применении рофекоксиба, целекоксиба и нимесулида, чем при использовании напроксена, ибупрофена, диклофенака, а также кетопрофена, пироксикама и кеторолака, – менее 2, от 2 до 5 и более 5 соответственно [33]. При этом относительный риск возникновения поражения верхних отделов желудочно-кишечного тракта для всех НПВП в данном исследовании составил 3,28 (95% ДИ 2,86–3,76).
Важно отметить, что в большинстве стран нимесулид назначается как анальгетическое средство на срок менее двух недель, в нашей стране преимущественно используется при хронических воспалительных ревматических заболеваниях в течение длительного периода. В связи с этим интерес могут представлять результаты ретроспективного анализа эндоскопических исследований верхних отделов желудочно-кишечного тракта, выполненных в клинике ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой» (НИИР) в 2011–2013 гг. пациентам с различными ревматическими заболеваниями, которые получали нимесулид не менее месяца до проведения фиброгастродуоденоскопии [34]. В качестве контроля были использованы результаты эндоскопических исследований, проведенных в этот же период всем пациентам, получавшим другие неселективные НПВП не менее месяца. Суммарно за три года эндоскопические исследования были выполнены 1048 пациентам, соответствовавшим критериям отбора и принимавшим нимесулид, а также 816 пациентам, использовавшим другие неселективные НПВП (диклофенак, кетопрофен, индометацин, ацеклофенак и ибупрофен). Незначительное число больных регулярно получали пироксикам, теноксикам, кеторолак или метамизол. Общее число лиц с эрозиями или язвами в группе нимесулида составило 244 (23,3%), в группе других НПВП – 272 (33,3%) (р < 0,001). При этом единичные эрозии чаще встречались на фоне терапии нимесулидом. Множественные эрозии и особенно язвы в данной группе выявлялись значительно реже. Так, на фоне приема нимесулида язва желудка и/или двенадцатиперстной кишки регистрировалась у 46 (4,4%) пациентов, других НПВП – у 119 (14,6%) [34].
Согласно полученным данным, нимесулид не увеличивает сердечно-сосудистый риск у пациентов с сердечно-сосудистыми заболеваниями [14].
В ходе отечественных исследований не выявлено дестабилизации артериальной гипертензии или гемодинамики на фоне его применения. Кроме того, ретроспективный анализ частоты развития побочных эффектов у 322 пациентов с различными ревматическими заболеваниями, принимавших нимесулид не менее года до поступления в клинику НИИР и продолживших его прием в течение всего периода госпитализации, показал, что длительный прием нимесулида не ассоциировался не только с высоким риском развития сердечно-сосудистых осложнений, но и с существенным нарастанием частоты гепатотоксических реакций. Большую часть пациентов составляли женщины (из них 18,6% в возрасте 65 лет и старше), страдавшие ревматоидным артритом и имевшие множественные коморбидные заболевания. Так, у 16% диагностирована ишемическая болезнь сердца, у 10% – сопутствующие заболевания гепатобилиарной зоны (желчнокаменная болезнь) и язвенная болезнь в анамнезе [35]. Более трети пациентов помимо нимесулида получали глюкокортикостероиды и цитотоксические препараты. У 10,6% пациентов сочетание ревматического заболевания с ишемической болезнью сердца стало причиной длительного комбинированного приема нимесулида и низких доз ацетилсалициловой кислоты.
Наиболее значимым класс-специфическим осложнением, связанным с использованием нимесулида, признано язвенное поражение желудочно-кишечного тракта – 13,3% обследованных. Дестабилизация или развитие артериальной гипертензии отмечены у 11,7% пациентов, клинически значимое повышение уровня аланинаминотрансферазы – у 2,2% [35].
Результаты крупного эпидемиологического исследования, в которое было включено 397 537 пациентов, получавших различные НПВП, продемонстрировали, что гепатотоксичность нимесулида не превышает таковую других НПВП. Риск гепатотоксичности при расчете на 100 тыс. пациенто-лет составил 35,3 для нимесулида, 39,2 для диклофенака и 44,6 для ибупрофена [36].
В более позднем исследовании, проведенном с участием 461 пациента, получавшего НПВП, показано, что серьезные гепатотоксические осложнения при приеме нимесулида развивались значительно реже, чем при использовании диклофенака и ибупрофена, – у 9, 12 и 18 пациентов соответственно [37].
Наиболее убедительными представляются результаты крупного многоцентрового исследования, проведенного в 57 центрах трансплантации в семи европейских странах [37]. В частности, в нем был установлен сопоставимый риск острого повреждения печени, приводящего к трансплантации, для всех НПВП. В данном исследовании риск оценивался как число трансплантаций, связанных с острым поражением печени, на 1 млн лет лечения. Для всех НПВП в среднем он составил 1,59 (95% ДИ 1,1–2,2): для ибупрофена – 2,3 (95% ДИ 1,2–3,9), для нимесулида – 1,9 (95% ДИ 0,8–3,7), для диклофенака – 1,6 (95% ДИ 0,6–3,4), для кетопрофена – 1,6 (95% ДИ 0,3–4,5).
Анализ спонтанных сообщений о нежелательных явлениях при применении нимесулида в зарубежной и отечественной клинической практике позволяет сделать вывод о том, что спектр осложнений, возникавших на фоне его приема, соответствует спектру нежелательных реакций, свойственных другим НПВП, и их частота относительно мала [38].
Исходя из сказанного выше, можно сделать вывод, что нимесулид является эффективным и безопасным препаратом для лечения различных ревматических заболеваний, характеризующихся развитием острой и хронической боли. Он отличается быстрым началом анальгетического и противовоспалительного действия, а также оптимальным соотношением «польза/риск» [16].
Нимесулид может стать оптимальным выбором для коморбидных пациентов.
I.B. Belyayeva, MD, PhD, Prof., V.I. Mazurov, Academician of RAS, MD, PhD, Prof.
North-Western State Medical University named after I.I. Mechnikov
Contact person: Irina B. Belyayeva, belib@mail.ru
According to international and national standards of treatment, the main analgesic agents for rheumatic diseases are non-steroidal anti-inflammatory drugs. They should be prescribed as topical therapy at the stages of diagnosis and differential diagnosis in order to achieve not only analgesic, but as well anti-inflammatory effect.
Nimesulide is recognized as one of the most preferred nonsteroidal anti-inflammatory drugs for such patients. The drug is being characterized not only by high efficiency, but also by a high safety profile in relation to the gastrointestinal tract, kidneys and cardiovascular system.
The article presents data from international and Russian cohort studies on the efficacy and safety of nimesulide as a long-term analgesic therapy in comorbid patients with rheumatic diseases.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.