Боли в спине: дифференциальная диагностика и патогенетическая терапия
- Аннотация
- Статья
- Ссылки
- English


Введение
Боли в спине (БС) занимают одно из лидирующих мест среди патологии опорно-двигательного аппарата. Согласно данным Всемирной организации здравоохранения, ими страдают около 4% населения земного шара. Наиболее частыми причинами БС считаются спондилез и воспалительные спондилоартропатии, которые проявляются механическими и воспалительными болями соответственно [1].
Боли в спине при различных заболеваниях опорно-двигательного аппарата
У 90–95% больных спондилезом в основе его развития лежат дегенеративные изменения в межпозвоночных дисках, телах позвонков и фасеточных суставах, дисфункция мышечно-связочного аппарата и сужение позвоночного канала [2]. Патология чаще возникает в возрасте 20–50 лет, хотя наиболее выраженные его проявления встречаются в возрасте 50–64 лет. Спондилез наиболее распространен у женщин (19–67%), что связано с дисгормональными нарушениями. Нередко патология развивается во время беременности и в постменопаузальном периоде [2, 3]. Причинами болевого синдрома, возникающего при дегенеративных изменениях позвонков, являются:
- механическое раздражение нервных корешков;
- раздражение болевых рецепторов на суставных поверхностях;
- болезненное мышечное напряжение, приводящее к нарушению осанки;
- локальное раздражение сосудов с нарушением метаболического транспорта;
- возникновение биохимических и иммунных реакций, которые завершаются формированием асептического нейрогенного воспаления в результате цитокинового каскада на разных уровнях.
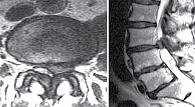
Грыжи диска наиболее часто сопровождаются типичной клинической картиной БС. Грыжа диска с компрессией корешка S3–4 вызывает типичную боль в пояснице с иррадиацией по задней поверхности бедра, передней области голени и заднебоковой поверхности стопы (рис. 1). Выпячивание пульпозного ядра и части фиброзного кольца в позвоночный канал – основная причина вертебральной боли.
Одним из осложнений спондилеза считается радикулопатия, возникновение которой связывают с микротравматизацией нервного корешка окружающими тканями. В нем развиваются воспаление, ишемия, отек. Клинические симптомы радикулопатии – стреляющие, радикулярные боли, распространяющиеся на ягодицу, бедро, икру и стопу, усиливающиеся при движении в поясничном отделе позвоночника. Для радикулопатии характерен истинный симптом Лассега (больной лежит на спине, при подъеме ноги в вертикальное положение появляются интенсивные боли в пояснице с иррадиацией по ходу пораженного корешка вплоть до стопы).
Достаточно частой причиной БС является миофасциальный синдром [4] с вовлечением мышц тазового пояса и нижних конечностей. В качестве основных причин его развития указывают длительную антифизиологическую позу, перегрузку нетренированных мышц, болезни висцеральных органов (желудочно-кишечного тракта (ЖКТ) и малого таза), аномалии развития скелета. Критериями диагностики миофасциального синдрома являются болезненные спазмированные мышцы, болезненные мышечные уплотнения, активные триггерные точки с формированием зон отраженных болей. Существенным для постановки диагноза является воспроизведение боли при надавливании на активную триггерную точку.
Боли в спине, появляющиеся после длительной ходьбы, указывают на возможность развития стеноза позвоночного канала. При обследовании сразу после физической нагрузки отмечаются слабость в нижних конечностях, снижение рефлексов и нарушение чувствительности.
Не редкость в ревматологической практике юношеская остеохондропатия, или болезнь Шейермана – Мау, – врожденный дефект развития опорных площадок (замыкательных пластинок) позвонков. Развитие данной патологии совпадает с периодом интенсивного роста (14–17 лет) и рентгенологически проявляется такими признаками, как двойной контур опорных площадок, многочисленные грыжи Шморля, клиновидная деформация тел позвонков и ранние дегенеративные изменения.
Боли, продолжающиеся более двух месяцев, служат индикаторами вторичного синдрома БС. Причины состояния могут быть различными: врожденные аномалии (спондилолистез – смещение вперед вышележащего позвонка из-за дефекта межсуставной части), травмы, воспалительные заболевания позвоночника, опухоли позвоночника, инфекционные поражения позвоночника, нарушения метаболизма, заболевания мочеполовых органов, проекционные боли при заболевании внутренних органов. Вторичный синдром БС чаще развивается у лиц моложе 20 лет и старше 50 лет.
Одной из важных причин БС является остеопороз и его осложнения в виде переломов позвоночника, нередко встречающихся у женщин в постменопаузальном периоде (рис. 2).
Среди причин воспалительных БС определенное место занимают воспалительные заболевания позвоночника – спондилоартриты, которые клинически проявляются при реактивных артритах, анкилозирующем спондилите, псориатическом артрите, а также при воспалительных заболеваниях кишечника, ассоциированных со спондилитом (неспецифический язвенный колит и болезнь Крона). Для спондилоартритов основным признаком является воспалительная боль в спине, которая характеризуется следующими критериями:
- возраст начала – моложе 40 лет;
- постепенное начало;
- уменьшение после физических упражнений;
- возникновение в покое;
- возникновение в ночное время (улучшение после пробуждения).
БС считается воспалительной при наличии четырех любых критериев Международного общества по изучению спондилоартритов 2009 г. [5].
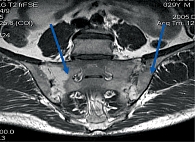
Классификационные критерии аксиального спондилита основаны на лучевой диагностике с выявлением сакроилиита по данным рентгенографии или магнитно-резонансной томографии (МРТ) (рис. 3), а также иммуногенетического фактора HLA-B27 [5].
Обследование и постановка диагноза
При клиническом обследовании у пациентов с БС можно выявить чрезмерный поясничный лордоз (сглаженность физиологических изгибов позвоночника, так называемая доскообразная спина), характерные для спондилоартрита сгорбленность, предполагающую врожденные аномалии или переломы позвоночника в анамнезе, сколиоз, аномалии тазового скелета, асимметричность паравертебральных и ягодичных мышц. Локальная болезненность при пальпации может быть обусловлена спазмом мышц в области поражения позвоночника или крестцово-подвздошных сочленений. При пальпации остистых отростков обращает на себя внимание их подвижность в боковом (перелом) или переднезаднем направлении. Ступенчатое расположение остистых отростков может быть признаком спондилолистеза. Ограничение подвижности в поясничном отделе позвоночника определяется с помощью функциональных позвоночных проб: пробы Шобера, Томайера и др. Для выявления воспалительного поражения илиосакральных сочленений используются пробы Кушелевского и Макарова. Для поражений нервных корешков и седалищного нерва характерны усиление боли после пробы Вальсальвы (при натуживании, кашле или чихании) и при поднятии вытянутой ноги, а также снижение рефлексов и расстройство чувствительности. При ишиасе боли распространяются по ходу седалищного нерва, чаще всего по ягодице и задней стороне бедра и голени. Они могут сопутствовать боли в нижней части спины, а могут появляться изолированно.
Клинический анализ крови назначается больным с подозрением на вторичный характер БС. Повышение скорости оседания эритроцитов, анемия – признаки воспалительного процесса в позвоночнике, онкопатологии, инфекции.
При биохимическом анализе крови определяют уровень кальция, фосфора, щелочной фосфатазы – для исключения остеопороза, онкопатологии, С-реактивного белка, фибриногена, белковых фракций – для установления наличия воспалительного процесса.
Для исключения спондилоартрита проводятся реакция непрямой гемагглютинации с иерсиниозным, сальмонеллезным, псевдотуберкулезным антигенами, полимеразная цепная реакция для выявления хламидий, НLA-B27.
При подозрении на рак предстательной железы исследуется простатспецифический антиген.
При хронических воспалительных БС туберкулиновые пробы проводятся при признаках туберкулезного поражения позвоночника.
HLA-B27-антиген определяется для исключения воспалительных спондилоартритов.
Назначается также общий анализ мочи для выявления воспалительного процесса в мочевыводящих путях.
Согласно современным представлениям, инструментальная диагностика при БС имеет строгие показания.
Рентгенография позвоночника проводится в прямой и боковой проекциях у лиц старше 50 лет (исключение компрессионных переломов и малигнизации) при неэффективности консервативной терапии в течение четырех – шести недель, а также при злоупотреблении алкоголем или проведении иммуносупрессивной терапии и терапии глюкокортикоидами (риск остеомиелита и переломов) (ICSI – 2008) [6].
Показаниями для проведения МРТ и компьютерной томографии (КТ) позвоночника являются (ICSI 2008) [6]:
- выраженный болевой синдром в спине или ноге и неэффективность консервативной терапии в течение шести недель;
- прогрессирующий неврологический дефицит (ослабление рефлексов, появление тазовых нарушений, слабость в ногах);
- клинические и рентгенологические признаки неопластического процесса;
- клинические и рентгенологические признаки инфекционного процесса (дисцит на фоне иммуносупрессии или хронической алкогольной интоксикации);
- травма (перелом с неврологическим дефицитом или компрессионный перелом у пожилых с целью выполнения вертебропластики).
Важное значение при диагностике ранних проявлений спондилоартрита отводится МРТ илиосакральных сочленений в режиме STIR/T1 с контрастированием (рис. 3).
Денситометрия проводится для диагностики остеопороза. При БС она показана больным старше 50 лет с БС хронического характера, женщинам в раннем постменопаузальном периоде и после удаления яичников, лицам, принимающим глюкокортикоиды, тиреоидные препараты, антациды, противосудорожные средства, пациентам с переломами (в анамнезе), всем больным, получающим медикаментозное лечение по поводу остеопороза.
Радиоизотопная остеосцинтиграфия проводится при наличии БС и опухолевых процессов для выявления метастатического поражения костей и позвоночника, исключения болезни Педжета (деформирующий остеит).
Миелография показана при подозрении на сдавление спинного мозга или конского хвоста.
В комплекс обследования по показаниям входят обзорная рентгенограмма легких, ультразвуковое исследование органов брюшной полости и малого таза, ректороманоскопия, фиброгастродуоденоскопия, фиброколоноскопия, КТ брюшной полости. Все больные должны быть осмотрены невропатологом. У женщин обязателен осмотр гинеколога, у мужчин – уролога.
Лечебные мероприятия
Лечение проводится с учетом формы заболевания и варианта его течения.
В остром периоде рекомендуется проводить терапию на дому или при выраженном болевом синдроме в стационаре. При возникновении острых болей сначала следует устранить основную причину, приведшую к БС. Для этого применяют холод на зону поражения в первые один-два дня, затем легкое тепло, в острый период ношение фиксирующего корсета, в последующем – только по необходимости [7–9]. Постельный режим не показан, необходимо сохранять двигательную активность с учетом выраженности болевого синдрома (таблица).
Основной задачей терапии острых и хронических БС является купирование болевого синдрома, в частности нестероидными противовоспалительными препаратами (НПВП).
В реальной клинической практике выбор НПВП основывается на наличии оптимального соотношения эффективности, безопасности и стоимости. Одним из препаратов, обладающих этими свойствами, является нимесулид (Нимесил®) [10–12]. В отличие от большинства НПВП нимесулид селективно ингибирует провоспалительную изоформу циклооксигеназы (ЦОГ) – ЦОГ-2 и не влияет на физиологическую ЦОГ-1. Это первый из синтезированных селективных ингибиторов ЦОГ-2. Одновременное ингибирование ЦОГ-1 и ЦОГ-2, свойственное другим НПВП, значительно сужает спектр их применения из-за возможных побочных реакций со стороны ЖКТ.
Еще одним преимуществом препарата является некислотное происхождение (в молекуле нимесулида карбоксильная группа заменена сульфонанилидом), что обеспечивает защитное воздействие на слизистую оболочку ЖКТ. В частности, при применении нимесулида намного реже развивались желудочно-кишечные побочные эффекты, что прежде всего обусловлено его селективностью с ЦОГ-2 [13].
Благодаря своим биохимическим особенностям нимесулид (Нимесил®) легко попадает в область воспаления (в частности, в пораженные суставы при артрите), накапливаясь там в большей концентрации, чем в плазме крови.
Вследствие высокой биодоступности уже через 30 минут после перорального приема концентрация препарата в крови достигает ~50% пиковой и отмечается отчетливый обезболивающий эффект. Через один – три часа концентрация достигает пика и, соответственно, развивается максимальное анальгетическое действие [14].
Нимесулид также демонстрирует ряд эффектов, не зависимых от класс-специфического влияния на синтез простагландинов и во многом определяющих его терапевтическое своеобразие. В частности, он способен подавлять синтез провоспалительных цитокинов (интерлейкина 6, фактора некроза опухоли α), активность металлопротеиназ, ответственных в том числе за разрушение гликопротеинового комплекса хрящевой ткани при остеоартрозе, блокировать фосфодиэстеразу IV, снижая тем самым активность клеток воспалительной агрессии – макрофагов и нейтрофилов, а также оказывать антигистаминное воздействие [15]. Нимесулид также обладает антибрадикининовыми эффектами.
Мощный и быстрый обезболивающий и противовоспалительный эффекты нимесулида подтверждены в клинических исследованиях. Так, при лечении острой патологии околосуставных мягких тканей – плечелопаточном периартрите, бурситах и тендинитах нимесулид оказался столь же или даже более эффективным, чем традиционные НПВП – диклофенак и напроксен, которые использовались в высоких дозах [16]. Эффективность нимесулида доказана и при острой боли в нижней части спины. В Финляндии было проведено рандомизированное клиническое исследование, в ходе которого 102 больных в течение десяти дней получали нимесулид в дозе 100 мг два раза в день или ибупрофен в дозе 600 мг три раза в день. Как по степени облегчения боли, так и по влиянию на функцию позвоночника нимесулид превосходил препарат контроля. У получавших нимесулид значения индекса Осверсти в среднем снизились на 23 (с 38 до 15) балла, в то время как у принимавших ибупрофен – на 16 (с 35 до 20) баллов (р = 0,02). За период терапии в группе нимесулида побочные эффекты со стороны ЖКТ возникли лишь у 7%, в группе ибупрофена – у 13% [17].
Как было отмечено ранее, класс-специфическим осложнением НПВП является патология ЖКТ. Российские и зарубежные данные, полученные в серии проспективных и когортных наблюдательных исследований, свидетельствуют о благоприятном профиле безопасности нимесулида в отношении ЖКТ [18].
Кроме того, анализ литературы показывает, что гепатотоксичность нимесулида не превышает таковую многих других представителей HПВП [19].
Так, отрицательная динамика лабораторных биохимических показателей, свидетельствующих о повреждении печени, при использовании нимесулида отмечалась с той же частотой, что и при приеме других HПВП. При назначении нимесулида коротким курсом (не более 30 дней) повышение уровней аланинаминотрансферазы и аспартатаминотрансферазы в два раза и более наблюдалось лишь у 0,4% больных, а при длительном многомесячном приеме – не более чем у 1,5% [20].
Особый интерес представляет оценка влияния нимесулида на сердечно-сосудистую систему.
Проанализировано 33 309 эпизодов инфаркта миокарда [21]. Относительный риск инфаркта для нимесулида составил 1,69, что приближалось к соответствующим показателям для мелоксикама, набуметона, этодолака и неселективных HПВП. Эти данные дают основание полагать, что у коморбидных пациентов нимесулид не повышает риск развития сердечно-сосудистых событий по сравнению с другими НПВП.
В проведенных нами исследованиях у больных остеоартритом не отмечено дестабилизации артериального давления по данным суточного мониторирования через 30 дней терапии нимесулидом в дозе 200 мг/сут [22]. Так, на фоне приема нимесулида среднее систолическое артериальное давление снизилось с 143 до 140 мм рт. ст., в то время как при использовании диклофенака оно повысилось с 147 до 156 мм рт. ст. (p < 0,05).
Таким образом, нимесулид (Нимесил®) является эффективным и безопасным препаратом, который с успехом может использоваться для купирования как острой, так и хронической боли в спине.
В отсутствие эффекта от максимальных доз НПВП, а также при наличии побочных эффектов на фоне их применения показан опиоидный анальгетик трамадол. Разовая доза (капли или капсулы) должна составлять 50 мг. В каждом конкретном случае доза трамадола может быть увеличена до 200 мг. Режим применения – два раза в сутки.
В связи с тем что в генезе БС большую роль играет мышечный спазм, патогенетически обоснованным является терапия миорелаксантами. Применение миорелаксантов уменьшает потребность в НПВП. Среди миорелаксантов центрального действия хорошо зарекомендовал себя толперизон (Мидокалм), максимальная доза которого может составить 450 мг/сут в два приема. Возможно использование тизанидина (Сирдалуда) по 4–8 мг два раза в сутки в течение 10–14 дней.
При БС, связанной с развитием остеопоротических переломов позвоночника, эффективны антирезорбтивные препараты.
В случае неэффективности терапии (после исключения инфекции, опухоли, эрозии кости, остеопороза и некоторых других заболеваний) рекомендуется эпидуральное введение глюкокортикоидов и/или анестетиков (10–20 мл 0,5%-ного раствора новокаина и 1,0 мл бетаметазона или триамцинолона).
Для повышения эффективности лечения болевого синдрома можно использовать транквилизаторы с выраженным мышечным релаксирующим эффектом, а именно диазепам в дозе 10–30 мг/сут в течение 14 дней с постепенным снижением дозы.
При рецидивирующих или хронических БС показано назначение антидепрессантов амитриптилина, миансерина, флуоксетина на срок не менее шести недель.
Важным компонентом является локальная терапия БС. В частности, используются мазевые, кремовые и гелевые формы НПВП, хорошо проникающие в подкожно-жировую клетчатку, мышцы, связки, обладающие анальгетическим, противовоспалительным и противоотечным эффектами. В остром периоде БС при спондилоартрозе эффективны Финалгон, обладающий раздражающим и сосудорасширяющим свойствами, Финалгель и др., для длительного применения – Фастум гель, Диклофенак гель и др.
У пациентов с БС, связанными со спондилоартритом, перспективными остаются медленно действующие симптом-модифицирующие препараты. В многочисленных исследованиях доказана высокая симптом-модифицирующая активность препаратов, содержащих хондроитин и глюкозамин сульфат.
После купирования острой боли применяют программы реабилитации: мануальную терапию, точечный массаж, иглорефлексотерапию, физиотерапию, грязелечение, сухое и подводное вытяжения, лечебную физкультуру. Противопоказаниями для проведения мануальной терапии и вытяжений являются выраженные спондилез и остеопороз, нестабильность позвонково-двигательного сегмента со спондилолистезом.
При неэффективности медикаментозной терапии БС решается вопрос о хирургическом лечении. Наиболее частыми показаниями для хирургического вмешательства являются грыжи диска и стеноз позвоночного канала.
В лечении аксиального спондилита применяются кинезиотерапия, реабилитационные и обучающие программы, НПВП на постоянной основе, локальное введение глюкокортикоидов.
При энтезитах показано применение сульфасалазина в дозе 2–3 г/сут при периферическом варианте, а в качестве симптом-модифицирующей терапии – биологические агенты (антитела к фактору некроза опухоли α, блокаторы интерлейкинов 17 и 23), таргетные препараты [23, 24].
Таким образом, боли в спине встречаются при многих заболеваниях опорно-двигательного аппарата. Современные подходы к дифференциальной диагностике БС с постановкой нозологического диагноза и назначение патогенетической терапии способствуют сокращению частоты случаев хронического течения болезни, а также улучшению качества жизни пациентов.
Нимесулид эффективно купирует как острую, так и хроническую боль, в том числе БС.
Частота развития НПВП-гастропатии на фоне приема препарата значительно меньше, чем при использовании традиционных HПВП.
Важным является и то, что длительное применение нимесулида не приводит к существенному возрастанию гепатотоксических реакций. По частоте встречаемости различий по суммарным показателям, характерным для класса HПВП в целом, не зафиксировано.
Терапия нимесулидом не ассоциируется с повышением риска дестабилизации течения артериальной гипертензии, характерного для других НПВП.
I.B. Belyayeva, MD, PhD, Prof.
North-Western State Medical University named after I.I. Mechnikov
Contact person: Irina B. Belyayeva, belib@mail.ru
Acute and chronic back pain – the most common complaints at outpatient appointments. Such pains are not the separate nosological unit, but the clinical manifestation of a number of diseases and require careful differential diagnosis. The establishment of the nosological diagnosis and the appointment of pathogenetic therapy reduce the risk of chronization of the process. The main objective of therapy is the relief of pain syndrome, focused on the use of nonsteroidal anti-inflammatory drugs with the most effective “risk – benefit” ratio, of which nimesulide deserves special attention.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.