Место адалимумаба в современной стратегии фармакотерапии ревматоидного артрита. Национальный саммит по ревматологии.
- Аннотация
- Статья
- Ссылки











Открывая сессию, директор Научно-исследовательского института ревматологии им. В.А. Насоновой (НИИР им. В.А. Насоновой), академик Российской академии наук, д.м.н., профессор Евгений Львович НАСОНОВ отметил, что сформулированная Европейской антиревматической лигой (European League Against Rheumatism – EULAR) концепция «Лечение до достижения цели» (treat to target – T2T)1 является современной парадигмой фармакотерапии ревматоидного артрита (РА). Ее реализация позволяет увеличить продолжительность жизни пациентов.
В основе фармакотерапии лежит применение инновационных лекарственных средств, в частности генно-инженерных биологических препаратов (ГИБП): ингибиторов фактора некроза опухоли альфа (ФНО-альфа), рецепторов интерлейкина (ИЛ) 6, анти-В-клеточных препаратов и блокаторов Т-лимфоцитов.
Концепция «Лечение до достижения цели» легла в основу новых клинических рекомендаций Ассоциации ревматологов России (АРР) по лечению ревматоидного артрита (2014)2. «Отечественные рекомендации не повторяют рекомендации Европейской антиревматической лиги. Они в определенной степени развивают лучшие традиции европейской ревматологии», – пояснил академик Е.Л. Насонов. Затем он кратко прокомментировал некоторые их положения.
Согласно рекомендациям АРР лечение РА основывается на применении базисных противовоспалительных препаратов (БПВП) и ГИБП.
Основная цель фармакотерапии РА заключается в достижении ремиссии (или низкой активности заболевания). Для ее реализации терапия БПВП должна назначаться как можно раньше (в так называемое окно возможности), а эффективность терапии – тщательно контролироваться и модифицироваться в зависимости от активности заболевания. Раннее назначение метотрексата, в том числе в форме для подкожного введения, должно стать обязательным компонентом лечения на всех стадиях РА. Все ГИБП предпочтительнее применять в комбинации с метотрексатом (или другими БПВП). По мнению Е.Л. Насонова, препаратами первого выбора среди ГИБП являются ингибиторы ФНО-альфа, так как подавляющее большинство исследований подтверждает их эффективность и безопасность.
Рекомендации EULAR-2013: новый взгляд на старые проблемы
В начале выступления профессор медицины, почетный член EULAR, Общества ревматологов Венгрии, Чехии, Нидерландов, член Королевской академии наук, автор более 900 рецензируемых научных работ Фердинанд БРЕДВИЛД (Нидерланды) перечислил основные принципы ведения пациентов с РА, обозначенные в рекомендациях EULAR-20133:
план лечебных мероприятий врач должен обсуждать с пациентом;
ведущая роль в ведении больных принадлежит врачу-ревматологу;
при назначении терапии необходимо учитывать ее стоимость.
Согласно рекомендациям EULAR-2013 терапия должна быть направлена на достижение ремиссии или низкой активности заболевания.
Достижение ремиссии наиболее коррелирует с повышением функционального статуса и уменьшением структурных повреждений в суставах. У ряда пациентов достаточным считается достижение низкой активности заболевания, что ассоциируется с менее тяжелыми функциональными исходами РА. Если через три месяца не достигается улучшение или через шесть месяцев – цель терапии, лечение должно быть изменено.
В последние годы для оценки активности заболевания наряду с композитным индексом DAS28 применяются упрощенный (SDAI) и клинический (CDAI) индексы. При этом индекс CDAI считается более жестким показателем активности РА. Так, согласно датскому регистру DANBIO на фоне терапии такими ГИБП, как адалимумаб, этанерцепт, инфликсимаб, в реальной клинической практике ремиссии по DAS28 (< 2,6 балла) достигали 39% больных РА, принимавших адалимумаб, а по CDAI – 26%4.
У пациентов, получавших этанерцепт и инфликсимаб, эти показатели оказались ниже (33 и 18%, 27 и 16% соответственно).
Было также показано, что прием комбинации адалимумаба (в дозе 40 мг) и метотрексата способствовал поддержанию ремиссии в течение 10 лет у больных с длительно текущим РА. При этом долгосрочные показатели эффективности лечения были схожими в разных группах начальной терапии5.
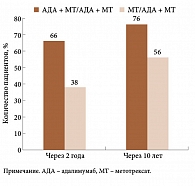
Эффективность комбинации адалимумаба и метотрексата в лечении РА на ранней стадии и достижении длительной ремиссии была подтверждена и в исследовании PREMIER (рис. 1)6.
Так, ремиссия заболевания в течение 10 лет отмечена у 76% получавших комбинированную терапию и 56% получавших первые два года метотрексат, а затем переведенных на комбинированную терапию.
В рекомендациях EULAR-2013 определено, что после постановки диагноза РА (используются новые классификационные критерии Американской коллегии ревматологов (American College of Rheumatology – ACR)) терапия должна начинаться как можно раньше. При этом метотрексат следует рассматривать как препарат первой линии для лечения активного РА.
Альтернативой монотерапии метотрексатом может быть назначение метотрексата с другими синтетическими БПВП. При наличии противопоказаний к приему метотрексата возможно применение лефлуномида или сульфасалазина. В первые шесть месяцев терапии в качестве одного из ее компонентов можно рассмотреть прием глюкокортикостероидов (ГКС). Они принимаются коротким курсом и в низких дозах (< 10 мг/сут)3.
Если цель лечения не достигнута, при отсутствии факторов неблагоприятного прогноза следует использовать другую стратегию лечения стандартными БПВП, а при их наличии рассмотреть возможность назначения ГИБП.
Факторами неблагоприятного прогноза считаются высокая активность заболевания, раннее развитие эрозий в суставах. В качестве ГИБП можно использовать ингибиторы ФНО-альфа (адалимумаб, этанерцепт, инфликсимаб и др.) или абатацепт, тоцилизумаб, а при особых показаниях – ритуксимаб. Парентеральные препараты золота в рекомендациях EULAR-2013 не рассматриваются.
Лечение ГИБП следует инициировать, если не удалось достичь ремиссии через шесть месяцев терапии стандартными БПВП3.
При недостаточной эффективности одного ГИБП следует назначить другой препарат этой группы. Например, в случае неэффективности первого ингибитора ФНО-альфа можно назначить другой ингибитор ФНО-альфа или ГИБП с другим механизмом действия. При неэффективности ГИБП необходимо рассмотреть возможность назначения тофацитиниба3.
Оптимальные сроки назначения ГИБП при раннем РА
Основная цель современных рекомендаций – добиться лечебного эффекта как можно быстрее, своевременно реагируя на потребности больного. В рекомендациях EULAR-2013 определено, что если через три месяца не наблюдается улучшение или через шесть месяцев цель лечения не достигнута (ремиссия/низкая активность), то терапию следует модифицировать. По мнению заместителя директора НИИР им. В.А. Насоновой, д.м.н., профессора Дмитрия Евгеньевича КАРАТЕЕВА, сроки принятия решения об использовании, например, комбинированной терапии с биологическими препаратами несколько удлиняются, что в случае ранней стадии РА может быть критично из-за прогрессирования структурных изменений в суставах. Именно поэтому в АРР указан более короткий период перехода на комбинированную терапию с ГИБП – три месяца и более в случае недостаточной эффективности метотрексата и комбинированной терапии метотрексата и синтетических БПВП2.
Результаты ретроспективных исследований по оценке эффективности биологической терапии при раннем РА и длительно текущем РА показали, что назначение ГИБП приводит к лучшим результатам в снижении активности заболевания, повышении функционального статуса пациента. Это подтверждают и данные проведенного субанализа по итогам исследования COMET, посвященного оценке эффективности монотерапии метотрексатом и комбинации метотрексата с этанерцептом7.
Сравнительный анализ результатов более ранних исследований по оценке эффективности комбинации метотрексата с ГИБП (ASPIRE, PREMIER, COMET), в которых принимали участие пациенты с длительностью РА от одного года до двух лет, и более поздних исследований (AGREE, IMAGE), в которых принимали участие пациенты с длительностью заболевания три – шесть месяцев, продемонстрировал, что клиническая ремиссия в первых исследованиях составила 30–40%, в последних – порядка 70%8. Таким образом, при очень раннем РА эффективность лечения повышалась в 1,5 раза.
Аналогичная тенденция отмечена и при анализе результатов отечественного исследования РЕМАРКА, проведенного в НИИР им. В.А. Насоновой. Цель исследования – определить эффективность и безопасность комбинированной терапии метотрексатом (подкожное введение) и ГИБП при реализации концепции «Лечение до достижения цели» у больных с активным ранним РА и РА в развернутой стадии, имеющих факторы неблагоприятного прогноза. Согласно протоколу РЕМАРКА всем участникам была назначена терапия метотрексатом в дозе 10 мг/нед с быстрой эскалацией дозы до 20–30 мг/нед. Через 12 недель оценивалась эффективность терапии. В случае достижения ремиссии (SDAI < 3,3 балла) или хорошего терапевтического ответа больные продолжали получать метотрексат. Если на монотерапии препаратом не удавалось достичь ремиссии/низкой активности заболевания или хорошего терапевтического ответа, пациентов переводили на комбинацию «метотрексат + ГИБП».
В отсутствие активной ГКС-терапии назначение биологических препаратов потребовалось 81 (62,3%) больному, 50 из них применяли адалимумаб, 21 – абатацепт, 8 – цертолизумаба пэгол и 2 – тоцилизумаб. Решение в связи с недостаточным контролем заболевания принималось в течение первых двух месяцев в отношении 25% пациентов, в течение первых трех месяцев – в отношении 33%, от трех до шести месяцев – в отношении 22% и свыше шести месяцев от начала терапии метотрексатом – в отношении 18% пациентов.
Оценка динамики активности заболевания по SDAI к концу шестого и 12-го месяца наблюдения показала, что при переходе на комбинацию с биологическими препаратами в первые три месяца от начала лечения метотрексатом результаты были лучше, чем при более позднем переходе на указанную терапию. Так, в группе раннего перехода на комбинированную терапию клинической ремиссии достигли 55% пациентов (против 29% пациентов из группы более позднего перехода).
«Таким образом, назначение биологических препаратов при раннем РА связано с более благоприятными результатами, чем при длительно текущем РА. У большинства больных решение о применении комбинированной терапии целесообразно принимать в течение трех месяцев от начала назначения метотрексата», – констатировал профессор Д.Е. Каратеев.
Возможности достижения цели при отсрочке назначения ГИБП на два года при раннем РА
Профессор кафедры ревматологии профессионального образования Первого Московского государственного медицинского университета им. И.М. Сеченова, д.м.н. Наталья Владимировна ЧИЧАСОВА отметила, что эффективность стратегии интенсивной терапии раннего РА для достижения цели подтверждена результатами двухлетнего многоцентрового рандомизированного двойного слепого исследования PREMIER9. В нем приняли участие больные активным РА с длительностью заболевания менее трех лет. Пациенты были рандомизированы на следующие группы: получавших монотерапию метотрексатом (n = 257), адалимумабом (n = 274) и комбинированную терапию адалимумабом и метотрексатом (n = 268).
Число достигших ответа по всем критериям ACR (20/50/70) через два года лечения было достоверно больше (р < 0,001) среди получавших комбинацию адалимумаба и метотрексата, чем среди получавших монотерапию. При оценке отдельных параметров активности РА (количество припухших суставов, болезненных суставов, оценка утренней скованности) и качества жизни по HAQ (Health Assessment Questionnaire) также показан достоверно лучший результат на фоне комбинированной терапии, чем монотерапии (рис. 2).
«Комбинация адалимумаба с метотрексатом в течение всего слепого периода исследования демонстрировала совершенно определенные и достоверные преимущества: примерно у половины больных наблюдалось стойкое подавление активности заболевания (по сравнению с монотерапией метотрексатом или адалимумабом). Таким образом, каждый второй пациент достигал ремиссии в течение двойного слепого периода на комбинированной терапии», – уточнила профессор Н.В. Чичасова.
У пациентов, получавших комбинированную терапию адалимумабом с метотрексатом, изменение общего счета повреждений по модифицированному методу Шарпа (mTSS – total Sharp score) было достоверно меньше через шесть месяцев, год, полтора и два года по сравнению с пациентами, получавшими монотерапию. Следует отметить, что монотерапия адалимумабом и комбинированная терапия с метотрексатом способствовала достоверно более медленному прогрессированию заболевания, чем на фоне монотерапии метотрексатом (рис. 3).
Среднее изменение mTSS при проведении комплексной терапии адалимумабом и метотрексатом через два года составило 1,9 (против 5,5 на монотерапии адалимумабом и 10,4 на монотерапии метотрексатом).
Через восемь лет терапии, после перевода всех пациентов на комбинацию «адалимумаб + метотрексат» (открытая фаза), среднее изменение mTSS было все же достоверно (р < 0,001) ниже в группе получавших комбинированную терапию с начала исследования (рис. 4).
Исходя из динамики рентгенологических показателей, через восемь лет терапии у пациентов, изначально принимавших комбинированную терапию, значение mTSS было меньше в 2,5 раза, сужение суставной щели – в два раза, число эрозий – в пять раз по сравнению с пациентами, начавшими лечение с монотерапии метотрексатом. Как результат, в два раза больше больных, стартовавших с комбинации «адалимумаб + метотрексат», достигли полного контроля над заболеванием10.
Последние данные свидетельствуют, что у больных, в дебюте получавших комбинированную терапию адалимумабом с метотрексатом, и через 10 лет лечения регистрируется лучший исход РА. Даже через 10 лет доля больных без рентгенологического прогрессирования среди них была меньше2.
«Следовательно, при отсрочке назначения адалимумаба на два года при раннем РА не удается достичь таких результатов, как при раннем назначении ГИБП», – подчеркнула в заключение профессор Н.В. Чичасова.
Возможности достижения цели при отсрочке назначения ГИБП на один год при длительно текущем РА – DE019 и личный опыт
В продолжение темы о наиболее оптимальных сроках назначения биологической терапии заведующий кафедрой терапии и ревматологии им. Э.Э. Эйхвальда Северо-Западного государственного медицинского университета им. И.И. Мечникова (СЗГМУ им. И.И. Мечникова), академик РАН, д.м.н., профессор Вадим Иванович МАЗУРОВ в своем выступлении постарался ответить на вопрос: насколько успешно будет достигнута цель лечения больных развернутым или длительно текущим РА при отсрочке назначения ГИБП на год? В первую очередь докладчик проанализировал результаты долгосрочного исследования DE01911.
DE019 – мультицентровое двойное слепое плацебоконтролируемое исследование продолжительностью 52 недели с последующим открытым периодом первоначальной терапии. Оно проводилось в 89 клиниках США и Канады. В исследование были включены 619 больных активным РА с недостаточным эффектом терапии метотрексатом. Средний возраст участников – 57 лет, длительность заболевания – 10,9 года, число предшествующих БПВП – 2,4, исходный индекс Шарпа – 68,3 балла.
Пациенты были разделены на три группы: первая (n = 207) получала адалимумаб в дозе 40 мг подкожно один раз в две недели в сочетании с метотрексатом, вторая (n = 212) – адалимумаб в дозе 20 мг подкожно один раз в неделю и метотрексат, третья (n = 200) – плацебо с метотрексатом. В открытую фазу вошли 304 пациента.
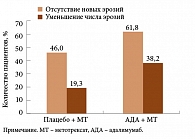
Данные, полученные в двойном слепом периоде, подтвердили целесообразность раннего назначения интенсивной терапии у больных длительно текущим РА с использованием комбинации «адалимумаб + метотрексат». Отсутствие рентгенологических признаков прогрессирования заболевания отмечалось у 61,8% пациентов на фоне терапии адалимумабом с метотрексатом и у 46% пациентов, принимавших плацебо и метотрексат. При этом у трети пациентов на фоне комбинированной терапии адалимумабом в сочетании с метотрексатом наблюдалось улучшение рентгенологической картины (рис. 5).
Подобная тенденция отмечалась и через пять лет лечения в открытом продленном периоде исследования. Так, у 58% пациентов, исходно принимавших комбинацию «адалимумаб + метотрексат», отсутствовало рентгенологическое прогрессирование РА12. В целом комбинированная терапия способствовала снижению прогрессирования и проявлений РА.
Современная стратегия предусматривает лечение РА до достижения цели. Это значит, что необходимо добиться стойкой ремиссии заболевания. По данным продленной фазы исследования DE019, примерно 60% больных с длительно текущим РА, получавших комбинацию адалимумаба и метотрексата в течение первого года (двойной слепой период), поддерживали контроль над заболеванием в течение 10 лет13.
По словам профессора В.И. Мазурова, накопленный к настоящему времени обширный исследовательский материал с участием когорты больных РА, включенных в регистр Центра терапии ГИБП Санкт-Петербурга, также свидетельствует об эффективности биологической терапии в достижении клинической ремиссии при адекватном и своевременном ее назначении. В качестве примера докладчик привел данные собственного исследования эффективности комбинированной терапии адалимумабом и метотрексатом у пациентов с ранним, развернутым и поздним РА. Длительность лечения – 52 недели.
В трех группах к концу исследования продемонстрированы хорошие клинические, рентгенологические и функциональные показатели, однако цели лечения (ремиссии/низкой активности заболевания) по DAS28 на фоне комбинированной терапии достигли только пациенты с ранним и развернутым РА. Пациенты с поздним РА достигли умеренной активности заболевания (рис. 6).
«Наши данные продемонстрировали совершенно очевидные вещи: длительность заболевания играет одну из важнейших ролей в степени ответа на проводимую терапию», – пояснил докладчик.
В заключение В.И. Мазуров отметил, что в настоящее время своевременное назначение ГИБП, в частности адалимумаба, предоставляет вполне реальные возможности для достижения ремиссии или низкой активности заболевания у пациентов как с ранним, так и с длительно текущим РА.
Данные исследования РEМАРКА
Свое второе выступление профессор Д.Е. Каратеев посвятил детальному анализу предварительных данных еще продолжающегося исследования РЕМАРКА. Дизайн исследования РЕМАРКА представляет собой адаптацию концепции T2T для лечения больных ранним РА и РА в развернутой стадии, имеющих факторы неблагоприятного прогноза, путем подкожного введения метотрексата и применения ГИБП.
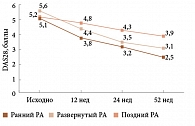
В предварительный анализ включены 130 пациентов: с ранним РА (n = 70) и медленно текущим РА (n = 60). У всех больных отмечалась высокая активность заболевания по индексам DAS28 (СРБ) (СРБ – С-реактивный белок), SDAI, CDAI. Различия между группами по количеству пациентов с эрозивным артритом и рентгенологической стадии заболевания были достоверными (р = 0,005).
Всем больным подкожно назначался метотрексат в дозе 10 мг в неделю с быстрой эскалацией дозы до 25–30 мг в неделю. У 3/4 больных оптимальная доза составила 20–25 мг, только у 9 (6,9%) больных метотрексат был отменен. Монотерапия метотрексатом позволила достичь цели лечения (ремиссия/низкая активность РА) у 37,7% пациентов.
Особенностью исследования стало ограничение по применению ГКС. Лишь 27 (17,7%) пациентов продолжали получать назначенный до включения в исследование метилпреднизолон в дозе 4–6 мг/сут.
При таком режиме лечения более 60% пациентов для достижения цели нуждались в биологической терапии. В дополнение к метотрексату им были назначены ГИБП.
Через 12 месяцев наблюдения 37,7% пациентов получали монотерапию метотрексатом, 38,4% – комбинированную терапию адалимумабом и метотрексатом, 16,2% – комбинацию «метотрексат + абатацепт», 6,2% – комбинацию «метотрексат + цертолизумаба пэгол», 1,5% – «метотрексат + тоцилизумаб».
Согласно полученным данным, цель лечения к 12 месяцам по индексам DAS28, SDAI, CDAI была достигнута у 75% пациентов, в том числе ремиссия – у 41,3% больных по DAS28 и 37,7% по SDAI.
У больных ранним РА потребность в ГИБП была достоверно ниже. Их добавление требовалось только 52,2% пациентов (против 78,6% пациентов с развернутым РА).
Следует отметить, что различия по дозам метотрексата в группах раннего РА и развернутого РА отсутствовали, а наличие низких доз ГКС не влияло на частоту назначения ГИБП. Переключение на другие ГИБП потребовалось трем больным ранним РА и девяти с развернутым РА.
Динамика активности РА у пациентов на монотерапии метотрексатом была лучше, чем у больных на комбинации метотрексата и ГИБП (рис. 7). Это связано с селекцией пациентов, хорошо отвечающих на метотрексат, что соответствует стратегии Т2Т и имеет немаловажное медицинское и экономическое значение.
Ремиссии или низкой активности заболевания по SDAI через 12 месяцев достигли 83,7% пациентов на монотерапии и 65,5% пациентов на комбинированной терапии. Как отметил профессор Д.Е. Каратеев, это была группа больных, исходно хорошо ответивших на терапию метотрексатом, а пациенты, которым потребовалось добавление ГИБП, были изначально более резистентными. Таким образом, в случае изначально хорошего ответа на лечение монотерапия метотрексатом (подкожное введение) может быть эффективнее его комбинации с ГИБП.
Аналогичные данные получены и в отношении нормализации функции суставов (HAQ < 0,5 балла), которую по окончании 12 месяцев на монотерапии достигли 69,4% больных, а на комбинированной – 51,9%.
Оценка динамики индекса SDAI в зависимости от выбора первого ГИБП показала большую эффективность ингибитора ФНО-альфа (адалимумаба), которая была достоверно более выраженной (р < 0,05), особенно в первые шесть месяцев наблюдения.
Завершая выступление, профессор Д.Е. Каратеев акцентировал внимание участников сессии на предварительных результатах исследования РЕМАРКА: больные ранним РА имеют больше шансов достичь ремиссии, а пациенты, нуждающиеся в назначении ГИБП, могут иметь более тяжелый и прогноcтически неблагоприятный субтип РА, резистентный к проводимой терапии.
Оптимальная доза метотрексата в сочетании с адалимумабом – 10 и 20 мг
Профессор Н.В. Чичасова во втором выступлении остановилась на возможности повышения эффективности комбинированной терапии метотрексатом и адалимумабом путем оптимизации дозы первого. Она представила результаты исследования CONCERTO14.
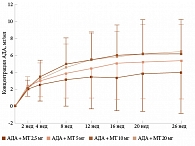
Исследование CONCERTO – это 26-недельное двойное слепое исследование фазы III в параллельных группах. Оно включало метотрексат-наивных больных. Длительность заболевания – менее года. Все пациенты были рандомизированы на четыре группы для терапии адалимумабом в дозе 40 мг один раз в две недели (открытый режим) в комбинации с метотрексатом в дозах от 2,5 до 20 мг один раз в неделю перорально (слепой режим).
В первой группе участники получали метотрексат в дозе 2,5 мг, во второй – в дозе 5 мг, в третьей – в дозе 10 мг, в четвертой – в дозе 20 мг. В последней группе доза препарата наращивалась постепенно – с 12,5 до 20 мг к восьмой неделе терапии.
Поскольку участники – пациенты с ранним РА, для включения в исследование помимо параметров активности заболевания изучались параметры, которые позволяли подтвердить диагноз, а именно: наличие одной и более эрозии в костях мелких суставов, положительного ответа на ревматоидный фактор (РФ) и антитела к циклическому цитруллинированному пептиду.
Согласно данным исследования, на 26-й неделе достоверно больше пациентов достигли низкой активности заболевания/ремиссии по индексам DAS28 и CDAI на более высоких дозах метотрексата – 10 и 20 мг в неделю. При этом достоверная тенденция к улучшению была зарегистрирована уже на 12-й неделе и сохранялась до конца наблюдения.
Доля пациентов без рентгенологического прогрессирования была одинаково высока во всех четырех группах и достоверно не различалась (изменение TSS от начала исследования до 26-й недели ≤ 0,5 балла), что, по мнению профессора Н.В. Чичасовой, объясняется способностью адалимумаба тормозить прогрессирование структурных повреждений суставов.
Результаты работы свидетельствовали о достоверной связи между увеличением дозы метотрексата и повышением доли пациентов, достигших полного контроля заболевания (рис. 8).
Примерно 32% пациентов в группе метотрексата в дозе 20 мг достигли полного контроля заболевания по показателю низкой активности заболевания и 26,5% пациентов – по показателю клинической ремиссии.
Интересные данные получены при изучении изменения фармакокинетики адалимумаба в разных группах. Показано, что концентрация адалимумаба в равновесном состоянии менялась в зависимости от дозы метотрексата: она увеличивалась при увеличении дозы метотрексата от 2,5 до 10 мг (рис. 9)15. Однако концентрация адалимумаба в равновесном состоянии не различалась при дозах 10 и 20 мг.
Более высокая иммуногенность отмечалась при более низких дозах метотрексата – количество больных с антителами к адалимумабу было почти в два раза выше в первых двух группах, нежели в двух других.
Параметры активности заболевания оценивались и по сообщениям пациентов, которые не почувствовали разницы в дозах метотрексата. Значительное улучшение по HAQ-DI у пациентов отмечалось от начала исследования до четвертой недели и сохранялось до его окончания. Улучшение функций, как и улучшение по DAS28, которое наступало к восьмой неделе и поддерживалось в течение всего срока исследования, не зависело от дозы метотрексата и, безусловно, было результатом действия адалимумаба.
Не зависела от дозы метотрексата и динамика ментальной (MCS) и физической (PCS) активности по SF-36, как и качество сна по MOS-SS (Medical Outcomes Study Sleep Scale). Улучшение сна отмечалось у всех пациентов с восьмой недели терапии.
Нежелательные явления (НЯ), связанные с приемом метотрексата, отмечались редко. При этом частота некоторых из них (инфекции, тошнота, выпадение волос) была обусловлена увеличением дозы препарата до 10 и 20 мг в неделю. Это позволило предположить, что в комбинации с адалимумабом следует использовать минимально эффективные дозы метотрексата. Серьезные НЯ не наблюдались.
Докладчик отметила, что в исследовании CONCERTO продемонстрирована статистически значимая тенденция к повышению эффективности комбинированной терапии у больных ранним активным РА – пропорционально увеличению дозы метотрексата с 2,5 до 10 и 20 мг. Важно и то, что сывороточная концентрация адалимумаба была выше в группах метотрексата 10 и 20 мг.
Оптимальная доза метотрексата в сочетании с адалимумабом с учетом данных УЗИ. Исследование MUSICA
Свой следующий доклад профессор Д.Е. Каратеев начал с краткого систематического обзора литературы за 2009 г., в котором указывается, что оптимальный подход к применению метотрексата при РА, основанный на доказательной медицине, предусматривает начало терапии с перорального приема препарата в дозе 15 мг в неделю с постепенным увеличением дозы на 5 мг в месяц до 25–30 мг в неделю или до максимально переносимой дозы, а при недостаточной эффективности данной схемы – переход на подкожное введение16.
Возможность повышения эффективности лечения РА с использованием низких или более высоких доз метотрексата в комбинации с ГИБП докладчик рассмотрел на основе результатов исследования MUSICA17.
MUSICA – двойное слепое рандомизированное исследование в параллельных группах, в ходе которого оценивалось влияние дозы метотрексата на исходы и ультразвуковую динамику заболевания у пациентов с тяжелым и среднетяжелым РА с предшествующей неэффективностью БПВП. В исследование были включены 309 пациентов, не ответивших на терапию метотрексатом. Участников разделили на две группы. Все пациенты получали адалимумаб в дозе 40 мг один раз в две недели. Пациенты первой группы (n = 154) в комбинации с адалимумабом применяли метотрексат в дозе 20 мг/нед, пациенты второй группы (n = 155) – метотрексат в дозе 7,5 мг/нед.
Достоверная разница в группах была получена только по таким показателям, как количество припухших суставов (9,6 ± 12,8 против 7,7 ± 10,5, р = 0,028), оценка активности заболевания врачом (23,7 ± 21,3 против 19 ± 17,4 балла, р = 0,035). Достоверной разницы в отношении критериев ACR 20/50/70, HAQ, числа болезненных суставов, оценки боли пациентом, синовиальной гипертрофии и васкуляризации, эрозий кости не наблюдалось. Динамика HAQ-DI была аналогичной в обеих группах и сохранялась до 24-й недели.
Таким образом, разница в клинических и ультразвуковых показателях эффективности лечения между более низкими и более высокими дозами метотрексата в комбинации с адалимумабом оказалась незначительной.
НЯ, связанные с приемом метотрексата, отмечались редко. При этом частота некоторых НЯ нарастала по мере увеличения дозы метотрексата, поэтому авторы исследования сделали вывод: в комбинации с адалимумабом следует использовать минимальные дозы метотрексата.
«Однако я не могу полностью согласиться с этим утверждением, поскольку предварительные результаты исследования РЕМАРКА по применению разных доз метотрексата, вводимых подкожно, с биологическими препаратами показывают эффективность и хороший профиль безопасности комбинированной терапии с высокими дозами первого», – пояснил докладчик. Согласно данным исследования РЕМАРКА, к 12-му месяцу наблюдения больные РА, получавшие комбинированную терапию метотрексатом в дозе 25–30 мг/нед и ГИБП, достоверно чаще достигали цели лечения (ремиссии/низкой активности заболевания) по DAS28 и SDAI, чем пациенты, принимавшие ГИБП в комбинации с метотрексатом в дозе 10–15 мг/нед. Серьезные НЯ, связанные с применением метотрексата, не выявлены.
В заключение Д.Е. Каратеев сформулировал следующие выводы:
при пероральном приеме метотрексата в комбинации с ГИБП доза первого незначительно влияет на результаты терапии;
- при подкожном введении метотрексата
в комбинации с ГИБП доза препарата более 20 мг/нед связана с достоверно более выраженным
снижением активности тяжелого РА.
Безопасность ГИБП: значение рекомендаций EULAR-2013
Вначале своего следующего доклада Ф. Бредвилд отметил: «Безопасность терапии остается ключевым фактором в лечении больных биологическими препаратами. Безопасность применения ингибиторов ФНО-альфа подтверждена в многочисленных исследованиях».
Так, в исследовании с участием 268 пациентов с ревматоидными заболеваниями анализ причин отмены ингибиторов ФНО-альфа показал, что частота прекращения лечения из-за появления НЯ значимо не различается у препаратов этой группы18. Наиболее частыми НЯ являются инфузионные реакции, инфекции, печеночная, почечная или гематологическая дисфункции, сердечно-сосудистые, неврологические и психотические нарушения, злокачественные новообразования.
Факторами риска, ассоциированными с развитием осложнений у получающих ГИБП, являются прием иммуносупрессивных препаратов, ГКС (длительно и в высоких дозах), значимые сопутствующие заболевания, в том числе злокачественные, соединительной ткани, хирургические вмешательства, пожилой возраст, контакт с туберкулезными больными, гепатит С в анамнезе, носительство гепатита19.
При обновлении рекомендаций по ведению больных РА сделан систематический обзор ряда исследований, посвященных оценке риска развития инфекционных заболеваний при лечении ингибиторами ФНО-альфа. Согласно Кохрановскому обзору биологические агенты как группа были ассоциированы со статистически значимой более высокой частотой развития серьезных инфекций и реактивации туберкулеза. Значимо более высокий риск развития серьезных инфекций по сравнению с контрольной группой был отмечен в группах цертолизумаба пэгол и анакинры20.
«Регистры являются полезным инструментом для оценки долговременной безопасности биологических агентов. Они предоставляют ценные данные о безопасности ГИБП, включая частоту развития туберкулеза, прерывания лечения вследствие НЯ, влияние на протекание беременности и появление злокачественных новообразований. Эти данные очень важны для планирования терапевтических мероприятий», – подчеркнул профессор Ф. Бредвилд.
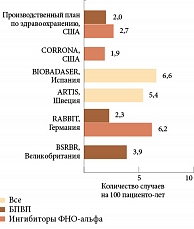
Так, по данным регистра DREAM, при длительном использовании в клинической практике ингибиторов ФНО-альфа частота возникновения серьезных инфекций составила 2,6 на 100 пациенто-лет21. Однако в других регистрах она оказалась более высокой (RABBIT, BSRBR) (рис. 10)22.
У пациентов с РА, получавших ГИБП, более высокий риск развития инфекций в течение года зафиксирован на фоне ритуксимаба, инфликсимаба и этанерцепта. Частота госпитализаций по поводу инфекций составила 17,4, 16,1 и 14,8 случая/100 пациенто-лет (скорректированный риск 1,37 (95% ДИ 1,2–1,55), 1,39 (95% ДИ 1,19–1,61), 1,26 (95% ДИ 1,08–1,48) соответственно)23. Для тоцилизумаба, адалимумаба и абатацепта – 13,8, 13,8 и 12,3 случая/100 пациенто-лет соответственно.
У пациентов с РА, получавших ГИБП, риск развития Herpes zoster достоверно не различался24.
Таким образом, данные регистров демонстрируют разную частоту развития инфекций для разных ГИБП.
Клинические исследования подтверждают, что частота серьезных инфекций при применении ингибиторов ФНО-альфа у больных РА поддерживается на одном уровне независимо от длительности терапии. Такие инфекции поддаются контролю, если своевременно проводить обследование пациента. Особое внимание должно уделяться пациентам с такими факторами риска, как возраст старше 60 лет, одновременный прием ГКС, метотрексата.
В последнее время активно исследуется связь между развитием злокачественных новообразований и терапией ГИБП. Установлено, что РА ассоциирован с повышенным риском возникновения лимфомы и степень риска увеличивается с увеличением активности заболевания25. Сравнение ингибиторов ФНО-альфа с другими противоревматическими видами терапии свидетельствует, что риск развития злокачественных новообразований на их фоне практически одинаков, а снижение активности воспаления способствует уменьшению риска развития лимфомы.
По данным регистра Швеции, по сравнению с РА средний риск развития лимфомы при псориатическом артрите и анкилозирующем спондилите не повышен, несмотря на то что нельзя исключить его увеличение в подгруппе пациентов с псориатическим артритом, получающих лечение метотрексатом и сульфасалазином26. Таким образом, повышенный риск возникновения лимфомы у пациентов с РА прямо не ассоциируется с данным видом лечения.
В настоящее время проведены исследования, доказавшие, что терапия ингибиторами ФНО-альфа также не ассоциирована с увеличением риска развития венозных тромбоэмболий27.
В заключение Ф. Бредвилд отметил, что для обеспечения безопасности терапии ГИБП требуется проведение тщательного скрининга больных до начала лечения для исключения наличия инфекций, онкологических заболеваний, сопутствующих заболеваний. При правильном терапевтическом подходе применение ГИБП у пациентов с ревматическими заболеваниями является эффективным и безопасным.
Иммуногенность ГИБП: влияние на эффективность и безопасность терапии
Профессор В.И. Мазуров во втором своем докладе рассмотрел вопросы иммуногенности биологических препаратов. Несмотря на то что применение ГИБП в сочетании с метотрексатом открыло принципиально новые терапевтические возможности в лечении РА, в этой области остается много нерешенных вопросов. Примерно у 20–30% пациентов после проведенного лечения сохраняется активность заболевания28. У 30% больных, ответивших на терапию ГИБП, при длительном лечении отмечается снижение их эффективности29.
Результаты исследований показали, что образование антител к ингибиторам ФНО-альфа в ряде случаев может существенно влиять на эффективность терапии и повысить риск развития НЯ30.
После терапии ингибиторами ФНО-альфа наблюдается увеличение количества Th17-клеток, которые обусловливают рецидив и повышение активности заболевания. Возможно, этим объясняется тот факт, что у многих пациентов нет полного ответа на терапию ингибиторами ФНО-альфа31.
Иммуногенность – способность антигена вызывать иммунный ответ независимо от его иммунной специфичности или способность вещества вызывать специфический иммунный ответ с развитием иммунитета. Степень иммуногенности зависит не только от свойств молекулы антигена, но и от способа введения в организм, дополнительных воздействий. Высокой иммуногенностью обладают белки и углеводы. Нуклеиновые кислоты, липиды и другие органические вещества зачастую слабо иммуногенны и могут выступать в роли эффективных антигенов только в составе комплексных соединений. С повышением молекулярной массы растет иммуногенность. Известно, что антигеном является биополимер, генетически чужеродный для организма, который распознается иммунной системой и вызывает иммунные реакции, направленные на устранение антигена. Под антигенностью понимают потенциальную способность молекул антигена активировать компоненты иммунной системы и специфически взаимодействовать с факторами иммунитета.
Биологические лекарственные препараты (эритропоэтин, инсулин, ГИБП) – вещества белковой природы с высокой молекулярной массой, вырабатываемые живыми клетками, могут стать субстратом для выработки антител.
Иммуногенность является характерным свойством всех ГИБП. Ненейтрализующие антитела к ГИБП связываются с нефункциональной частью молекулы ГИБП, а нейтрализующие антитела – с Fab-фрагментом и могут снижать ее потенциальную способность связываться с ФНО. Иммунный комплекс представляет собой взаимодействие растворимого антигена и антитела. Антитела к ГИБП, как нейтрализующие, так и ненейтрализующие, могут не влиять или, напротив, влиять на клиренс, эффективность, вызывать реакции гиперчувствительности, а также образование иммунных комплексов. При наличии антител к препарату может увеличиться частота инфузионных реакций.
Формирование антител к ГИБП зависит от иммунной компетентности организма, генетической предрасположенности и целого ряда других факторов.
Генетическая предрасположенность – это группа состояний, которые связаны с наличием гиперчувствительности, формирующейся в ходе жизнедеятельности организма, но генетически детерминированные на уровне генома.
К факторам, влияющим на формирование антител к препарату, относятся композиты, которые входят в состав препаратов, структурные свойства препаратов, Т-клеточные эпитопы, способность антигена связываться с Fab-фрагментом, последовательная вариабельность мышиного компонента, сочетанное использование иммуномодулирующих препаратов, частота, доза и способ введения препарата32.
Иммунный ответ на биологические препараты может повлиять на их эффективность и переносимость, включая развитие инфузионных реакций, гиперчувствительности, отсутствие ответа на лечение.
На сегодняшний день в ряде исследований показано, что наличие антител в невысоком титре не влияет на эффективность проводимой терапии ГИБП.
Однако на эффективность препарата влияет его концентрация в крови. Чем выше уровень генно-инженерного препарата в крови, тем более значим клинический ответ. В открытом исследовании с участием пациентов с РА, получавших терапию этанерцептом, установлена достоверная связь между эффективностью лечения и уровнем содержания препарата в сыворотке крови больных33.
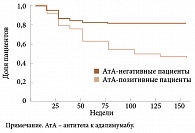
В ряде исследований по оценке эффективности адалимумаба было показано, что не у всех позитивных по антителам пациентов снижается эффективность терапии. 62% из них продолжили лечение. Однако 14% пациентов, у которых не были обнаружены антитела, прекратили терапию из-за ее неэффективности34 (рис. 11). Следовательно, наличие антител не всегда является причиной снижения эффективности терапии ГИБП.
Вместе с тем не вызывает сомнений, что применение ингибиторов ФНО-альфа связано с формированием антител к ним, а концентрация препарата в крови может зависеть от индивидуальных характеристик пациента (веса, возраста, пола).
Некоторые пациенты с антителами к ФНО хорошо отвечают на терапию, поскольку концентрация ГИБП в крови во многом зависит от уровня антител, а не от их наличия или отсутствия. Концентрация ГИБП в крови в большей степени коррелирует с клинической эффективностью, чем уровень антител. У части пациентов причина неэффективности лечения ГИБП не связана ни с наличием антител, ни с концентрацией препарата в крови.
Золотым стандартом лечения РА является метотрексат. Биологическая терапия в сочетании с метотрексатом способствует поддержанию достигнутого эффекта в течение длительного времени. Влияние метотрексата на образование антител носит дозозависимый характер. По данным целого ряда исследований, при высоких дозах препарата (≥ 22,5 мг в неделю) у пациентов с РА, псориатическим артритом отмечается более значимое снижение образования антител, чем при низких дозах (5–10 мг)35.
Метотрексат снижает образование нейтрализующих антител к ГИБП, влияет на их клиренс.
Данные о влиянии на клиническую эффективность биологической терапии перекрестной иммуногенности ГИБП неоднозначны. Антитела к одному ингибитору ФНО-альфа могут влиять или не влиять на риск развития иммуногенности к другим препаратам этой группы. Наличие антител к инфликсимабу, например, не означает появления антител к другому ГИБП – адалимумабу. Поэтому при недостаточной эффективности первого ингибитора ФНО-альфа целесообразно назначение другого ГИБП.
Еще один важный вопрос применения биологической терапии – развитие иммуногенности при длительном приеме ГИБП. Анализ регистров показывает, что через год частота прекращения терапии была одинаковой для этанерцепта, адалимумаба, инфликсимаба, а через три-четыре года несколько выше для инфликсимаба.
Основные причины отмены ГИБП – первичная или вторичная неэффективность, НЯ, финансовые причины и др.
Таким образом, в настоящее время связь между наличием антител к ГИБП и их клинической эффективностью не имеет достаточной доказательной базы и не может быть признана критерием выбора препарата. Решение о выборе ГИБП должно основываться на клинической эффективности и безопасности препарата, установленных в рандомизированных клинических исследованиях и реальной клинической практике.
Результаты внедрения принципов T2T в России
Профессор кафедры терапии и ревматологии СЗГМУ им. И.И. Мечникова, д.м.н., профессор Александр Михайлович ЛИЛА в своем докладе представил результаты внедрения в российскую практику концепции T2T.
В соответствии с существующей концепцией основной целью лечения РА является достижение клинической ремиссии. При длительном течении заболевания альтернативной целью может стать низкая активность заболевания.
Независимой маркетинговой компанией «Астон Консалтинг» при непосредственном участии АРР было проведено исследование результатов внедрения концепции Т2Т в России. Оценивались изменения, произошедшие в практике лечения РА в 21 ведущем центре страны с 2010 по 2013 г.
Анализ эффективности лечения, особенностей фармакотерапии, отношения к информированию взрослых пациентов о прогнозе и вариантах течения РА, его диагностике и современных подходах к лечению заболевания проводили на основании результатов опроса врачей.
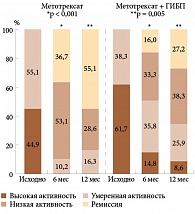
В исследование были включены 568 пациентов в 2010 г. и 507 пациентов в 2013 г. При распределении больных по степеням активности РА умеренная активность заболевания была отмечена в 46% случаев, высокая – в 30–34%.
Прерывание лечения из-за отсутствия препаратов в 2010 г. констатировали 80% опрошенных врачей, в 2013 г. – 87%, из-за НЯ – 80%, из-за нарушения схемы применения препаратов по вине пациента в 2010 г. – 50%, в 2013 г. – 63% врачей.
Частота визитов пациентов и частота назначений визитов врачом практически совпадали, что свидетельствует о высокой приверженности лечению. Отмечено повышение количества повторных рентгенологических исследований пораженных суставов, что связано с коррекцией рекомендаций – в настоящее время для более полного контроля за течением РА такое исследование лучше проводить один раз в шесть, а не в 12 месяцев. В 2010 г. рентгенологические исследования один раз в шесть месяцев врачи назначали в 10% случаев, в 2013 г. – в 17%, один раз в 12 месяцев – в 83 и 70% случаев соответственно. «В этом вопросе необходимо придерживаться стандартов лечения территориальной программы государственных гарантий бесплатного оказания медицинской помощи, учитывая особенности течения заболевания у конкретного пациента», – прокомментировал А.М. Лила.
Была проанализирована частота пальпации суставов и использования индекса DAS28 для оценки состояния. Первый показатель составил 93 и 93% соответственно, второй – 77 и 87%. «Однако в клинической практике эти цифры могут быть в два раза ниже», – пояснил докладчик.
Согласно данным опроса за 2013 г., 100% врачей считают важным обучение пациентов, проведение бесед о механизме развития и прогрессирования РА, современных методах лечения, необходимых обследованиях и др. При этом частота проведения бесед с больными во время визита была высокой – 70% случаев.
Отмечено, что в 2013 г. по сравнению с 2010 г. снизилось число применяемых нестероидных противовоспалительных препаратов (НПВП) – 88 против 94%, а также БПВП – 83 против 93%. В 2013 г. использование системных ГКС сократилось на 15%, но увеличилась доля их локального применения (31 против 27%). Использование в терапии ГИБП увеличилось с 7,6 до 10%.
Для лечения пациентов по-прежнему назначаются БПВП (метотрексат, лефлуномид, сульфасалазин), комбинация метотрексата с другими БПВП. В 2013 г. в два раза повысилось применение комбинаций метотрексата с ГИБП.
Поскольку с 2010 по 2013 г. врачи стали чаще ставить в качестве целей терапии достижение низкого уровня активности заболевания, клинической ремиссии, отсутствие болезненных суставов и поддержание/улучшение уровня повседневной активности, число пациентов, у которых цели терапии были достигнуты, увеличивалось (до 1/3 от всех пациентов). При этом 50% врачей утверждали, что все их больные в 2013 г. смогли получить ГИБП в достаточном объеме.
Профессор А.М. Лила представил также данные о результатах лечения больных РА в клинической ревматологической больнице № 25 Санкт-Петербурга. В 2014 г. 89 пациентам поставлен диагноз РА и назначена терапия БПВП. Через три месяца больным был назначен повторный осмотр, рекомендации выполнили только 17 человек. В то же время на первый осмотр к врачу-ревматологу 10 больных пришли только через шесть месяцев, восемь – через девять, а три – через год. Неэффективность назначенных БПВП отмечалась в 24% случаев, значимое снижение индекса DAS28 – в 75,9%, повышение – в 17,2% случаев.
Анализ, выполненный по результатам регистра Центра антицитокиновой терапии СЗГМУ им. И.И. Мечникова, демонстрирует увеличение в последние годы доли метотрексата в базисной терапии РА. Применение ГИБП при ревматических заболеваниях приводит к снижению их активности. Основными причинами перевода на другой ГИБП являются неэффективность и инфузионные реакции. Более высокая частота случаев неэффективности и НЯ наблюдалась при введении инфликсимаба (пациентов переводили на терапию ритуксимабом), низкая частота случаев неэффективности – при применении адалимумаба, абатацепта, этанерцепта.
Внедрение мониторинга ведения больных РА в Москве: результаты регистра МЕРА
Главный внештатный специалист-ревматолог Департамента здравоохранения г. Москвы, профессор кафедры ревматологии Российской медицинской академии последипломного образования, д.м.н., профессор Евгений Валерьевич ЖИЛЯЕВ стоял у истоков создания Московского единого регистра артритов (МЕРА). С самого начала создатели регистра МЕРА преследовали несколько целей: административные, научные, медицинские. Основными задачами были оценка эффективности и безопасности терапии ГИБП, поиск предикторов эффекта и безопасности, оптимизация использования препаратов, планирование и учет расходов ГИБП, контроль качества медицинской помощи пациентам с ревматическими заболеваниями.
На 30 декабря 2014 г. в регистр было включено 315 пациентов (70% от всех зарегистрированных пациентов, получавших ГИБП по поводу РА). Более одного визита завершено у 131 пациента (41,6% больных, включенных в регистр).
Среди пациентов с РА, получавших ГИБП, половина не использовала метотрексат. Самая распространенная доза препарата – 10 мг (16,7% больных). Метотрексат в дозе 15 мг принимали 14,4% больных, в дозе 20 мг – 8%. Среди пациентов, получавших метотрексат, 60% применяли препарат перорально, 24% – подкожно, 16% – внутримышечно.
Практически 1/3 больных, у которых средний срок использования ГИБП составлял около трех лет, получали ГКС в дозе 10–15 мг в сутки в пересчете на преднизолон.
При анализе эффективности ГИБП отмечено, что цели лечения (низкая активность или ремиссия) не достигаются большинством пациентов на всех препаратах.
Была выделена группа пациентов (n = 131), которые посетили врача более раза, для изучения динамики их состояния за период наблюдения. Критериями включения стали диагноз РА, установленный на основании критериев ACR (1987) и/или ACR/EULAR (2010), подписанное информированное согласие на участие в исследовании.
Между первым и последним визитами в среднем прошло 400 дней.
Среди пациентов 18 на момент включения были биологически наивными, 113 уже получали ГИБП. Девятерым из них биологическая терапия была отменена по разным причинам. Среди используемых ГИБП преобладали Ремикейд® (инфликсимаб) – 34%, Хумира (адалимумаб) – 21%, Энбрел® (этанерцепт), Актемра® (тоцилизумаб) – 12%. Средняя доза метотрексата составила 6,26 ± 7,25 мг, стандартизированная доза НПВП – 340 ± 408 мг. Текущая доза ГКС в пересчете на преднизолон – 1,77 ± 3,25 мг.
В ходе работы была зафиксирована достоверная положительная динамика всех показателей активности заболевания в обеих группах. По всем показателям (субъективным и объективным) зафиксировано значительное улучшение состояния. Количество пациентов, достигших целевого уровня активности, увеличилось с 5,6 до 38,9% среди ГИБП-наивных и с 28,3 до 55,7% среди получавших ГИБП.
Замена ГИБП имела место у 43 пациентов (38,1%), ранее их получавших.
В заключение профессор Е.В. Жиляев отметил, что наращивание эффективности ГИБП в клинической практике возможно путем своевременной смены препарата. В качестве резерва можно рассматривать сохранение и оптимизацию базисной противовоспалительной терапии у больных РА, уже получающих ГИБП.
Заключение
метотрексата и ГИБП позволяет достичь цели терапии (ремиссии/низкой активности
заболевания) у пациентов как с ранним, так и с длительно текущим РА. Весьма
перспективными подходами, позволяющими вызвать индукцию ремиссии при активном
РА, считаются агрессивная монотерапия метотрексатом (подкожное введение) и ранняя
комбинированная терапия адалимумабом и метотрексатом. Согласно результатам
исследований при раннем назначении комбинации адалимумаба с метотрексатом
больные РА в два раза чаще достигают ремиссии или низкой активности
заболевания, чем при раннем назначении монотерапии. Своевременное применение
комбинации «адалимумаб + метотрексат» способствует длительному, не менее 10
лет, контролю заболевания. Адалимумаб (Хумира®) отличается благоприятным
профилем безопасности и может применяться после предшествующей неэффективной
стандартной терапии или других ингибиторов ФНО-альфа. Применение адалимумаба
уменьшает клиническую выраженность заболевания, замедляет структурное поражение
суставов и в конечном итоге способствует достижению ремиссии РА.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.