Небактериальные инфекции в практике врача-дерматолога. Междисциплинарный взгляд на проблему. XV Всероссийский съезд дерматовенерологов и косметологов. Сателлитный симпозиум компании «Вертекс»
- Аннотация
- Статья
- Ссылки



Подходы к лечению онихомикоза у пациентов с коморбидными состояниями
Онихомикоз (ОМ) – грибковое заболевание ногтей. На его долю приходится более 50% всех заболеваний ногтей. Считается, что ОМ страдает от 7,5 до 20% населения. По данным Научно-исследовательского института медицинской микологии им. П.Н. Кашкина, представленным доцентом кафедры дерматовенерологии Северо-Западного государственного медицинского университета им. И.И. Мечникова, к.м.н. Любовью Павловной КОТРЕХОВОЙ, наиболее подвержены риску развития ОМ лица старше 60 лет. Встречаемость ОМ в этой возрастной группе составляет от 25 до 90%. Высокая распространенность ОМ отмечается также у больных с иммунодефицитными состояниями, сахарным диабетом и нарушением кровообращения в дистальных отделах конечностей.
Докладчик представила результаты собственного исследования частоты встречаемости, особенностей этиологии, клиники и характера течения ОМ у 1652 больных. Так, у 40% пациентов были выявлены коморбидные состояния (два и более соматических заболевания). 44% больных ОМ стоп с коморбидными состояниями принимали более двух лекарственных препаратов. Декомпенсация одного из соматических заболеваний наблюдалась у 25% пациентов. «Лечить ОМ необходимо. Однако, назначая еще один лекарственный препарат системного действия, необходимо учитывать значительное увеличение риска развития нежелательных явлений», – уточнила Л.П. Котрехова.
При ОМ изменяются цвет ногтевой пластины (от молочно-белого до черного), толщина и форма, происходит ее деформация. В некоторых случаях может развиться онихолизис. При выраженной патологии поражается матрикс, развиваются дерматофитомы и воспаление околоногтевых валиков. Клиническими разновидностями заболевания у больных с коморбидными состояниями являются поверхностный белый ОМ, дистально-латеральный, проксимальный, эндоникс, проксимальный с паронихией (кандидозный). Тотальный ОМ развивается более чем у 50% больных старше 60 лет и у 19% больных в возрасте 30–40 лет. Тотальная форма ОМ – терминальная стадия всех клинических разновидностей ОМ.
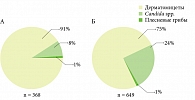
Основными возбудителями ОМ стоп у больных с коморбидными состояниями, так же как и у больных без таковых, являются дерматомицеты (75 и 91% соответственно) (рис. 1).
Среди дерматомицетов (дерматофитов) наиболее часто выявлялись Trichophyton rubrum (464 случая) и Trichophyton interdigitale (17 случаев). Одинаково невысокой в обеих группах была доля плесневых грибов (1%). Однако у пациентов с коморбидными состояниями значительно чаще высевали Candida spp. (24 против 8% соответственно). Можно констатировать, что доля ОМ стоп, вызванного условно-патогенной микобиотой, у пациентов с коморбидными состояниями значительно выше, чем у соматически здоровых пациентов.
К клиническим особенностям течения ОМ у пациентов с коморбидными состояниями относятся:
-
высокий риск развития распространенных форм грибкового поражения кожи и ее придатков;
-
высокий риск развития нескольких нозологических форм микозов кожи и ее придатков, обусловленный разными возбудителями;
-
сочетанное поражение кожи и слизистых оболочек, обусловленное Candida spp.
Применение стандартных схем терапии ОМ у пациентов с коморбидными состояниями часто бывает недостаточно эффективным. Поэтому в таких ситуациях наиболее оправданна, по мнению докладчика, комбинированная терапия системными и топическими антимикотиками.
Из препаратов системного действия (итраконазол, флуконазол, тербинафин) именно азолы обладают наиболее широким спектром противогрибковой активности. Итраконазол, например, эффективен в отношении большинства дерматомицетов – Trichophyton spp., Microsporum spp., Epidermophyton spp. и недерматомицетов Candida spp. (C. albicans, C. parapsilosis, C. tropicalis и др.), Aspergillus spp., Fusarium spp. и др.
Для лучшего всасывания итраконазола необходим нормальный уровень кислотности, поэтому итраконазол в капсулах следует принимать с пищей, а в виде раствора – натощак. Ограничением к применению препарата является хроническая сердечная недостаточность, а также серьезные нарушения функций печени и почек.
Итраконазол взаимодействует с некоторыми лекарственными препаратами, и это надо учитывать при назначении его пациентам с коморбидными состояниями. Недопустим прием азолов с терфенадином, астемизолом, хинидином, пимозидом. Следует также помнить, что совместный прием тербинафина с ингибиторами микросомальных ферментов печени (рифампицин, циметидин, эритромицин) потенциально опасен из-за высокого риска развития нежелательных явлений.
Итраконазол может применяться в виде пульс-терапии, что является его преимуществом при выборе схемы лечения.
При ОМ кистей рук итраконазол назначают в дозе 200 мг два раза в сутки в течение семи дней и проводят два сеанса пульс-терапии – на первой и пятой неделе. При ОМ стоп итраконазол назначают по 200 мг два раза в сутки в течение семи дней и проводят три сеанса пульс-терапии – на первой, пятой и девятой неделе.
Эффективность лечения во многом зависит от приверженности ему пациентов, которая в немалой степени связана с их финансовыми возможностями.
Снизить стоимость лечения ОМ можно с помощью эффективных и безопасных дженериков. Именно таким дженериком является препарат Итразол (итраконазол 100 мг), эффективность и хорошая переносимость которого были подтверждены в клинических исследованиях.
Разнообразие форм выпуска (6, 14 и 42 капсулы в упаковке), эффективность, а также доступная цена способствуют хорошей комплаентности терапии.
Усилить эффект терапии системными антимикотиками помогают топические антифунгальные препараты, в частности аморолфин. Аморолфин за счет фунгицидной активности и эффекта сублимации удовлетворяет современным требованиям, предъявляемым к антифунгальным препаратам для местного применения. Результаты проведенного в микологической клинике проспективного рандомизированного сравнительного исследования эффективности комбинированной терапии системным антимикотиком и аморолфином у пациентов с плохими прогностическими признаками (2010–2012 гг.) показали, что такая комбинация повышает эффективность лечения на 20–30%.
Далее Л.П. Котрехова привела пример из собственной клинической практики. Пациент М. 60 лет. Более десяти лет страдал ОМ стоп, обусловленным T. rubrum. Кроме того, пациент страдает гормонозависимой бронхиальной астмой, сахарным диабетом типа 2, артериальной гипертензией второй стадии. Учитывая наличие у больного коморбидного фона, для лечения следовало использовать системный антимикотик тербинафин. Однако было выявлено кандидозное поражение пищевода: выделено два возбудителя, один из которых был малочувствителен к тербинафину. Именно поэтому выбор сделали в пользу итраконазола (Итразола) – препарата широкого спектра действия, к которому чувствительны оба возбудителя. Итразол применяли в дозе 200 мг/сут тремя курсами пульс-терапии. Одновременно были проведены аппаратный педикюр (дважды за курс лечения) и терапия лаком с аморолфином в течение шести месяцев. Улучшение наблюдалось уже через полтора месяца лечения. «Мы получили от такой комбинированной терапии очень хороший эффект. Полное отрастание ногтевых пластинок у пациента с коморбидным состоянием заняло менее года», – отметила Л.П. Котрехова в завершение выступления.
Герпесвирусные инфекции. Взгляд иммунолога
Вирусы простого герпеса – это облигатные внутриклеточные паразиты подсемейства Alphaherpesvirinae, которые характеризуются высокой цитопатической активностью с относительно коротким репликативным циклом и широким спектром поражаемых хозяев. Большинство людей переносят первичное инфицирование одним или несколькими герпесвирусами, которые остаются в латентном состоянии на протяжении всей жизни.
Течение герпесвирусной инфекции может быть острым, хроническим, рецидивирующим или латентным (бессимптомным). По словам заведующего отделением аллергологии и иммунотерапии Института иммунологии, д.м.н., профессора Андрея Евгеньевича ШУЛЬЖЕНКО, вирусная персистенция – это совершенно уникальный механизм, который заключается в способности выживать в условиях активности врожденного и адаптивного иммунного ответа.
Как известно, на каждый возбудитель в организме вырабатываются специфические антитела. В случае герпесвирусной инфекции наиболее значимыми являются иммуноглобулины классов М и G (IgM, IgG). IgM синтезируются с четвертого дня после контакта клеток иммунной системы с антигеном (вирусом герпеса) и достигают максимального уровня к 15–20-му дню. Затем их уровень в сыворотке крови постепенно снижается до нулевых значений. Через 14 дней начинается выработка антител IgG, которые будут циркулировать в кровотоке в течение всей жизни. В настоящее время 75–90% взрослого населения планеты являются носителями антител IgG к вирусу герпеса.
Определение вирус-специфических антител в сыворотке крови человека целесообразно проводить в следующих случаях:
1) необходимо установить тип вируса простого герпеса (первый или второй);
2) в анамнезе отмечено атипичное или бессимптомное течение герпесвирусной инфекции;
3) при наличии клинической картины не определяется ДНК вируса в очаге поражения;
4) необходимо дифференцировать первичное инфицирование и рецидив герпесвирусной инфекции;
5) при тестировании беременных без клинических проявлений герпеса.
Профессор А.Е. Шульженко отметил, что выявление специфических антител к вирусам простого герпеса в отсутствие клинических проявлений заболевания не является основанием для постановки диагноза и не требует назначения терапии.
У пациентов с высокой частотой рецидивов герпесвирусной инфекции (более шести раз в год) следует оценивать не только уровень антител, но и их авидность – способность антител связывать возбудитель инфекции. Высокая авидность антител говорит об усиленном, а низкая – об ослабленном или, возможно, еще не сформированном специфическом гуморальном иммунном ответе. Часто исследований гуморального иммунного ответа недостаточно для понимания иммунопатологических процессов в организме, приводящих к потере контроля над герпесвирусной инфекцией. В таких случаях необходимо дополнительное, более расширенное исследование иммунной системы: определение субпопуляций лимфоцитов, активности NK-клеток, концентрации спонтанного и индуцированного альфа- и гамма-интерферона. В большинстве случаев только по результатам такого глубокого и полноценного исследования можно назначить адекватную как противовирусную, так и иммуномодулирующую терапию.
На сегодняшний день согласно международным стандартам лечения препаратами выбора с доказанной противогерпетической эффективностью являются ациклические нуклеозиды – ацикловир, валацикловир и фамцикловир1. Их использование обеспечивает этиотропную направленность лечения как в период обострения, так и в межрецидивный период.
Уникальность противогерпетического действия ациклических нуклеозидов обусловлена тем, что они активируются специфическим ферментом герпесвирусов – тимидинкиназой, которая связывается с химиопрепаратами быстрее, чем клеточная. В результате происходит накопление действующего вещества исключительно в инфицированных клетках. ДНК-полимераза герпесвирусов всегда ошибочно включает фосфорилированные ациклические нуклеозиды в концевые участки синтезируемых новых вирусных ДНК, вместо естественного дезоксигуанозина трифосфата. Как следствие, нарушается репликация (размножение) возбудителя. Благодаря этому достигается высочайшая избирательность препаратов в отношении вирусов простого герпеса без вмешательства в биохимию свободных от вируса клеток. Это также обеспечивает высокий профиль безопасности ациклических нуклеозидов.
Первый ациклический нуклеозид – ацикловир по праву считается эффективным и безопасным препаратом. Его недостаток заключается в низкой биодоступности и неудобной схеме приема (до четырех-пяти раз в сутки).
Создание препарата валацикловир (путем присоединения аминокислоты валина к ацикловиру) способствовало решению проблемы: кишечная абсорбция валацикловира по сравнению с ацикловиром повысилась в четыре-пять раз, что резко увеличило его биодоступность.
При этом в результате приема валацикловира обеспечивается почти такая же высокая и стабильная концентрация ацикловира в крови, как и в результате применения инъекционного ацикловира.
Клинические подходы к лечению герпесвирусной инфекции ациклическими нуклеозидами предполагают две схемы лечения:
1) эпизодическая противовирусная терапия, направленная на предотвращение рецидива, с известным пусковым (триггерным) фактором: валацикловир по 500 мг (одна таблетка) два раза в сутки в течение 5–10 дней;
2) супрессивная противовирусная терапия (6–12 месяцев). Показана пациентам с частыми рецидивами герпесвирусной инфекции, а также пациентам с тяжелым и длительным течением заболевания: валацикловир 500–1000 мг в сутки ежедневно (USTI, 2010 г.). Длительная супрессивная терапия эффективно снижает риск рецидива и способна предотвратить передачу вируса простого герпеса партнеру.
Преимуществами отечественного препарата Валцикон являются:
-
ускорение заживления при рецидивирующей герпетической инфекции на 30%;
-
значительное уменьшение средней продолжительности рецидива;
-
достоверное снижение частоты рецидивов;
-
удобная схема приема по сравнению с ацикловиром;
-
безопасность, сравнимая с ацикловиром, при более высокой эффективности.
Валцикон выпускается в виде таблеток (№ 10 и 42), покрытых пленочной оболочкой, содержащих 556 мг валацикловира гидрохлорида, что эквивалентно 500 мг валацикловира.
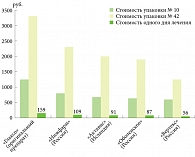
Бесспорно, снижение себестоимости терапии повышает ее доступность для пациента, а следовательно, и приверженность лечению. Фармакоэкономический анализ стоимости оригинального валацикловира и его дженериков демонстрирует, что препарат Валцикон занимает лидирующую позицию (рис. 2).
Один день длительной супрессивной терапии препаратом Валцикон стоит 56 руб., что значительно ниже стоимости одного дня лечения и оригинальным валацикловиром, и другими его дженериками.
К сожалению, в реальной клинической практике врачи в острый период заболевания часто вместо противогерпетических препаратов (ациклических нуклеозидов) назначают иммуномодуляторы в качестве монотерапии. «Иммунотропные препараты, действительно, способствуют ускорению клинического выздоровления, преодолению резистентности, предотвращению рецидивов. В то же время у них нет точечного воздействия на выбранное звено иммунной системы, поэтому при длительном и бессистемном приеме происходит истощение иммунного ответа. Кроме того, их прямое противовирусное действие не доказано. Поэтому назначать иммуномодуляторы в монотерапии при обострении герпесвирусной инфекции не рекомендуется», – подчеркнул профессор А.Е. Шульженко в заключение.
Комбинированная терапия герпесвирусной инфекции: обоснование и тактика
Как отметила заведующая кафедрой дерматовенерологии и косметологии Новосибирского государственного медицинского университета, д.м.н., профессор Ольга Борисовна НЕМЧАНИНОВА, по данным глобального клинико-эпидемиологического исследования международного герпетического форума, в большинстве индустриальных стран около 80% населения инфицируется вирусом простого герпеса (ВПГ) к 40 годам. Сложности терапии простого герпеса обусловлены формированием резистентности к базовым препаратам, иммуносупрессивным эффектом противовирусных препаратов при длительном применении, угнетением иммунитета в период репликации вируса и идентичными механизмами действия используемых противогерпетических средств. Все это диктует необходимость применения комплексной терапии.
Основные механизмы развития резистентности к ацикловиру связаны с появлением мутантных штаммов ВПГ.
Причины этого кроются, во-первых, в отсутствии индукции вирусом специфической тимидинкиназы, во-вторых, в том, что тимидинкиназа продуцируется, однако она генетически изменена и не может осуществлять фосфорилирование ацикловира, в-третьих, в том, что мутации происходят в гене ДНК-полимеразы, в результате чего снижается чувствительность к тормозящему действию ацикловира трифосфата.
Согласно данным литературы, у пациентов, страдающих простым герпесом, наряду с системным иммунодефицитом наблюдается снижение местной резистентности кожи и слизистых, приводящее к незавершенному фагоцитозу вирусов и уменьшению продукции интерферона альфа, который наиболее активно участвует в цитолизе инфекционного агента и играет важную роль в борьбе с ВПГ. При этом выраженность нарушений местного иммунитета находится в прямой корреляции с системным иммунодефицитом. Установлено также, что в период ремиссии в местах типичной локализации простого герпеса присутствует возбудитель в виде провируса. По мнению докладчика, эти факты дают основание включать местные противовирусные средства в терапию рецидивов простого герпеса.
Местные противовирусные препараты могут применяться как отдельно, так и в комплексе с системными противовирусными препаратами. В виде монотерапии их лучше использовать на пике обострения, в первые три дня после начала рецидива, когда уже наблюдаются клинические проявления простого герпеса. В остальных ситуациях показана комбинированная терапия, которая у подавляющего большинства пациентов дает более высокие клинические результаты и позволяет полностью купировать симптомы в продромальный период или на стадии эритемы2.
Местные противовирусные препараты необходимы:
-
для нивелирования цитопатического действия и подавления репродукции ВПГ в очаге поражения;
-
как дополнение к системной терапии в продромальный период и на пике обострения;
-
для модуляции локального иммунитета.
Новое средство в терапии герпеса – противовирусный препарат прямого действия Девирс. Это единственный на сегодняшний день препарат рибавирина в форме крема для лечения герпетической инфекции, зарегистрированный в России.
Рибавирин считается сильным противовирусным препаратом, активным в отношении ДНК-вирусов (герпесвирусы, аденовирусы, вирусы оспы) и РНК-вирусов (грипп А и В, парамиксовирусы, реовирусы и др.). Девирс (рибавирин) наносится на пораженные участки кожи и слизистой (за исключением области глаз) пять раз в сутки – до полного исчезновения симптомов.
Девирс оказывает тройное действие на ВПГ3:
-
индуцирует переход иммунного ответа в Т-хелперы типа 1, запускает цитотоксическую реакцию, не подавляя при этом общие показатели иммунной системы;
-
ингибирует инозин-монофосфат-дегидрогеназу, нарушая тем самым синтез ДНК-вируса. При этом резистентность не формируется;
-
вызывает прямые мутации в геноме вируса за счет продукции дефектной вирусной ДНК. При этом не подавляется синтез ДНК человека.
Показаниями к применению Девирса служат инфекции кожи и слизистых оболочек, вызванные ВПГ типов 1 и 2, различной локализации, опоясывающий герпес (в составе комплексной терапии). Противопоказаниями – повышенная чувствительность к рибавирину или другим компонентам препарата, беременность и период лактации, детский и юношеский возраст (до 18 лет).
Клиническая эффективность местной терапии герпетической инфекции препаратами рибавирина подтверждена рядом международных исследований4. Девирс уменьшает клинические проявления вируса в очаге поражения, ускоряет эпителизацию и сокращает длительность выделения вируса из очага поражения. Девирс способен селективно ингибировать синтез вирусного генома, не подавляя синтез ДНК в нормально функционирующей клетке.
Преимуществами комплексной терапии «Валцикон + Девирс» считаются синергетический эффект в отношении ВПГ, преодоление возможной резистентности к традиционной противовирусной терапии, быстрое купирование процесса и сокращение сроков лечения.
При первичном эпизоде простого герпеса Валцикон применяется в дозе 500 мг два раза в сутки в течение 5–10 дней. Системная терапия может быть дополнена нанесением крема Девирс на пораженные участки кожи пять раз в сутки – до полного исчезновения симптомов.
Тактика ведения пациентов с рецидивом простого герпеса в продромальный период или на начальных этапах проявления заболевания предусматривает назначение комбинированной терапии по схеме: Валцикон в дозе 500 мг два раза в сутки в течение пяти дней в сочетании с кремом Девирс на пораженные участки кожи пять раз в сутки (до полного исчезновения симптомов). Если герпетические высыпания существуют более двух дней, достаточно местной терапии.
При длительной супрессивной терапии простого герпеса Валцикон применяется в дозе 500 мг один раз в сутки в течение 4–12 месяцев, в случае рецидива к терапии следует добавить крем Девирс. Его наносят пять раз в сутки.
В случае опоясывающего лишая рекомендуется противовирусная терапия Валциконом в дозе 1000 мг три раза в сутки в течение семи дней. Можно применять комбинацию «Валцикон + Девирс». В отсутствие эффекта в указанные сроки противовирусную терапию следует продолжать до исчезновения кожных высыпаний.
В заключение профессор О.Б. Немчанинова сформулировала следующие выводы:
-
крем Девирс (рибавирин) обладает высоким терапевтическим потенциалом по сравнению с другими местными противовирусными препаратами;
-
механизм противовирусного действия рибавирина принципиально отличается от такового у препаратов ацикловирного ряда, что обусловливает синергизм противовирусного эффекта при их совместном применении;
-
крем Девирс может назначаться в продромальный период в сочетании с системным противовирусным препаратом Валцикон, а со второго-третьего дня обострения – в виде монотерапии;
-
комбинированная противовирусная терапия позволяет добиться более высоких результатов и купировать клинические симптомы в продромальный период или на стадии эритемы у большинства пациентов.
Заключение
Современные подходы к лечению небактериальных инфекций диктуют потребность в новых лекарственных средствах, отвечающих оптимальному соотношению «эффективность/безопасность/доступная стоимость». Подобную возможность врачам и пациентам предоставляет компания «Вертекс», выпускающая линейку новых препаратов для лечения грибковых поражений ногтей и герпесвирусных инфекций. Приведенные докладчиками данные исследований и примеры из собственной клинической практики продемонстрировали, что рациональное применение в практической дерматологии препарата Итразол для лечения ОМ у коморбидных больных способствует полному клиническому выздоровлению. Назначение препарата Валцикон и крема Девирс (рибавирин) как в монотерапии, так и в составе комбинированной терапии позволяет достоверно значимо снизить частоту обострений герпеса, уменьшить среднюю продолжительность рецидива и ускорить заживление герпетических высыпаний, преодолеть возможную резистентность к традиционной противовирусной терапии и сократить сроки лечения. Разнообразие форм выпуска, удобство применения, эффективность и безопасность, а также доступная стоимость линейки препаратов для лечения грибковых поражений и герпесвирусных инфекций позволяют повысить приверженность пациентов лечению.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.