Неврология в лицах: от простого к сложному
- Аннотация
- Статья
- Ссылки
Коагулопатия и COVID-19: внимание на детали
Открывая симпозиум, профессор кафедры клинической фармакологии лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова, д.м.н. Марина Викторовна ПУТИЛИНА отметила, что современные реалии диктуют необходимость всестороннего рассмотрения ранних и отдаленных неврологических проявлений и осложнений COVID-19.
Коронавирусная инфекция COVID-19, вызванная вирусом SARS-CoV-2, опасна высокой контагиозностью и осложнениями, в частности острой дыхательной недостаточностью и поражением многих органов, прежде всего нервной системы и желудочно-кишечного тракта (ЖКТ). Отсутствие вирус-специфической терапии, особенно при тяжелых формах заболевания, обусловлено повышенным риском летального исхода.
В настоящее время коронавирусная инфекция COVID-19 включена в Международную классификацию болезней 10-го пересмотра (МКБ-10), разработаны методические временные рекомендации по ее лечению. С 2019 г. систематизируется информация, расширяются знания о патогенезе и клиническом течении коронавирусной инфекции. В связи с этим периодически обновляются рекомендации, корректируется перечень лекарственных препаратов для лечения пациентов с COVID-19.
Согласно недавно опубликованным данным зарубежных исследователей, различают три фазы заражения коронавирусом. В первой фазе вирус проникает в альвеолярные эпителиальные клетки 2-го типа, вызывая первичный иммунный ответ. После вирусной репликации и пролиферации иммунный ответ инициируется моноцитами, макрофагами, нейтрофилами. Вторая фаза, получившая название легочной, характеризуется поражением легких, развитием легочного фиброза. В третьей фазе воспалительные цитокины (интерлейкины (ИЛ) 2, 6, 7, фактор некроза опухоли (ФНО) альфа, интерферон гамма) вызывают цитокиновый шторм и системное воспаление. У больных развиваются полиорганная недостаточность, наблюдается тяжелое течение COVID-19, нередко приводящее к летальному исходу.
Повреждение паренхимы легких возникает в результате воспалительных процессов, вазодилатации, проницаемости эндотелия, рекрутирования лейкоцитов и отека легких. Деструкция эндотелия сосудов легких путем прямого проникновения SARS-CoV-2 и индуцированного воспаления может предрасполагать к образованию микротромбов и инфаркту легких. Однако в ряде случаев развитие вируса затормаживается на первой стадии. Но надо помнить, что практически при любой фазе заражения имеют место нарушения эндотелия и иммунной системы. SARS-CoV-2 напрямую вызывает гибель эндотелиальных клеток через гематоэнцефалический барьер. Плотные контакты в эндотелиальных клетках разрушаются посредством моноцитов, нейтрофилов, ИЛ-1-бета, ФНО-альфа.
На третьей стадии заражения коронавирусной инфекцией отмечаются нарушения в системе свертываемости крови, поражается нервная система. Образовавшиеся микротромбы мигрируют в головной мозг и органы-мишени. У пациентов развиваются лакунарные инсульты, которые можно трактовать как болезнь малых сосудов.
Повышенные уровни плазмина и плазминогена служат биомаркерами повышенной восприимчивости к SARS-CoV-2, поскольку протеаза плазмин способна «разрезать» соответствующий сайт S-белка SARS-CoV-2, повышая вирулентность.
Накопленные данные свидетельствуют о том, что пациенты с тяжелым течением коронавирусной инфекции в большей степени склонны к коагулопатии, связанной с COVID-19, чем больные с легким течением. Именно в этой группе пациентов регистрируется большее количество летальных исходов.
Эксперт рассмотрела возможный механизм, связывающий нарушение регуляции воспаления и коагуляции с тромбозом. Провоспалительные цитокины и инфекция эндотелия SARS-CoV-2 способствуют гиперкоагуляции за счет активации прокоагулянтов, таких как тканевой фактор, Р-селектин, фибриноген, фактор фон Виллебранда. Происходят подавление физиологических антикоагулянтов, таких как тромбомодулин и рецептор эндотелиального протеина, модуляция фибринолиза за счет увеличения экспрессии ингибитора активатора плазминогена 1-го типа и рекрутирования лейкоцитов. Таким образом, гипоксия и неподвижность у госпитализированных пациентов с COVID-19 являются мощными триггерами тромбоза.
К предикторам тяжелого течения инфекции COVID-19 и развития коагулопатии относятся:
- одышка, сниженная оксигенация крови (SpO2 < 90%);
- лимфопения;
- гипоальбуминемия;
- повышенные уровни аланинаминотрансферазы, аспартатаминотрасферазы, лактатдегидрогеназы, маркера коагуляции D-димера;
- повышение уровней маркеров воспаления С-реактивного белка (СРБ), ферритина, ИЛ-2R, ИЛ-6, ИЛ-10, ФНО-альфа.
Тяжелые пациенты, обычно в стационарах, нуждаются не только в определении уровней ферритина, ИЛ, но и локусов CD4+ и CD8+1.
Коагулопатия, связанная с COVID-19, характеризуется легкой тромбоцитопенией, небольшим удлинением протромбинового времени, высоким уровнем D-димера и повышенными уровнями фибриногена, фактора VIII и фактора фон Виллебранда. Уровни D-димера, продукта распада поперечно-сшитого фибрина, коррелируют с тяжестью заболевания и позволяют прогнозировать риск тромбоза, потребность в искусственной вентиляции легких и смертность.
Тромбоцитопения у пациентов, перенесших COVID-19, может быть вторичной по отношению к прямому взаимодействию тромбоцитов вируса через рецепторы распознавания патогена. Такое взаимодействие приводит к активации тромбоцитов и последующему клиренсу ретикулоэндотелиальной системой.
Механизмы, лежащие в основе длительного тромбофилического состояния после инфицирования COVID-19, неизвестны, но могут быть связаны с диффузной инфекцией эндотелиальных клеток сосудов, повреждением и дисфункцией.
При коронавирусной инфекции поражения центральной и периферической нервной системы могут проявляться неврологическими симптомами различной степени выраженности. Причем подобные симптомы на первом этапе не всегда коррелируют с тяжестью собственно вирусной инфекции.
Докладчик рассмотрела клинический случай. Пациентка М., 40 лет, поступила в стационар с транзиторной глобальной амнезией. Ее госпитализировали по скорой помощи с предварительным диагнозом «острое нарушение мозгового кровообращения». Больной проведен скрининг. По данным компьютерной томографии, патологии не выявлено. Магнитно-резонансная томография (МРТ) головного мозга показала признаки очагового изменения сосудистого генеза, микроангиопатию, последствия хронических микрокровоизлияний в базальных ядрах с обеих сторон. Согласно результатам анализа крови, тромбофилическое состояние, повышение уровней D-димера, СРБ, фактора 12, протеинов S/C. Анализ на COVID-19 методом полимеразной цепной реакции (ПЦР) отрицательный. Диагноз: тромбофилия, артериальная гипертензия 2-й степени.
Пациентке назначили антикоагулянтную терапию, на фоне которой состояние ухудшилось, появились носовые и обильные маточные кровотечения. Больная самостоятельно прекратила прием антикоагулянтов. На амбулаторном приеме через неделю после выписки из стационара пациентке назначили препарат Курантил N 75 мг/сут, рекомендовали сдать повторные анализы на коронавирусную инфекцию. Анализ на COVID-19: наличие антител к SARS-CoV-2 (иммуноглобулин (Ig) G).
На фоне применения Курантила N зафиксировано снижение уровня D-димера. Через месяц терапии уровни D-димера пришли в норму, неврологическая симптоматика регрессировала.
Чем было обусловлено тяжелое неврологическое состояние пациентки? По данным МРТ, у больной имела место микроангиопатия – одно из распространенных неврологических осложнений при COVID-19. Наиболее частыми нарушениями, связанными с тромботической микроангиопатией, являются тромбоцитопеническая пурпура и синдром гемолитической уремии.
Отличить коагулопатию, связанную с COVID-19, от синдрома диссеминированного внутрисосудистого свертывания (ДВС-синдрома) и тромботической микроангиопатии на ранних стадиях можно по рутинным лабораторным анализам. Среди отличительных лабораторных маркеров коагулопатии, связанной с COVID-19, прежде всего следует отметить увеличение уровней D-димера, СРБ, изменение антикардиолипиновых антител, протеина С2.
К патологическим особенностям тромботической микроангиопатии относится образование диссеминированных артериолярных и капиллярных тромбов, состоящих из агрегированных тромбоцитов, фактора фон Виллебранда и фибрина с отеком соседних сосудистых эндотелиальных клеток. Кровотечение при тромботической микроангиопатии не распространено.
В рассматриваемом клиническом случае у пациентки выявлены множественные очаги сосудистого генеза и отек сосудистых эндотелиальных клеток.
При коронавирусной инфекции клинические проявления, связанные с центральной нервной системой, включают головную боль, головокружение, нарушение сознания, атаксию и судороги, когнитивные нарушения3. Эти симптомы вписываются в концепцию болезни мелких сосудов. Термин «болезнь мелких сосудов» используется для описания ряда синдромов, патогенез которых в значительной степени неясен. Возможно, они связаны с повреждением перфорирующих церебральных артериол, капилляров и венул. По данным наблюдений, у детей с COVID-19 встречается синдром Кавасаки – классический некротизирующий системный васкулит с преимущественным поражением средних и мелких артерий. Он проявляется лихорадкой, поражением коронарных и других висцеральных артерий с возможным образованием аневризм, тромбозов и разрывов сосудистой стенки.
Среди симптомов ковидного тромбоваскулита у взрослых пациентов прежде всего следует отметить резкую головную боль, не адекватную интоксикации. У полиморбидных пожилых пациентов иногда присоединяется суставная боль, боль в спине. Кроме того, ковидный тромбоваскулит характеризуют такие симптомы, как необычная слабость, появление чрезвычайно ярких снов и видений, потеря ориентации во времени и пространстве, депрессия, суицидальные мысли, резкие перепады настроения и нарушение ритмов жизнедеятельности. Многие пациенты жалуются на нарушения терморегуляции, нередко возникает гипотермия. Нарушается регулирование уровня артериального давления, ритма сердца, зрения и слуха, дыхания, менструального цикла, прохождения пищи по ЖКТ.
По словам профессора М.В. Путилиной, всем пациентам с подтвержденной инфекцией COVID-19 или подозрением на нее при развитии судорожного синдрома, угнетении или изменении сознания, появлении новой очаговой неврологической симптоматики показано выполнение МРТ головного мозга в режимах Т2-градиент, FLAIR, SWI с контрастированием, при невозможности выполнения МРТ – компьютерная томография головы. В ряде случаев проводят исследования цереброспинальной жидкости методом ПЦР на носительство COVID-19.
Согласно рекомендациям Международного общества по проблемам тромбоза и гемостаза (ISTH) по выявлению и лечению коагулопатии у больных COVID-19, диагностика коагулопатии включает определение уровня D-димера, протромбинового времени, содержания тромбоцитов и фибриногена. После этого выбирается схема терапии. Эксперты предлагают включать в исследования клинические испытания противовирусных, противовоспалительных и иммуномодулирующих препаратов для лечения тромбозов и микротромбозов.
Сегодня рассматривается новое направление терапии COVID-ассоциированного тромбоза – воздействие на внеклеточные ловушки нейтрофилов (NET). Они состоят из внеклеточных нитей хроматина (нуклеиновых кислот, ДНК), обернутых вокруг гистонов (нуклеосом) и переплетенных с нитями фибрина. NET служат идеальной основой для связывания активированных тромбоцитов, эритроцитов, активации фактора Хагемана и выработки тромбина для производства фибрина. Таргетная терапия, направленная на NET, может сыграть существенную роль в лечении тромботических заболеваний, к которым потенциально относится и COVID-192.
Показано, что дипиридамол подавляет NETоз, опосредованный протромботическими антифосфолипидными аутоантителами (аРL-антитела), и смягчает венозный тромбоз мышей в лабораторных условиях. В свою очередь дипиридамол подавляет IgG-опосредованное высвобождение NET из нейтрофилов у пациентов с COVID-19 in vitro4.
Недавно началось рандомизированное клиническое исследование DICER, в котором тестируется дипиридамол у пациентов с COVID-19. Цель исследования – сравнить эффективность дипиридамола и плацебо в снижении тромбообразования.
В исследовании X. Liu и соавт. (2020) дипиридамол продемонстрировал преимущество перед хлорохином в дозозависимом подавлении репликации вируса SARS-CoV-2 в клетках in vitro5.
Механизм действия дипиридамола у пациентов с COVID-19 обусловлен его уникальными свойствами. Дипиридамол – ингибитор фосфодиэстеразы, является индуктором интерферона и оказывает модулирующее действие на функциональную активность системы интерферона. Дипиридамол воздействует на систему D-димера, обладает антиоксидантным и противовоспалительным эффектами, а также способствует снижению тромбообразования. Установлено, что антиагреганты, в том числе дипиридамол, способны замедлять развитие идиопатического легочного фиброза при COVID-19.
По данным библиотеки лекарственных средств FDA, антикоагулянтный препарат дипиридамол подавляет репликацию SARS-CoV-2 in vitro, оказывает сильное влияние на интерферон-1, облегчает патологию легких в вирусной модели пневмонии. При анализе 12 пациентов с COVID-19, получавших антикоагулянтную терапию, добавление дипиридамола значительно увеличивало количество тромбоцитов и лимфоцитов. На фоне применения препарата снижался уровень D-димера, повышался уровень гемоглобина, улучшался прогноз, в том числе у тяжелых пациентов. Пациенты принимали дипиридамол в дозе 50 мг три раза в день (150 мг/сут) в течение двух недель. Эти данные подтвердили турецкие исследователи, которые заявили, что дипиридамол снижает риск коагулопатии при COVID-19. Анализ наблюдений за 510 пациентами с COVID-19, 369 из которых получали дипиридамол в качестве профилактики коагулопатии, показал, что на фоне применения дипиридамола снижался риск развития коагулопатии6.
В Мичиганском университете в 2020 г. началось плацебоконтролируемое рандомизированное исследование эффективности дипиридамола у пациентов с COVID-19. Цель исследования – оценить влияние 14-дневной терапии дипиридамолом на снижение чрезмерной свертываемости крови у пациентов с COVID-19. Первичная конечная точка исследования – уменьшение уровня D-димера в плазме крови, комбинированная точка – смерть, искусственная вентиляция легких, насыщение кислородом. Завершение исследования планируется в ближайшее время.
Дипиридамол (Курантил N) действует как плейотропный многоэффекторный препарат. Он воздействует на эндотелиоциты, ангиомиоциты, тромбоциты, макрофаги, снижает уровень воспаления и оказывает антиоксидантный эффект. Эффекты дипиридамола обусловлены усилением активности эндогенного аденозина, который влияет на гладкую мускулатуру сосудов, препятствует высвобождению норэпинефрина и защищает нейроны в условиях ишемии. Дипиридамол оказывает вазорелаксирующее действие, снижает окислительный стресс, воспаление и улучшает ангиогенез7.
Дипиридамол входит в протокол лечения COVID-19 медицинского центра МГУ. Кроме того, во временных рекомендациях по диагностике и лечению новой коронавирусной инфекции в последней редакции дипиридамол также рассматривается как средство профилактики коагулопатии.
Особый интерес вызывает противовирусное действие Курантила N, поскольку для иммунотерапии острых респираторных вирусных инфекций (ОРВИ), в том числе COVID-19, широко используются индукторы интерферона. Они способствуют синтезу сбалансированного количества эндогенных интерферонов, на фоне их однократного введения в терапевтических дозах улучшается иммунный ответ. Курантил N повышает неспецифическую противовирусную резистентность к вирусным инфекциям как индуктор интерферона. Препараты этой группы включены во временные методические рекомендации «Лекарственная терапия ОРВИ в амбулаторной практике в период пандемии COVID-19». Важно, что в отличие от других иммуномодуляторов Курантил N 25 характеризуется удобной схемой применения: 50 мг один раз в неделю в течение четырех-пяти недель для профилактики ОРВИ. Такая схема лечения особенно удобна для пожилых пациентов, принимающих несколько лекарственных препаратов.
Откуда родом боль? Биомеханические нарушения как фактор хронизации боли в спине
По словам заведующего кафедрой неврологии, психиатрии, мануальной медицины и медицинской реабилитации Волгоградского государственного медицинского университета, члена совета экспертов Ассоциации междисциплинарной медицины, д.м.н., профессора Александра Евгеньевича БАРУЛИНА, постковидный синдром может сопровождаться разной симптоматикой, в частности болью различной локализации. Эксперт рассмотрел факторы риска хронизации боли, связанные с биомеханическими нарушениями.
На сегодняшний день наиболее актуальной моделью хронической боли считается биопсихосоциальная. В соответствии с биопсихосоциальной моделью, боль является результатом взаимодействия биологических, психологических и социокультурных факторов.
Биологические факторы инициируют и поддерживают изменения в фасеточных суставах, позвоночнике и позвоночно-двигательном сегменте. Нарушения биомеханики вызывают перегрузку опорно-двигательных сегментов, которая ведет к развитию дегенеративно-дистрофических изменений и болевого синдрома. Докладчик на примере ряда наблюдений наглядно продемонстрировал роль биомеханических нарушений в формировании хронической боли в спине.
При обследовании пациентов оценивают статические показатели, обращая внимание прежде всего на конституциональные особенности. Однако даже у атлетически сложенного человека, регулярно занимающегося спортом, с точки зрения биомеханики можно обнаружить статические изменения, например различия оси регионов по горизонтальным позициям (одно плечо выше другого), явления ротации таза вокруг вертикальной оси, антеверсию таза, смещение центра тяжести.
Без сомнения, биомеханические нарушения опорно-двигательного аппарата в патогенезе боли в спине играют не последнюю роль. Так, патологические изменения в области поясничного отдела, проявляющиеся болевой реакцией, могут быть обусловлены биомеханической перегрузкой. У лиц с плоскостопием подобные изменения нередко носят системный характер, сначала затрагивая коленные суставы, затем крупные суставы, позвоночник. Таким образом, в контексте перегрузки, связанной со статическими и динамическими нарушениями, формируются опорно-двигательные нарушения с болевым синдромом.
В клинической практике часто встречаются пациенты с жалобами на боль в плече. Перед назначением им лечения необходимо определить структуру формирования биомеханических нарушений, обозначить мышечную группу, вовлеченную в патологический паттерн. Для дополнительного реабилитационного лечения можно рекомендовать кинезиотейпирование, различные аппликации для включения разных мышечных групп, стабилизации плечевого сустава, лимфодренажную технику или методы, направленные на биомеханическую коррекцию.
Тело человека можно рассматривать как систему «биотенсегрити». Структура «тенсегрити» – компоненты натяжения и сжатия. Компоненты сжатия стремятся наружу, противодействуя компонентам натяжения, тянущим внутрь. Если оба силовых компонента уравновешены, структура стабильна. Но если систему нарушить, она будет меняться в каскаде реакций, создавая определенные зоны компенсации. Большую роль в этом процессе играет фасция. Сила мышц, сила тяжести и опоры передаются по фасциальным сетям. Фасции максимально подвижны, эластичны и способны восстанавливаться. Фасции превращают или сводят к минимуму локальное напряжение в области мышц и суставов. Эти особенности показывают важность взаимодействия мышечной, фасциальной и костной структур. Сократить отдельно взятую мышцу невозможно, но можно координировать направление. Изменения направления движения делают возможной перестройку всего опорно-двигательного аппарата.
Нельзя не упомянуть и таком заболевании костно-мышечной системы и соединительной ткани, как дорсопатия. Повреждение нервного волокна при дорсопатии может быть обусловлено компрессией, воспалением, отеком, ишемией, демиелинизацией и аксональной дегенерацией. При лечении дорсопатии основной акцент делается на снижении выраженности воспаления и купировании зоны компрессии.
Лечение пациентов с хронической болью, обусловленной биомеханическими нарушениями, представляет сложный многосторонний процесс, включающий воздействие на очаг воспаления, устранение мышечного спазма. При ведении пациентов с болью необходимо помнить, что в основе хронической боли лежат изменения центральной и периферической нервной системы (периферическая и центральная сенситизация). Не исключена и нисходящая дизингибиция, то есть недостаточность нисходящего антиноцицептивного влияния. Сказанное означает, что пациенты с хронической болью нуждаются в патогенетической терапии8.
Основной составляющей симптоматического и патогенетического лечения боли в спине являются нестероидные противовоспалительные препараты (НПВП). Минимальный курс противовоспалительной терапии для полного купирования боли и воспалительного процесса в очаге поражения должен составлять 10–14 дней.
Декскетопрофена трометамол – действующее вещество препарата Дексалгин, обладающее анальгезирующим, противовоспалительным и жаропонижающим эффектами. Механизм действия препарата обусловлен ингибированием синтеза простагландина на уровне циклооксигеназы (ЦОГ) 1 и ЦОГ-2. Анальгезирующее действие Дексалгина проявляется через 30 минут после парентерального введения. Препарат выпускается в разных лекарственных формах – раствор для внутривенных или внутримышечных инъекций, таблетки и гранулы для приготовления раствора. При острой боли назначают Дексалгин внутримышечно или внутривенно с последующим переходом на пероральную форму.
На сегодняшний день в лечении пациентов с болью хорошо зарекомендовал себя Дексалгин в форме гранул для приготовления раствора (один пакетик каждые восемь часов). Его отличает более быстрое всасывание декскетопрофена при приеме внутрь по сравнению с таблетированной формой препарата. Применение препарата Дексалгин в форме гранул для приготовления раствора способствует более быстрому наступлению противовоспалительного и анальгетического эффектов.
Для лечения слабой и умеренной боли также используют препараты с противовоспалительным действием. Продолжительность терапевтического курса зависит от выраженности дегенеративного процесса и воспалительной реакции. При преобладании воспалительного процесса можно применять монотерапию препаратом Нимесил в форме гранул для приготовления суспензии по одному пакетику (100 мг нимесулида) два раза в день в течение 15 дней.
Нимесил (нимесулид) – НПВП с выраженным противовоспалительным и обезболивающим действием. Нимесил – препарат многофакторного действия, преимущественно ингибирует ЦОГ-2, агрегацию и миграцию нейтрофилов, нейтрализует токсичные свободные радикалы. Кроме того, нимесулид подавляет выработку медиаторов воспаления (ИЛ-6, ФНО-альфа), ингибирует синтез металлопротеиназ, синтез и высвобождение субстанции Р.
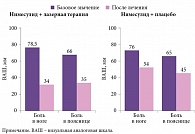
Нимесил эффективно уменьшает болевой синдром в спине у пациентов с радикулопатией, характеризуется выраженным анальгетическим, а также противовоспалительным эффектом, обусловленным активным противовоспалительным компонентом (рис. 1)9.
В исследованиях последних лет показано, что нимесулид характеризуется низким риском развития кровотечений из верхних отделов ЖКТ: в три раза меньше, чем у мелоксикама, в два раза меньше, чем у эторикоксиба. Таким образом, нимесулид имеет более благоприятный профиль безопасности по сравнению с другими НПВП.
Завершая выступление, эксперт подчеркнул, что для восстановления правильной биомеханики у пациентов с хронической болью можно использовать дополнительные ортопедические, коррекционные методы, прежде всего нейродинамические техники для стимуляции и восстановления объема движений.
Диагностика и лечение диабетической полинейропатии: от простого к сложному
Президент региональной общественной организации «Северо-Западное общество по изучению боли», профессор кафедры нервных болезней Военно-медицинской академии им. С.М. Кирова, д.м.н. Дмитрий Анатольевич ИСКРА продолжил симпозиум докладом о современных методах лечения диабетической полинейропатии (ДПН). Он отметил, что заболеваемость сахарным диабетом (СД) в мире растет угрожающими темпами. За последние десять лет число пациентов с СД в нашей стране удвоилось. Опыт последних лет показывает, что СД ухудшает прогноз течения COVID-19. Пациенты с СД и предиабетом чаще умирают от коронавирусной инфекции.
Диабетическая полинейропатия – самое распространенное осложнение СД со стороны периферической нервной системы. Его выявляют у 50% пациентов с манифестной формой СД и 32% пациентов с предиабетом. При этом 20–30% больных ДПН страдают от нейропатической боли. Автономная полинейропатия является основной причиной смерти больных СД.
Диабетическая нейропатия характеризуется многообразием клинических форм. Нейропатические синдромы диабета классифицируются следующим образом:
- генерализованные симметричные полинейропатии:
- ДПН (хроническая сенсомоторная полинейропатия или дистальная симметричная полинейропатия): нейропатия малых волокон; нейропатия крупных волокон;
- диабетическая вегетативная нейропатия (автономная полинейропатия);
- острая сенсорная полинейропатия;
- фокальные и мультифокальные нейропатии:
- очаговая конечностная нейропатия (в том числе туннельные синдромы);
- нейропатия черепных нервов;
- стволовая радикулонейропатия;
- проксимальная моторная нейропатия;
- быстро обратимая лекарственно-индуцированная нейропатия.
В ряде случаев одновременно наблюдается несколько форм нейропатий.
По мнению экспертов международного консенсуса по терапии СД, ДПН – симметричная дистальная сенсомоторная полинейропатия, связанная с метаболическими и микрососудистыми изменениями в результате хронического воздействия гипергликемии и факторов сердечно-сосудистого риска. При ДПН выраженность клинической симптоматики часто не коррелирует с тяжестью аксонального поражения.
Следует отметить, что у пациентов с СД 1-го и 2-го типов факторы риска развития неврологических осложнений абсолютно разные. При СД 1-го типа ведущим фактором риска развития ДПН является гипергликемия. При СД 2-го типа на первый план выходят ожирение, гипертриглицеридемия, гиперхолестеринемия, гипертензия, курение и только потом гипергликемия.
Диагностика диабетических нейропатических синдромов прежде всего включает определение клинического статуса: наличие двух или более признаков, таких как симметричное изменение дистальной чувствительности (болевой, температурной, вибрационной, тактильной), «позитивные» сенсорные симптомы – боль, снижение или отсутствие ахиллова рефлекса. Различают два подтипа ДПН – с поражением больших и малых волокон. Они различаются не только клиническими проявлениями, но и методами инструментальной диагностики. При поражении больших волокон применяют электронейромиографию, при малых – биопсию кожи с оценкой плотности интраэпидермальных нервных волокон, корнеальную конфокальную микроскопию, контрактные тепловые вызванные потенциалы, пластырь для функциональной оценки иннервации потовых желез.
С точки зрения диагностики ДПН крайне важно, во-первых, валидизировать симптомы, а во-вторых, выявить их на ранней стадии манифестации заболевания. Для этого существует ряд опросников, в частности Мичиганский опросник скрининга нейропатии (MNSI). Использование валидизированных шкал опросников позволяет оценить выраженность полинейропатии в баллах и верифицировать диагноз.
В ходе дифференциальной диагностики не следует забывать о базовых тестах. Речь прежде всего идет об определении уровня глюкозы или гликированного гемоглобина (при нормальных показателях используется тест толерантности к глюкозе), содержания витамина В12. Часто дефицит витамина В12 имеет ятрогенный генез, связан с кумулятивными дозами метформина. Парапротеинемическая полинейропатия занимает третье место в ряду всех полинейропатий и синдромов. Поэтому проведение электрофореза и иммунофиксация белков сыворотки крови служат важным дифференциально-диагностическим тестом.
Среди автономных нейропатий кардиоваскулярная автономная нейропатия (КАН) в большей степени связана с фатальными событиями. В то же время ее трудно выявить при рутинном неврологическом осмотре. Проявления КАН – тахикардия покоя, вариабельность сердечного ритма, ортостатическая гипотензия, злокачественная аритмия или внезапная смерть. На фоне КАН повышается риск инфаркта, инсульта, смерти.
В рекомендациях Американской диабетической ассоциации (ADA) по диагностике КАН указаны симптомы и признаки КАН, которые необходимо оценивать у пациентов с микрососудистыми и нейропатическими осложнениями (нейропатия, нефропатия, ретинопатия) и пациентов, не осведомленных о своей гипогликемии. При наличии симптомов КАН выполняются тесты, исключающие другие сопутствующие заболевания или эффекты/взаимодействия лекарственных средств, которые могут имитировать КАН. Золотым стандартом диагностики КАН признаны электрокардиографический мониторинг, постуральные пробы: измерение частоты сердечных сокращений (ЧСС), ЧСС при глубоком дыхании, в положении стоя, при маневре Вальсальвы. При изменении одного показателя дополнительно оцениваются остальные. Если остальные значения в норме, у пациента диагностируется вероятная или ранняя КАН. Изменения двух показателей позволяют установить окончательный или подтвержденный диагноз КАН.
По словам докладчика, ведение пациента с КАН требует комбинированного подхода с участием смежных специалистов – кардиологов, неврологов и эндокринологов.
Базовые принципы лечения ДПН основаны на использовании патогенетической терапии, купировании симптомов, улучшении качества жизни пациентов, предотвращении прогрессирования и лечении осложнений, прежде всего синдрома диабетической стопы. У больных СД важно своевременно диагностировать диабетическую стопу. Периодический осмотр стоп является одним из обязательных правил ведения пациентов с СД и позволяет выявить проблему на ранней стадии. Прежде всего необходимо фиксировать изменения чувствительности стопы с помощью простого теста «на шесть прикосновений».
Патогенетическое лечение ДПН предусматривает коррекцию не только уровня глюкозы, но и факторов риска диабетических нейропатий. Это терапия ожирения, дислипидемии, гипертензии. Диета и физические упражнения способны предотвратить развитие диабетической нейропатии, замедлить ее прогрессирование и восстановить регенерацию нервных волокон.
В настоящее время известны препараты с доказанной клинической эффективностью для лечения заболеваний периферической нервной системы при СД. Среди них – альфа-липоевая кислота (АЛК), бенфотиамин, гамма-линоленовая кислота.
Тиоктовая кислота – антиоксидант прямого и непрямого действия является незаменимым препаратом для патогенетического лечения ДПН. Она считается мощным перехватчиком свободных радикалов, улучшает кровоснабжение нерва, оказывает нейропротективное и нейротрофическое действие, подавляет активацию ядерного фактора воспаления NF-kB. Эффективность и безопасность применения АЛК при ДПН доказаны в многочисленных многоцентровых плацебоконтролируемых исследованиях.
По данным исследования SYDNEY II, внутривенное введение АЛК вызывает достоверное снижение нейропатических симптомов ДПН и неврологической объективной симптоматики10. В исследовании ALADIN I клиническое улучшение у больных ДПН на фоне АЛК начиналось уже с пятого дня терапии и постепенно нарастало. Доза 600 мг признана оптимальной в аспекте эффективности терапии и минимальной частоты развития побочных эффектов. По мнению исследователей, АЛК необходимо назначать как можно раньше, на доклинической стадии, поскольку она способна предотвратить развитие полинейропатии11. Препараты АЛК применяются и в целях профилактики диабетической стопы.
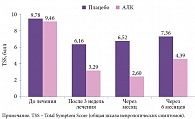
При внутривенном введении АЛК в дозе 600 мг/сут 14–15 инфузий продолжительность эффекта составляет не менее полугода. При этом АЛК целесообразно применять на протяжении 2–6 месяцев (рис. 2).
Берлитион, содержащий молекулу АЛК, обладает плейотропным действием, является антиоксидантом прямого и непрямого действия. По характеру биохимического действия Берлитион близок к витаминам группы В. Препарат вызывает стойкий положительный эффект при купировании нейропатических синдромов. Инфузионная терапия Берлитионом приводит к значительному снижению выраженности позитивных (боль, жжение, парестезии) и негативных (онемение, гипостезия) симптомов ДПН. В ходе исследований установлено, что более длительный внутривенный капельный курс препаратом в дозе 600 мг/сут (до 20 дней) эффективнее короткого курса (10 дней) в снижении выраженности симптомов ДПН12.
Интересно, что в ряде исследований продемонстрирована способность АЛК уменьшать выраженность болевого синдрома при ДПН. Берлитион снижает болевой синдром за счет улучшения состояния периферических нервных волокон, относящихся к соматосенсорной системе. АЛК может модулировать Т-тип кальциевых каналов, что изменяет болевую импульсацию13.
В исследованиях оценивали эффективность АЛК при пероральном приеме14. Эффективность ступенчатой и пероральной терапии Берлитионом сопоставима, но в первом случае анальгетический эффект наступает на неделю раньше.
Показано, что прием АЛК 300 мг три раза в сутки сопровождается достоверно большим снижением выраженности неврологической симптоматики. Частота ее рецидивов не зависит от предшествующей схемы назначения АЛК, а определяется исходным уровнем гликированного гемоглобина15.
Как отметил докладчик, во время пандемии коронавируса особую актуальность приобретают исследования эффективности и безопасности препаратов у пациентов с COVID-19. В рандомизированном исследовании эффективности и безопасности АЛК у пациентов в критическом состоянии с COVID-19 АЛК ассоциировалась со снижением риска смерти от всех причин16.
Механизмы действия АЛК при коронавирусной инфекции достаточно разнообразны и требуют дальнейшего изучения. Известно, что АЛК может проявлять противовирусный эффект за счет снижения активации NF-kB и облегчения окислительно-восстановительных реакций. Практические результаты наблюдений свидетельствуют о том, что применение АЛК оправданно у пациентов с коронавирусной инфекцией, особенно при СД 2-го типа.
Среди других причин смерти пациентов с СД особое внимание следует уделять нарушению мозгового кровообращения. При СД возможно развитие не только полинейропатии, но и нарушений центральной нервной системы. Неврологи иногда упускают из виду этот факт. Между тем поражения центральной нервной системы лежат в основе увеличения смертности при COVID-19.
Результаты французского многоцентрового наблюдательного исследования с участием пациентов с СД, госпитализированных с COVID-19, показали, что микро- и макрососудистые осложнения диабета относятся к независимым факторам риска смерти на седьмой день заболевания17.
Таким образом, для лечения цереброваскулярной болезни следует применять корректоры макро- и микроангиопатии, в частности дипиридамол (Курантил N). Дипиридамол – непрямой агонист, который ингибирует фосфодиэстеразу, оказывает влияние на распад и накопление аденозина. Дипиридамол относится к препаратам, влияющим на пуринергическую систему (систему кондиционирования).
У пациентов с СД Курантил N уменьшает окислительный стресс, воспаление в эндотелии сосудов, благоприятно влияет на реологические свойства крови, расширяет сосуды, увеличивает образование и биодоступность оксида азота в ткани. Кроме того, доказана эффективность дипиридамола в сочетании с ацетилсалициловой кислотой в целях профилактики сосудистых осложнений после некардиоэмболического ишемического инсульта и транзиторной ишемической атаки. Эффективность комбинированной терапии «дипиридамол + ацетилсалициловая кислота» превышает таковую монотерапии ацетилсалициловой кислотой при вторичной профилактике инсульта18, 19.
В заключение профессор Д.А. Искра подчеркнул, что в лечении пациентов с ДПН необходимо использовать препараты с доказанной терапевтической эффективностью, плейотропным действием, особенно при осложнениях со стороны периферической или центральной нервной системы на фоне COVID-19.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.