Возможности комбинированного скрининга с ADAM-12 в прогнозировании преэклампсии
- Аннотация
- Статья
- Ссылки
- English
Цель – повысить эффективность скрининга ПЭ за счет изучения клинико-лабораторных данных, материнских анамнестических факторов и показателей инструментального исследования.
Материал и методы. Проанализированы показатели PIGF, ADAM-12, PAPP-A, хорионического гонадотропина человека и пульсационного индекса (ПИ) маточных артерий на сроке 11–14 недель гестации у 180 пациенток, наблюдавшихся в женской консультации на базе Павлово-Посадской больницы. До родов проводились проспективное наблюдение и обследование в соответствии с действующими клиническими рекомендациями. После родоразрешения 19 женщин с поздней умеренной ПЭ были включены в основную группу, 38 женщин, отобранных случайным образом, – в контрольную. Результаты обрабатывали в программе StatTech 4.8.0.
Результаты. На основании проанализированных клинико-анамнестических данных выделены наиболее значимые материнские анамнестические предикторы ПЭ: возраст старше 28 лет (p = 0,0015), средний уровень артериального давления > 90 мм рт. ст. (p = 0,001), индекс массы тела > 28,3 кг/м2 (p < 0,001), ПЭ в предыдущих родах (p = 0,038), нарушения менструального цикла в анамнезе (p = 0,049), артериальная гипертензия (p = 0,021) и инсулинорезистентность (p = 0,004). Показана прогностическая ценность ADAM-12 в прогнозировании ПЭ при уровне выше 1,6 нг/мл при 10,5% ложноположительных результатов (p = 0,004). Подтверждена эффективность определения PIGF и ПИ маточных артерий (p < 0,001 и p = 0,028 соответственно). Предложена модель комбинированного скрининга на основании PIGF, ADAM-12 и ПИ маточных артерий на сроке 11–14 недель и выявления факторов риска для прогнозирования поздней умеренной ПЭ с чувствительностью и специфичностью 100 и 94,7% соответственно (p < 0,001).
Заключение. Определение ADAM-12 и PIGF в сочетании с ПИ маточных артерий и факторами риска в рамках первого антенатального скрининга имеет более высокую чувствительность для предикции ПЭ по сравнению с моделью без ADAM-12. Данный метод может быть внедрен в практику после изучения на большей выборке.
Цель – повысить эффективность скрининга ПЭ за счет изучения клинико-лабораторных данных, материнских анамнестических факторов и показателей инструментального исследования.
Материал и методы. Проанализированы показатели PIGF, ADAM-12, PAPP-A, хорионического гонадотропина человека и пульсационного индекса (ПИ) маточных артерий на сроке 11–14 недель гестации у 180 пациенток, наблюдавшихся в женской консультации на базе Павлово-Посадской больницы. До родов проводились проспективное наблюдение и обследование в соответствии с действующими клиническими рекомендациями. После родоразрешения 19 женщин с поздней умеренной ПЭ были включены в основную группу, 38 женщин, отобранных случайным образом, – в контрольную. Результаты обрабатывали в программе StatTech 4.8.0.
Результаты. На основании проанализированных клинико-анамнестических данных выделены наиболее значимые материнские анамнестические предикторы ПЭ: возраст старше 28 лет (p = 0,0015), средний уровень артериального давления > 90 мм рт. ст. (p = 0,001), индекс массы тела > 28,3 кг/м2 (p < 0,001), ПЭ в предыдущих родах (p = 0,038), нарушения менструального цикла в анамнезе (p = 0,049), артериальная гипертензия (p = 0,021) и инсулинорезистентность (p = 0,004). Показана прогностическая ценность ADAM-12 в прогнозировании ПЭ при уровне выше 1,6 нг/мл при 10,5% ложноположительных результатов (p = 0,004). Подтверждена эффективность определения PIGF и ПИ маточных артерий (p < 0,001 и p = 0,028 соответственно). Предложена модель комбинированного скрининга на основании PIGF, ADAM-12 и ПИ маточных артерий на сроке 11–14 недель и выявления факторов риска для прогнозирования поздней умеренной ПЭ с чувствительностью и специфичностью 100 и 94,7% соответственно (p < 0,001).
Заключение. Определение ADAM-12 и PIGF в сочетании с ПИ маточных артерий и факторами риска в рамках первого антенатального скрининга имеет более высокую чувствительность для предикции ПЭ по сравнению с моделью без ADAM-12. Данный метод может быть внедрен в практику после изучения на большей выборке.

Введение
Преэклампсия (ПЭ) – комплексное мультисистемное осложнение беременности, ассоциированное с повышением артериального давления (АД), потерей белка c мочой и полиорганной материнской дисфункцией [1].
Распространенность ПЭ в мире варьируется от 3 до 5% [2]. Опасения вызывают не только высокие показатели материнской и младенческой смертности, но также краткосрочные и долгосрочные последствия развития ПЭ, влияющие на состояние здоровья матери и ребенка. Речь, в частности, идет о более высоком риске развития заболеваний сердечно-сосудистой системы, почек, неврологической патологии и нарушения обмена веществ [3].
ПЭ определяют как диагностированную после 20 недель гестации артериальную гипертензию в сочетании с протеинурией либо другим проявлением нарушения функции органов или систем [4].
Единственным методом лечения ПЭ остается досрочное родоразрешение. Однако следует учитывать, что данное осложнение может развиться не только во время беременности, но также во время родов и в послеродовом периоде [5].
Этиопатогенез ПЭ до конца не изучен, но первостепенная роль, по данным ряда исследователей, отводится плацентарным нарушениям и окислительному стрессу c последующим системным эндотелиозом и прогрессирующей эндотелиальной дисфунцией. Классический каскад патологических нарушений при ПЭ описывают аномальной плацентацией в первом триместре беременности и преобладанием антиангиогенных факторов над ангиогенными начиная со второго триместра, что приводит к возникновению клинических материнских симптомов [6]. Как известно, чем раньше развивается ПЭ, тем она тяжелее поддается терапии и тем чаще сопряжена с неблагоприятным исходом [7].
На основании изученных биологических веществ – участников патогенеза ведется поиск потенциальных предикторов. Калькуляция рисков развития ПЭ базируется на определении на сроке 11–14 недель гестации уровня плацентарного фактора роста (PIGF), пульсационного индекса (ПИ) маточных артерий и материнских анамнестических факторов [8]. Данная модель характеризуется высокими показателями специфичности и чувствительности для прогнозирования ранней ПЭ [9] и используется во многих странах, в том числе в России.
Учитывая ограниченную доступность скрининга и необходимость раннего начала профилактических мероприятий, таких как прием ацетилсалициловой кислоты при своевременном выявлении группы риска, следует продолжать поиск эффективных предикторов для снижения заболеваемости и смертности от ПЭ и уменьшения акушерских рисков, в частности преждевременных родов, недоношенности и отдаленных последствий.
Материал и методы
В исследовании участвовали 180 беременных, состоявших на учете в женской консультации Павлово-Посадской больницы и подписавших добровольное информированное согласие (ДИС).
После родоразрешения пациентки были разделены на две группы в зависимости от факта развития ПЭ. В основную группу вошли 19 женщин с поздней умеренной ПЭ (ранней или тяжелой ПЭ за период наблюдения не зафиксировано), в контрольную – 38 женщин с физиологическим течением беременности, отобранных случайным образом.
Критериями для постановки диагноза ПЭ служили повышенный уровень АД ≥ 140/90 мм рт. ст., протеинурия ≥ 0,3 г/сут либо в двух порциях мочи с шестичасовым интервалом или любое проявление полиорганной недостаточности [1].
В основную группу включались подписавшие ДИС совершеннолетние с одноплодной беременностью без рисков хромосомных аномалий плода по данным первого скрининга.
Из исследования исключались не подписавшие ДИС пациентки с многоплодной беременностью и выявленными пороками плода.
На сроке 11–14 недель гестации осуществлялся забор крови для определения уровней PIGF и ADAM-12 методом иммуноферментного анализа, а также измерялся ПИ маточных артерий. Далее проводилось проспективное наблюдение.
Изучались анамнез, данные физикального и инструментального обследований для поиска потенциальных предикторов. Обработка и анализ полученных результатов осуществлялись с помощью программного обеспечения StatTech v. 4.8.0.
Для отбора предикторов использовались ROC-анализ и корреляционный анализ. Для комбинации наиболее значимых факторов была построена регрессионная модель.
Исследование, одобренное Межвузовским комитетом по этике (протокол № 06-19 от 13 июня 2019 г.), выполнено с соблюдением этических норм.
Результаты и обсуждение
Мы провели ROC-анализ и получили следующие статистически значимые предикторы по данным обьективного исследования: возраст старше 28 лет, индекс массы тела (ИМТ) > 28,3 кг/м2 и средний уровень АД > 90 мм рт. ст. (р = 0,0015, р < 0,001, p = 0,001 соответственно).
Изучив акушерско-гинекологический анамнез, мы выявили, что вероятность развития ПЭ у пациенток с ПЭ в анамнезе выше в 9,867 раза (95%-ный доверительный интервал (ДИ) 1,017–95,690), а при нарушениях менструального цикла в анамнезе – в 3,879 раза (95% ДИ 1,099–13,686).
При анализе экстрагенитальной патологии получены данные об увеличении в 4,8 раза (95% ДИ 1,296–17,776) риска развития ПЭ у пациенток с артериальной гипертензией в анамнезе. Кроме того, статистически значимые отличия получены при выявлении инсулинорезистентности в анамнезе: вероятность развития ПЭ у пациенток с ее наличием в анамнезе в 8,485 раза выше, чем у женщин без инсулинорезистентности в анамнезе. Различия статистически значимы (95% ДИ 1,913–37,642).
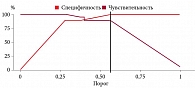
При сравнении уровней биомаркеров выявлены достоверно более высокие значения ADAM-12 в группе с ПЭ (p = 0,004). По данному показателю проведен ROC-анализ. При уровне ADAM-12 > 1,6 нг/мл можно прогнозировать ПЭ с чувствительностью 57,9% и специфичностью 89,5%.
Кроме того, выполнен корреляционный анализ для установления наличия связи наиболее достоверных предикторов с ADAM-12. Обнаружена умеренной тесноты прямая связь ADAM-12 и ИМТ. При повышении ИМТ на 1 кг/м2 следует ожидать увеличения ADAM-12 на 0,033 нг/мл. Установлена также слабой тесноты прямая связь ADAM-12 и среднего уровня АД. При повышении уровня последнего на 1 мм рт. ст. следует ожидать увеличения ADAM-12 на 0,015 нг/мл.
Подтверждена прогностическая ценность PIGF [10]. В группе с последующим развитием ПЭ этот биомаркер показал достоверно более низкие результаты, чем в контрольной группе, – 29,35 ± 10,90 и 43,49 ± 12,91 нг/мл соответственно (p < 0,001). По данным ROC-анализа прогнозировать ПЭ можно при значении PIGF < 39 нг/мл с чувствительностью 73,7% и специфичностью 76,3%.
Мы оценили значения ПИ маточных артерий по данным допплерометрии на сроке 11–14 недель и получили более низкие показатели в контрольной группе. С помощью ROC-анализа мы отмечали точку отсечения 1,9. При значении ПИ ≥ 1,9 чувствительность и специфичность метода составляют 68,4 и 68,4% соответственно.
Таким образом, были отобраны следующие предикторы для построения комбинированной модели скрининга ПЭ (рис. 1):
- обьективные данные: ИМТ, возраст, средний уровень АД;
- анамнестические данные: ПЭ и нарушения менструального цикла в анамнезе, инсулинорезистентность, артериальная гипертензия;
- уровни PIGF и ADAM-12 на сроке 11–14 недель;
- ПИ маточных артерий.
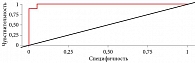
Получена регрессионная модель предикции поздней умеренной ПЭ (p < 0,001), псевдо-R² Нагелькерке 100%. Для оценки дискриминационной способности регрессионной модели проведен ROC-анализ (рис. 2). Оценка вероятности p показала статистическую значимость для прогнозирования ПЭ (AUC = 0,994; 95% ДИ 0,971–1,000; p < 0,001) (рис. 3). Чувствительность полученной прогностической модели – 100%, специфичность – 94,7%.
Заключение
Результаты настоящего исследования показали прогностическую ценность комбинированного скрининга с ADAM-12 для предикции поздней умеренной ПЭ.
При выявлении беременных группы риска по данным объективного статуса, имеющих анамнестические факторы риска, рекомендуется комбинированное определение PIGF и ADAM-12, а также ПИ для расчета вероятности развития ПЭ.
Пациенткам с высокой вероятностью развития ПЭ необходимо в профилактических целях назначать препараты ацетилсалициловой кислоты [11].
Учитывая отсутствие эффективных терапевтических направлений в отношении ПЭ и эклампсии, основные усилия следует направить на проведение доступного скрининга для своевременного выявления когорты беременных, нуждающихся в более углубленном мониторинге, и принятия превентивных мер.
Предложенная комбинированная модель, продемонстрировавшая высокую чувствительность для прогноза поздней умеренной ПЭ, в дальнейшем может быть внедрена в практику. С учетом небольшого количества наблюдений, ограничившего наше исследование, дальнейшее изучение вопроса целесообразно продолжить с привлечением большей выборки.
Авторы заявляют об отсутствии конфликта интересов
L.V. Khrushch, Ye.I. Manukhina, PhD, Prof.
Russian University of Medicine
Pavlovo-Posad Hospital
Contact person: Lyudmila V. Khrushch, dr.khrushch@yandex.ru
Relevance. One of the major challenges of modern obstetrics remains preeclampsia and eclampsia. World statistics on the mortality accompanying this pathology show minor improvements. However, this applies mainly to developed countries due to higher screening coverage and the use of acetylsalicylic acid in the high-risk group of preeclampsia. Studies of the etiopathogenesis of this disease, its epigenomics in accordance with various types of clinical course are ongoing to identify new effective predictors for predicting preeclampsia. Combination of biomarkers combined with maternal factors and uterine artery Dopplerometry scores show the best results.
The aim is to increase the effectiveness of screening for preeclampsia by studying clinical and laboratory data, maternal anamnestic factors and instrumental study indicators.
Material and methods. PIGF, ADAM-12, PAPP-A, hCG and PI of uterine arteries at 11–14 weeks of pregnancy in 180 patients observed in the antenatal clinic at Pavlovo-Posad Hospital were analyzed. Prior to delivery, prospective follow-up and examination were performed in accordance with current guidelines. After delivery, 19 women with late moderate preeclampsia were assigned to the main group and 38 women made up the control group by random sampling. The results were processed in StatTech 4.8.0.
Results. Clinical and anamnestic data were analyzed and the most significant maternal anamnestic predictors of preeclampsia were identified: age over 28 years (p = 0.0015), MAP level above 90 mm Hg (p = 0.001), BMI value above 28.3 kg/m2 (p < 0.001), preeclampsia at previous birth (p = 0.038), disorders history of menstrual cycle (p = 0.049), hypertension (p = 0.021) and insulin resistance (p = 0.004). The prognostic value of ADAM-12 for predicting preeclampsia at a level above 1.6 ng/ml with 10.5% false positive results is shown, p = 0.004. The effectiveness of PIGF and PI of the uterine arteries, p < 0.001 and p = 0.05, respectively, was confirmed. A combined screening model is proposed based on determination of PIGF, ADAM-12 and PI of uterine arteries at 11–14 weeks and detection of risk factors for prediction of late moderate preeclampsia with sensitivity and specificity of 100 and 94.7%, respectively, p < 0.001.
Conclusion. The combined definition of ADAM-12 and PIGF combined with uterine artery PI and risk factors within the first antenatal screening has a higher sensitivity for the prediction of preeclampsia compared to the non-ADAM-12 model. This method can be introduced into practice after studying on a larger number of patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.