Нитрофураны в терапии неосложненных инфекций мочевых путей
- Аннотация
- Статья
- Ссылки
В настоящее время неосложненные ИМП и их самая распространенная нозологическая форма – острый цистит (ОЦ) – относятся к наиболее частым инфекционным заболеваниям, встречающимся в амбулаторной врачебной практике и требующим адекватной антибактериальной терапии (АБТ). Женщины наиболее подвержены заболеванию, что объясняется анатомическими особенностями строения их урогенитального тракта. По современным данным, каждая вторая женщина хотя бы раз в жизни переносит ОЦ, а заболеваемость последним составляет 0,5-0,7 случаев на одну женщину в год (1, 2). В России ежегодно регистрируется до 36 млн случаев ОЦ в год, а в США женщинам с ИМП ежегодно выписывается приблизительно 11,3 млн рецептов с общими затратами на лечение до 1,6 млрд долл. США (3, 4).
Микробный пейзаж неосложненных ИМП в 70-95% случаев представлен E. coli, в остальных случаях возбудителями являются другие представители энтеробактерий (клебсиелла, протей) или грамположительные бактерии Staphylococcus spp., Enterococcus spp. (1, 5-7). Именно такое безусловное доминирование кишечной палочки в этиологической структуре неосложненных ИМП и оправдывает ссылки исследователей на чувствительность именно этого патогена при обосновании выбора АМП для терапии.
Долгое время ко-тримоксазол оставался препаратом выбора для терапии неосложненных ИМП, однако на протяжении последнего десятилетия за рубежом и в России отмечается чрезвычайно высокий уровень устойчивости основных уропатогенов к этому препарату, что зачастую делает невозможным дальнейшее его эмпирическое использование при данной патологии. Другой мировой современной тенденцией является рост резистентности возбудителей ИМП к фторхинолонам и ингибиторозащищенным пенициллинам, связанный с их повсеместным и широким использованием в клинической практике (5, 6, 7, 8, 9). Последнее обстоятельство заставило клиницистов, клинических микробиологов и фармакологов искать выход из сложившейся ситуации и, исходя из актуальной необходимости сохранения активности фторхинолонов, обратить внимание на класс АМП группы производных нитрофурана (10, 11).
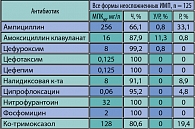
Возбудители неосложненных имп и их устойчивость к АМП
С 1998 г. в НИИ антимикробной химиотерапии ГОУ ВПО «Смоленская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию» и Научно-методическом центре по мониторингу антибиотикорезистентности Федерального агентства по здравоохранению и социальному развитию проводят исследования этиологической структуры и динамики устойчивости к АМП возбудителей ИМП. В одном из последних опубликованных исследований изучена резистентность 1064 штаммов возбудителей, полученных от пациентов с неосложненными ИМП из 12 крупных российских городов Центрального, Северо-Западного, Южного, Приволжского, Уральского и Сибирского федеральных округов.
Следуя известной особенности более медленного формирования устойчивости возбудителей инфекций к антибиотикам в России, резистентность кишечной палочки к ко-тримоксазолу и незащищенным аминопенициллинам при неосложненных ИМП достаточно высока (19,4 и 33,9% соответственно), но все-таки несколько отстает от общемировых показателей. Наиболее активными в отношении E. coli по состоянию на 2006 г. являлись фторхинолоны, ЦС II-IV поколения, фосфомицин и нитрофурантоин (см. таблицу) (8).
Важной для рассмотрения является динамика резистентности кишечной палочки в разные годы исследований в период с 1998 по 2006 гг. Так, устойчивость этого микроорганизма к налидиксовой кислоте и ципрофлоксацину в указанный период времени достоверно увеличилась с 5,5 до 8,9% и с 2,2 до 4,8% соответственно, а чувствительность к нитрофурантоину в разные годы исследования не превышала 1,4%.
Данные по России, полученные в панъевропейском многоцентровом исследовании возбудителей ИМП ARESC, указывают на резистентность кишечной палочки к цефуроксиму и ципрофлоксацину в 14,3% и 13,6% соответственно, в то время как устойчивость к нитрофурантоину и фосфомицину остается на низком уровне в 5,3% и 0,6% (6).
Значительный ознакомительный и прогностический интерес представляют и данные, полученные в Северной Америке (США и Канада). Во время исследования NAUTICA была изучена резистентность 1142 штаммов кишечной палочки, наиболее активными препаратами в отношении которой оказались нитрофурантоин и фторхинолоны с показателями чувствительности 98,9% и 94,5% соответственно. Активность же ампициллина и ко-тримоксазола составила соответственно 62,3% и 81,7% (5).
Другие авторы, исследовав чувствительность 59653 штаммов E.coli, выделенных из мочевых путей амбулаторных пациенток в США в 1995 и 2001 гг., отметили ципрофлоксацин как единственный препарат, резистентность к которому достоверно выросла в указанный период более чем в три раза (с 0,7 до 2,5%) (12).
В тоже время резистентность кишечной палочки к фосфомицину и нитрофурантоину во всем мире редко превышает 5% и незначительно меняется со временем, что заставляет предположить особые механизмы действия препаратов, препятствующие развитию резистентности, а также предрасполагают к более пристальному вниманию в отношении указанных АМП в качестве выбора последних для терапии неосложненных ИМП (10, 11).
Производные нитрофурана и их место в терапии неосложненных ИМП
Нитрофураны являются синтетическими АМП, известными уже более 65 лет. Примечательно, что приоритет разработки оригинальных препаратов данного класса во многом принадлежит советским ученым, работавшим тогда в Институте органического синтеза АН Латвии вплоть до конца 1980-х годов.
Механизм действия производных нитрофурана во многом уникален и заключается в угнетении клеточного дыхания, что препятствует образованию энергии, необходимой для роста и размножения бактерий. Подобный механизм действия и отсутствие селективного влияния на определенные ферментные системы роднит эти АМП с антисептиками, коими и являются некоторые производные нитрофурана (фурацилин) (13, 14, 15).
Первыми нитрофурановыми АМП стали нитрофурантоин (Фурадонин), синтезированный в США в 1952 г. и фуразидин (Фурагин), синтезированный в Латвии в 1954 г. Препараты обладали относительно низкой токсичностью, что сделало возможным их системное применение, а механизм антимикробного действия наделил их важными в будущем преимуществами, заключающимися в медленном росте резистентности возбудителей и отсутствии перекрестной устойчивости с другими классами АМП. Отражением этого является низкий и практически не меняющийся со временем уровень устойчивости кишечной палочки и некоторых грамположительных возбудителей неосложненных ИМП к нитрофурантоину.
Сравнительно редкому использованию при терапии ИМП производные нитрофурана обязаны появлением на рынке первых нефторированных хинолонов (налидиксовой кислоты) в начале 60-х годов прошлого столетия, а затем и фторхинолонов в начале 80-х. Хинолоны, а тем более фторхинолоны обладали по сравнению с нитрофуранами массой преимуществ, включая значительно большую активность (МПК90 ципрофлоксацина, налидиксовой кислоты и нитрофурантоина для E. coli составляют соответственно 0,06, 8,0 и 32,0 мг/л), лучшие фармакокинетические характеристики (достижение бактерицидных концентраций не только в моче, но в сыворотке и тканях) и высокие показатели безопасности, связанные в том числе и с более короткими курсами терапии. Однако, несмотря на это, все ведущие отечественные и мировые рекомендации включали и включают нитрофурантоин в качестве препарата второго ряда для терапии неосложенных ИМП (1, 7).
Необходимо подчеркнуть, что работы по улучшению активности, фармакокинетических показателей и показателей безопасности нитрофуранов велись со дня появления их первых представителей. Для нитрофурантоина была предложена макрокристаллическая форма, которая медленнее всасывается и лучше переносится, для фуразидина вначале была синтезирована его калиевая соль, отличающаяся лучшей растворимостью, а затем был разработан комбинированный препарат, включающий калиевую соль фуразидина и карбонат магния основной (Фурамаг), что еще более увеличило растворимость и биодоступность активного компонента, улучшило его фармакокинетику и переносимость терапии.
Сравнительные исследования показали значительные преимущества Фурамага по сравнению с обычным фуразидином, выражавшиеся в лучшей биодоступности (большей в среднем в 2,5-3 раза), создании и сохранении более высоких концентраций (в среднем в 3 раза) в моче после приема аналогичных доз. Так, при однократном приеме 100 мг калиевой соли фуразидина концентрация его в моче в течение интервала дозирования (8 часов) колеблется в пределах 18-28 мг/л (16, 17). Сегодня установлено, что среднегеометрические значения МПК фуразидина в отношении грамположительных микроорганизмов в 3 раза ниже, а в отношении грамотрицательных возбудителей в 7-10 раз ниже, чем у нитрофурантоина, что свидетельствует о значительно более высокой активности первого препарата. Предложенные недавно отечественными авторами предварительные критерии интерпретации чувствительности возбудителей к фуразидину равны его концентрации 16,0 мг/л, промежуточного уровня чувствительности – 32,0 мг/л и устойчивости – 64,0 мг/л, отмечается тем не менее необходимость проведения дальнейших исследований в этой области (18).
Таким образом, создание лекарственных форм нитрофуранов с улучшенной фармакокинетикой нивелирует, в известной степени, недостатки изначально предложенных препаратов, отличавшихся плохой растворимостью, низкой биодоступностью и трудностями в создании и поддержании эффективных концентраций в моче.
Логично, что наибольшее количество сравнительных исследований эффективности и безопасности производных нитрофурана в терапии неосложненных ИМП было проведено в 1980-90-х гг. Тогда была показана примерно равная эффективность и безопасность терапии нитрофурантоином в сравнении с фосфомицином, триметопримом, ко-тримоксазолом (19, 20, 21, 22). Единственной разницей режимов сравнения являлась длительность назначения АМП, равнявшаяся в среднем 7 дням для групп пациентов, получавших производное нитрофурана. Однако некоторые исследования показали достаточную клиническую и микробиологическую эффективность и более коротких 3-дневных курсов терапии препаратами нитрофуранов с улучшенной фармакокинетикой (23).
Повышение внимания к нитрофуранам в качестве альтернативных препаратов выбора для терапии неосложненных ИМП в свете роста резистентности уропатогенов к фторхинолонам явилось стимулом к возобновлению сравнительных исследований эффективности и безопасности терапии неосложненных ИМП нитрофурановыми АМП с улучшенной фармакокинетикой (24). Некоторые авторы отмечают сходную эффективность 3-дневных курсов ципрофлоксацина и 7-дневных нитрофурантоина при лечении этой патологии (25, 26).
Определенный интерес представляет отечественное исследование клинической и бактериологической эффективности 5- и 7-дневных курсов терапии ОЦ комплексным препаратом калиевой соли фуразидина и магния карбоната основного (Фурамаг) у 105 пациенток. Авторы отмечают сходную высокую клиническую эффективность обеих режимов применения АМП (равную 96,3% и 96,1% соответственно). Бактериологическая эрадикация была достигнута в 93,9% и 97,1%, а нежелательные лекарственные явления отмечены в 3,7% и 5,9% случаев соответственно (27).
Известно, что в деле формирования резистентности возбудителей основную роль играет селективное давление АМП, зависящее в первую очередь от интенсивности и рациональности использования того или иного препарата. Решая вопросы, связанные с терапией ИМП, не следует забывать и о профилактическом применении АМП в урологии. Один из аспектов антибактериальной профилактики (АБП) касается длительного назначения АМП пациентам с рецидивирующими ИМП, в то же время совсем нередкие в урологической практике инвазивные трансуретральные манипуляции у пациентов с факторами риска также должны сопровождаться профилактическим назначением АМП для предупреждения развития инфекционных осложнений.
У 20-30% женщин с неосложненными ИМП наблюдаются рецидивы данного заболевания, определяемые как три эпизода ИМП в год или два эпизода ИМП за полгода (28). В многочисленных исследованиях показана эффективность АБП для снижения частоты рецидивов ИМП в 8 и 5 раз по сравнению с периодом до начала профилактики и по сравнению с плацебо соответственно (1). Европейское общество урологов рекомендует с этой целью длительный (6 месяцев) или однократный прием после полового акта (у пациенток, обострения ИМП у которых связаны с сексуальной активностью) ко-тримоксазола, нитрофурантоина или фосфомицина (для последнего предлагается режим однократного приема с интервалом 10 дней). Популярный стереотип мнения о плохой переносимости производных нитрофуранов не подтверждается результатами ряда качественных клинических исследований, продемонстрировавших низкую частоту нежелательных лекарственных явлений при соблюдении режима приема АМП (29, 30). На этом фоне использование комплексного препарата калиевой соли фуразидина и магния карбоната основного (Фурамаг) может быть еще более безопасным, так как его токсичность в 2,4-3,6 раза ниже, чем у нитрофурантоина (31, 32, 35).
Заключение
Подводя итог вышесказанному, можно констатировать, что в эру антибактериальной резистентности крайне важным представляется необходимость сохранения активности некоторых жизненно важных препаратов, таких, например, как фторхинолоны. Известно, что снижение потребления определенных антибиотиков сопровождается закономерным ростом чувствительности к ним патогенов (36), поэтому сегодня как никогда возрастает необходимость в эффективных препаратах, имеющих направленный спектр активности и соответствующих показаний к применению. К таким препаратам, несомненно, относятся производные нитрофурана, интерес к которым еще более обоснован появлением лекарственных форм с улучшенной фармакокинетикой. По неспецифическому механизму действия эти АМП близки к антисептикам, именно поэтому устойчивость патогенов формируется к ним крайне медленно, кроме того, отсутствует перекрестная резистентность с другими классами антибиотиков.
Хорошим примером ориентации российского здравоохранения на инновационные разработки лекарственных средств может являться широкое внедрение в урологическую практику комплексного оригинального препарата калиевой соли фуразидина и магния карбоната основного (Фурамаг). В немногочисленных пока исследованиях уже даны фармакодинамические и фармакокинетические обоснования его использования при неосложненных ИМП, а в клинических исследованиях показана его достаточная эффективность и безопасность, позволяющая говорить о своего рода ренессансе АМП нитрофуранового ряда.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.