Низкодифференцированный нейроэндокринный рак поджелудочной железы
- Аннотация
- Статья
- Ссылки
- English

Актуальность
Нейроэндокринные опухоли считаются гетерогенными с точки зрения эмбрионального происхождения, степени агрессивности, прогноза и тактики лечения [1].
Низкодифференцированные нейроэндокринные карциномы (НЭК) G3 относятся к редким опухолям. На их долю приходится около 5% всех нейроэндокринных опухолей поджелудочной железы [2].
НЭК поджелудочной железы – клинически агрессивная опухоль, характеризующаяся низкой дифференцировкой, высокой пролиферативной способностью и быстрым прогрессированием [3–5]. В отличие от пациентов с хорошо дифференцированными нейроэндокринными опухолями G1/G2, у которых обычно наблюдается вялотекущий процесс заболевания, у большинства пациентов с НЭК отмечаются симптомы, сходные с протоковой аденокарциномой, включая боль в спине, кахексию, снижение веса и желтуху [4].
Свыше 70% пациентов с НЭК на момент постановки диагноза имеют регионарные или отдаленные метастазы, что обусловлено быстрым агрессивным течением заболевания, и только в 20–30% случаев возможна хирургическая резекция [3, 4, 6, 7].
Пятилетняя выживаемость пациентов с НЭК ниже, чем пациентов с высоко или умеренно дифференцированными нейроэндокринными опухолями [1]. При распространенной стадии, равно как и при локализованной НЭК, средняя выживаемость составляет 4–16 месяцев [8–14]. В отсутствие лечения выживаемость существенно меньше – один месяц [15].
Роль хирургического вмешательства при НЭК противоречива. Вопрос о таком лечении рассматривается в случае ограниченного процесса. Кроме того, хирургическое лечение должно сочетаться с адъювантной химиотерапией из-за риска метастатического прогрессирования и рецидива [16, 17].
НЭК обычно не реагирует на стандартные методы лечения, традиционно применяемые при опухолях G1 и G2, – аналоги соматостатина, эверолимус, сунитиниб и интерферон [18–20]. Аналоги соматостатина не рекомендуются при НЭК, поскольку их противоопухолевое действие подтверждено только при нейроэндокринных опухолях с индексом Ki-67 < 10%. У пациентов с НЭК очень редко наблюдается карциноидный синдром [16, 17, 21, 22]. Аналоги соматостатина могут применяться в комбинации с лечебной химиотерапией для контроля карциноидного синдрома либо при маркерном росте.
У пациентов с метастатической НЭК химиотерапия первой линии предполагает использование цисплатина или карбоплатина в сочетании с этопозидом. Согласно данным исследований, частота ответа на комбинированную терапию цисплатином и этопозидом варьируется от 14 до 50% [22–26]. Крупнейшее ретроспективное исследование желудочно-кишечной НЭК показало более низкий уровень ответа на химиотерапию на основе платины у пациентов с Ki-67 < 55% (15%) по сравнению с пациентами с высокой пролиферативной активностью Ki-67 > 55% (42%; р < 0,01) [15].
Схема химиотерапии второй линии на данный момент не определена. В большинстве рекомендаций предлагается повторная индукция с помощью платины/этопозида или применение темозоломида, капецитабина [15, 27–29]. Возможно и применение схем химиотерапии, включающих иринотекан и платину [30–37]. При тяжелой сопутствующей патологии – статус ECOG 2 – допустимо применение темозоломида в монорежиме [38–40]. Альтернативой может служить комбинация иринотекана и цисплатина. В крупном японском ретроспективном исследовании сообщалось о лучшем ответе и более высокой выживаемости для этой комбинации по сравнению с цисплатином и этопозидом (частота ответа – 50 против 28%, выживаемость – 13 против 7 месяцев) [30]. Варианты терапии второй и третьей линии у пациентов с НЭК представлены в таблице [41].
Клинический случай
Пациентке 1960 г.р. в 2011 г. была проведена энуклеация опухоли в области перешейка поджелудочной железы T1N0M0, обнаруженной при ультразвуковом исследовании (УЗИ) во время диспансеризации. Иммуногистохимическое (ИГХ) исследование показало НЭК поджелудочной железы, Кi-67 50%. Маркеры (хромогранин А, гидроксииндолилуксусная кислота, нейронспецифическая энолаза) – в пределах референсных значений. У пациентки отсутствовала тяжелая сопутствующая патология, наследственный анамнез не отягощен. Лечения больная не получала, проводилось динамическое наблюдение по месту жительства.
В декабре 2014 г. по поводу опухоли головки поджелудочной железы, метастазов в печени, брыжейке тонкой кишки, яичниках пациентке был наложен обходной анастомоз по Ру. Гистологическое исследование показало в лимфатических узлах и брюшине метастазы НЭК G3. Проведено десять курсов химиотерапии по схеме XELOX (оксалиплатин 130 мг/м2 в день внутривенно (в/в) капельно + внутрь капецитабин 2000 мг/м2 в 1–14-й дни каждые три недели) на фоне введения октреотида 20 мг один раз в 28 дней.
В мае 2016 г. после лечения наблюдалась стабилизация процесса, согласно результатам компьютерной томографии (КТ). УЗИ малого таза: прогрессирование заболевания в виде увеличения метастаза в левом яичнике. Выполнена экстирпация матки с придатками.
Результаты ИГХ-исследования показали метастазы НЭК. Назначено шесть курсов химиотерапии по схеме: паклитаксел 175 мг/м2 в день в/в + карбоплатин AUC5 в/в каждые три недели до апреля 2017 г.
Все курсы химиотерапии пациентка перенесла удовлетворительно. В июне 2017 г. зафиксировано повышение уровня хромогранина А до 148,5 мкг/л. Была рекомендована терапия октреотидом 40 мг один раз в 28 дней.
В ноябре 2017 г. (контрольное обследование) отмечалось увеличение забрюшинных лимфатических узлов и очагов в печени. Поскольку безрецидивный период превысил шесть месяцев, было принято решение провести химиотерапию по схеме: этопозид 100 мг/м2 в 1–3-й дни в/в + цисплатин 75 мг/м2 в день в/в каждые три недели. Пациентка прошла шесть курсов химиотерапии (до мая 2018 г.). В мае 2018 г. исследование маркеров крови показало увеличение уровня хромогранина А до 323,48 мкг/л. Пациентке была проведена эхокардиография для исключения сердечной недостаточности. Отклонений не выявлено. КТ брюшной полости: в печени обнаружены два новых очага. Проведено восемь курсов химиотерапии по схеме: темозоломид 150 мг/м2 внутрь в 10–14-й дни + капецитабин 2000 мг/м2 в 1–14-й дни каждые четыре недели на фоне терапии аналогами соматостатина (октреотид 60 мг один раз в 28 дней). Курсы пациентка перенесла удовлетворительно, без гематологической токсичности. Последний курс завершился в феврале 2019 г. Терапия октреотидом продолжена в прежнем режиме. Проведено исследование NGS, мутаций не выявлено.
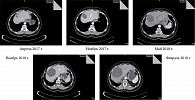
Результаты КТ органов брюшной полости показали стабилизацию процесса. В дополнение к проведенному ранее лечению было решено провести радиочастотную абляцию очагов печени. Повторная КТ в августе 2019 г. показала отсутствие динамики. В сентябре 2019 г. наступила смерть. Алгоритм лечения пациентки с НЭК поджелудочной железы представлен на рис. 1, динамика очага печени – на рис. 2.
Выводы
Учитывая, что средняя продолжительность жизни пациентов с НЭК не превышает двух лет и НЭК относится к редким патологиям, рассмотренный случай можно считать уникальным. По нашему мнению, данный факт обусловлен диагностированием на ранней стадии (стадия I), радикальностью выполненной операции на первом этапе, хорошей переносимостью назначенной терапии.
С ростом онкологической заболеваемости, в том числе нейроэндокринными опухолями, все большее значение приобретает поиск новых схем лечения пациентов с НЭК, прогноз которых оставался неблагоприятным в течение последних десятилетий. Ингибиторы контрольных точек, такие как ниволумаб или пембролизумаб, расширяют возможности лечения данных пациентов.
Результаты исследования показали, что экспрессия PD-L1 в НЭК связана с низкой степенью дифференцировки (экспрессия PD-L1 наблюдалась в 40% случаев НЭК) и плохим прогнозом [42]. В исследовании P.T. Nghiem и соавт. на фоне пембролизумаба, который назначали пациентам с карциномой из клеток Меркеля (также относится к НЭК) в качестве терапии первой линии, отмечался объективный ответ в 56% случаев [43]. Таким образом, необходимы дальнейшее изучение иммунотерапии при НЭК G3 и выявление групп пациентов, у которых новые варианты лечения могут быть эффективны.
С учетом неоднородности и сложной биологии опухоли в каждом конкретном случае лечение должно быть строго индивидуальным и проводиться с участием многопрофильной команды. Такой подход к лечению предполагает проведение тщательного анализа всех факторов, связанных с пациентом и заболеванием, определение степени, локализации первичной опухоли и метастазов, а также объема собственно опухолевой массы, симптомов, сопутствующих заболеваний и общего статуса пациента. Скрупулезная оценка и при необходимости переоценка потенциальных преимуществ конкретных терапевтических и поддерживающих мероприятий на каждом этапе принятия клинического решения в отношении течения заболевания призваны обеспечить наиболее благоприятный исход.
A.Z. Isyangulov, R.Sh. Khasanov, PhD, Prof., RASci. Corr. Mem.
Republican Clinical Oncology Dispensary, Kazan
Kazan State Medical Academy – Branch Campus of the Federal State Budgetary Educational Institution of Further Professional Education ‘Russian Medical Academy of Continuous Professional Education’ of the Ministry of Healthcare of the Russian Federation
Volga Branch Federal State Budgetary Institution ‘N.N. Blokhin National Medical Research Center of Oncology’
Contact person: Alina Z. Isyangulova, a.isyangulova@rambler.ru
Data on neuroendocrine tumors are very limited. Neuroendocrine cancer (NEC) is a rare and highly aggressive malignancy, and despite sensitivity to chemotherapy, overall survival in most cases does not exceed several years. Limited data and small groups of studies do not offer much choice in treatment tactics for patients with NEC. This article presents our own experience in treating a patient with pancreatic NEC, whose total duration of follow-up was more than 8 years.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.