Новое в таргетной терапии HER2-позитивного рака молочной железы
- Аннотация
- Статья
- Ссылки
- English

Рак молочной железы – социально значимое заболевание, лидирующее в структуре онкологической заболеваемости и смертности женщин практически во всем мире. Важно, что прошлое столетие ознаменовалось прогрессом в хирургическом, лучевом и лекарственном лечении рака молочной железы (РМЖ), начало нового столетия – развитием таргетной (биологически направленной) терапии. Известно более 100 потенциальных мишеней для таргетной терапии РМЖ, важнейшими из которых по-прежнему остаются рецепторы эстрогенов и рецептор эпидермального фактора роста 2 типа (Human Epidermal Growth Factor Receptor 2, HER2) [1, 2].
Таргетная терапия трастузумабом и лапатинибом у больных ранним и метастатическим HER2-позитивным РМЖ позволила улучшить показатели безрецидивной и общей выживаемости. С целью увеличения эффективности лечения больных таргетными анти-HER2-препаратами в настоящее время проводятся клинические исследования, направленные на открытие новых биологических препаратов для комплексного преодоления механизмов резистентности. В прошлом году была представлена основательная доказательная база по эффективности новых таргетных препаратов: трастузумаба для подкожного введения, T-DM1 (конъюгата моноклонального антитела – трастузумаба и химиотерапевтического агента – DM1 (производного майтанзина)) и пертузумаба (ингибитора димеризации HER2-рецептора c рецепторами семейства HER) у больных HER2-позитивным РМЖ, в том числе с прогрессированием после трастузумаб-содержащих режимов.
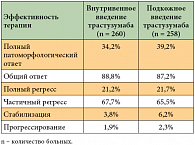
Трастузумаб для подкожного введения – новая форма введения трастузумаба в виде подкожной инъекции в фиксированной дозе 600 мг. Эффективность и безопасность подкожного введения препарата были доказаны в неоадъювантном исследовании III фазы HannaH [3] в сравнении со стандартной формой внутривенного введения трастузумаба у больных HER2-позитивным РМЖ на ранних стадиях (табл. 1) [3]. Результаты исследования показали, что в исследовании HannaH профиль безопасности новой формы трастузумаба соответствовал ранее изученному для трастузумаба (нежелательные явления включали алопецию, тошноту, нейтропению, диарею, астению и утомляемость), что объясняется сопоставимостью средних концентраций трастузумаба в крови как при подкожном, так и при внутривенном введении (геометрическое среднее концентрации трастузумаба в крови на 8-м цикле перед очередным введением препарата составило 69,0 и 51,8 мкг/мл соответственно). Существенно, что подкожное введение трастузумаба занимает около 5 минут, а инфузия препарата в существующей форме для внутривенного введения – более 30 минут. Таким образом, трастузумаб в виде подкожных инъекций является альтернативой для внутривенной формы трастузумаба, являющейся стандартом терапии пациенток с HER2-позитивным РМЖ.
В перспективе новая форма препарата обеспечит пациентам эффективный и более удобный способ введения трастузумаба, а также снизит затраты на лечение по сравнению со стандартной формой внутривенного введения, так как пациенты будут проводить меньше времени в стационаре. Особенно это важно при лечении больных РМЖ на ранних стадиях, получающих трастузумаб в течение 1 года. На основании данных исследования HannaH была подана заявка на регистрацию подкожной формы трастузумаба в Европейское агентство по лекарственным средствам (European Medicines Agency, EMA) для лечения HER2-позитивного РМЖ.
T-DM1 (трастузумаб эмтанзин) – новый таргетный препарат класса конъюгатов «антитело + лекарственное средство» для лечения HER2-позитивного (HER2+) РМЖ [4, 5]. DM1 (N-метил-N-[3-меркапто-1-оксопропил]L-аланин эфир майтанзинола) – это антимитотический цитостатик, который связан с моноклональным антителом посредством тиоэфирного мостика (линкера) [6]. Преимущество использования тиоэфирного линкера в иммуноконъюгатах заключается в его стабильности в сыворотке при сохранении способности внутриклеточного выделения агента. In vitro производные майтанзина обладают противоопухолевой активностью в 25–500 раз выше, чем у паклитаксела, и на 2–3 порядка выше, чем у доксорубицина [7]. Биологическая активность трастузумаба сохраняется в T-DM1, что делает возможным разрушение HER2-позитивных опухолевых клеток посредством антителозависимой цитотоксичности. Образовавшийся комплекс T-DM1-HER2 захватывается клеткой и распадается в лизосомах. После выхода цитостатика в цитоплазму происходит блокировка сборки микротрубочек, приводящая к гибели опухолевой клетки [8].
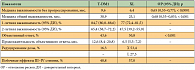
В исследованиях на клеточных культурах T-DM1 продемонстрировал высокую активность на клеточных линиях РМЖ с гиперэкспрессией HER2. На ксенотрансплантатах трастузумаб эмтанзин также продемонстрировал противоопухолевую активность при резистентном к трастузумабу РМЖ с гиперэкспрессией HER2. Многообещающие результаты были получены в исследовании II фазы TDM4450g (при медиане наблюдения 13 месяцев) по сравнению эффективности и токсичности T-DM1 в дозе 3,6 мг/кг каждые 3 недели против стандартной комбинации «трастузумаб + доцетаксел» (TD) у 137 больных HER2+ метастатическим РМЖ (мРМЖ) в 1-й линии лекарственного лечения [9]. В результате объективный ответ в группе T-DM1, по оценке исследователей, составил 64,2%, в группе TD – 58,0%. Выживаемость без прогрессирования у больных, получавших T-DM1, составила 14,2 месяца, в то время как в контрольной группе – 9,2 месяца (p = 0,035). Таким образом, различия в медиане выживаемости составили 5 месяцев.
Спектр побочных эффектов T-DM1 характеризовался в основном тошнотой (47,8%), увеличением активности аспартатаминотрансферазы (АСТ) (39,1%) и повышением температуры (39,1%). Токсичность III–IV степени у больных в группе T-DM1 регистрировалась в 2 раза реже по сравнению с больными группы TD (46,4% против 89,4% соответственно). В исследуемой группе T-DM1 полностью отсутствовали фебрильная нейтропения и снижение фракции выброса левого желудочка до III–IV степени. Значительно меньшая токсичность T-DM1 и удобный режим введения (30-минутная инфузия 1 раз в 3 недели) позволили сохранить качество жизни больных на более высоком уровне [10]. Хорошая переносимость T-DM1 по сравнению с режимом «трастузумаб + доцетаксел» связана с минимальным токсическим действием на организм вследствие адресной доставки цитостатика DM1 к опухолевой клетке HER2+ РМЖ. На конференции ASCO 2012 г. были представлены результаты первого запланированного промежуточного анализа исследования III фазы (медиана наблюдения – 12 месяцев) по оценке эффективности и токсичности T-DM1 в сравнении со стандартным режимом «капецитабин + лапатиниб» (XL) у больных HER2+ мРМЖ (n = 978), резистентных к трастузумабу и таксанам [11].
Объективный ответ регистрировался достоверно чаще в группе T-DM1 (43,6%) по сравнению с контрольной группой (30,8%) (p < 0,001). Различия в медиане продолжительности полученных объективных ответов составили 12,6 месяца и 6,5 месяца в пользу T-DM1. Преимущества исследуемого препарата отмечены в отношении выживаемости без прогрессирования: 9,6 месяца у получавших T-DM1 больных и 6,4 месяца у больных, получавших комбинацию «капецитабин + лапатиниб» (p < 0,0001). Медиана общей выживаемости на момент окончательного анализа [5] в исследуемой группе составила 30,9 месяца, тогда как в группе XL – 25,1 месяца (р < 0,001). Отмечено увеличение 1-годичной выживаемости с 77% у больных, получавших комбинацию капецитабина и лапатиниба, до 84,7% у больных, получавших T-DM1 (конъюгат трастузумаба и цитостатика эмтанзина), а также увеличение 2-летней выживаемости (с 47,5% до 65,4% соответственно) (табл. 2) [5, 11].
Наиболее частыми побочными эффектами терапии T-DM1 III–IV степени были тромбоцитопения (12,9% против 0,2%), увеличение трансаминаз ACT (4,3% против 0,8%) и АЛТ (2,9% против 1,4%). Типичными и предсказуемыми осложнениями III–IV степени комбинации XL были диарея (20,7% против 1,6%), ладонно-подошвенный синдром (16,4% против 0) и рвота (4,5% против 0,8%). Более мягкий токсический профиль T-DM1 по сравнению с режимом «лапатиниб + капецитабин» связан с направленной доставкой цитостатика DM1 к опухолевой клетке HER2+ РМЖ, что ведет к уменьшению токсического действия на весь организм. В этом году на основании результатов исследования EMILIA подана заявка на регистрацию применения трастузумаба эмтанзина при HER2-позитивном метастатическом РМЖ в Европе и США. Рецептор HER2 является преимущественным партнером для димеризации трех других рецепторов человеческого эпидермального фактора роста, поскольку не имеет лигандов и постоянно готов к взаимодействию с ними [12]. Предполагается, что димеризация рецепторов HER2 и HER3 является одной из ведущих причин развития лекарственной резистентности, так как ведет к повышению активности сигнальных путей PI3K и МАРК, ответственных за рост, пролиферацию и предотвращение апоптоза опухолевой клетки [13].
Синергизм действия пертузумаба (нового таргетного препарата в классе ингибиторов димеризации HER2) и трастузумаба впервые был продемонстрирован на моделях с перевиваемыми опухолями [14]. В пилотных исследованиях пертузумаб показал эффективность у больных HER2+ мРМЖ с прогрессированием заболевания после терапии трастузумабом [15], однако результаты лечения данной категории больных стали значительно лучше при двойной блокаде HER2. Учитывая то, что пертузумаб и трастузумаб не обладают перекрестной резистентностью и проявляют синергизм в отношении противоопухолевой активности [16], с целью повышения эффективности лекарственного лечения больных HER2+ мРМЖ было инициировано исследование III фазы CLEOPATRA (CLinical Evaluation Of Pertuzumab and TRAstuzumab – Клиническая оценка пертузумаба и трастузумаба), направленное на изучение эффективности и переносимости комбинации «пертузумаб + трастузумаб + доцетаксел» (РTD) [17].
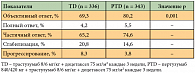
В исследование были включены 808 больных HER2+ мРМЖ, не получавших ранее лекарственной терапии по поводу диссеминации процесса или с рецидивом после комплексного лечения, включающего неоадъювантную и/или адъювантную терапию. Эти больные были рандомизированы в две группы терапии: «пертузумаб + трастузумаб + доцетаксел» и «пертузумаб + трастузумаб + плацебо» (контрольная группа). Группы были хорошо сбалансированы по основным клиническим характеристикам. Доза пертузумаба или плацебо была фиксированной и составила 840 мг с переходом на режим поддержки 420 мг. Трастузумаб больные получали в стандартном режиме, начиная с нагрузочной дозы 8 мг/кг и дальнейшим переходом на поддерживающую дозу 6 мг/кг. Доцетаксел назначался в дозе 75–100 мг/м2 (было рекомендовано как минимум 6 циклов доцетаксела). Внутривенные инфузии препаратов (в соответствии со схемой лечения) повторялись каждые 3 недели до прогрессирования заболевания или непереносимой токсичности. В группе пертузумаба (PTD) больные получили 24 (1–66) цикла, в контрольной группе (TD) – 15 (1–62) циклов с медианой продолжительности лечения 17,4 и 11,4 месяца соответственно. В среднем больные получили по 8 циклов монохимиотерапии доцетакселом (табл. 3) [18].
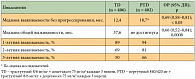
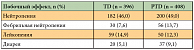
При медиане наблюдения 19,3 месяца объективный ответ в группе PTD оказался достоверно выше по сравнению с группой контроля TD (80,2% и 69,3% соответственно). Это при том, что контроль над болезнью (полный регресс + частичный регресс + стабилизация) в группе «пертузумаб + трастузумаб + доцетаксел» приближался к 100% (табл. 4) [17]. По оценке независимых экспертов и исследователей, добавление пертузумаба в стандартный режим 1-й линии лекарственного лечения HER2+ мРМЖ увеличило медиану выживаемости без прогрессирования на 6,1 месяца – с 12,4 до 18,5 месяцев (p < 0,001) [17]. Выживаемость без прогрессирования была также достоверно выше в группе PTD у больных, получавших трастузумаб неоадъювантно или адъювантно (16,9 месяца против 10,4 месяца в группе TD), и у больных, никогда не получавших трастузумаб (21,6 месяца против 12,6 месяца соответственно). Окончательный анализ общей выживаемости (ОВ) был представлен в 2012 г. в Сан-Антонио на симпозиуме SABCS (Исследовательский центр терапии рака и Американская ассоциация исследований рака) по раку молочной железы. Результаты исследования показали достоверное улучшение ОВ в сочетанной группе.
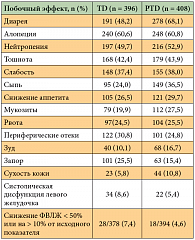
Было отмечено снижение риска смерти на 34% (ОР = 0,66; p = 0,0008) у больных, получавших трастузумаб и доцетаксел в сочетании с пертузумабом, в сравнении с теми, кто получал только трастузумаб и химиотерапию. Также в группе пертузумаба исследователи выявили увеличение показателей 1-годичной, 2-годичной и 3-годичной выживаемости (табл. 5) [18]. На момент проведения анализа медиана ОВ у пациентов, которым проводилось лечение, включающее пертузумаб, еще не была достигнута, так как более половины из них были живы, тогда как медиана ОВ пациентов, получавших трастузумаб и химиотерапию, составила 37,6 месяца. Исходя из этих данных, участницам исследования CLEOPATRA, которые получали только трастузумаб и доцетаксел, была предложена возможность лечения комбинацией препаратов, включающей пертузумаб. Токсический профиль этих режимов был в целом сопоставим (табл. 6, 7) [18]. Несколько чаще в группе пертузумаба регистрировались диарея (68,1% против 48,2%), сыпь (36,5% против 24,0%), мукозиты (27,5% против 19,9%), фебрильная нейтропения (13,7% против 7,6%) и сухость кожи (10,8% против 5,8%).
При этом добавление пертузумаба к стандартной комбинации трастузумаба и доцетаксела не привело к увеличению частоты асимптоматических и серьезных кардиологических осложнений (табл. 6). Не было зарегистрировано дозолимитирующей кардиотоксичности. Таким образом, синергизм пертузумаба и трастузумаба в блокаде рецептора HER2 приводит к преодолению лекарственной резистентности и, как следствие, к значимому увеличению частоты ответа на лечение и общей выживаемости больных. Учитывая все вышеизложенное, в июне 2012 г. комбинация пертузумаба (таргетного препарата в новом классе противоопухолевых агентов – ингибиторов димеризации), трастузумаба и доцетаксела была одобрена FDA (US Food and Drug Administration – Управление США по надзору за качеством пищевых продуктов и лекарственных средств) в качестве 1-й линии лечения HER2-позитивного метастатического РМЖ. В заключение отметим: достигнут значимый прогресс в терапии метастатического рака молочной железы с гиперэкспрессией HER2, а также изучены пути преодоления резистентности мРМЖ к стандартным программам лекарственного лечения. Внедрение в медицинскую практику новых таргетных препаратов – трастузумаба для подкожного введения, T-DM1 и пертузумаба – позволит индивидуализировать тактику лечения и тем самым повысить эффективность лечения и качество жизни женщин, страдающих HER2-позитивным раком молочной железы.
M.A. Osipov1,
2 State Educational Institution of Higher Professional Training ‘St. Petersburg Pavlov State Medical University’ of the Ministry of Health and Social Development of the Russian Federation
Contact person: Tatyana Yuryevna Semiglazova; tsemiglazova@mail.ru
