Неоадъювантная таргетная терапия рака молочной железы
- Аннотация
- Статья
- Ссылки
- English
Амплификация и/или гиперэкспрессия рецептора-2 человеческого эпидермального фактора роста (Human Epidermal Growth Factor Receptor – HER2, именуемого также ERВB2), трансмембранного рецептора тирозинкиназы, присутствует примерно в 22% случаев раннего операбельного РМЖ, в 35% случаев местнораспространенного и метастатического РМЖ и в 40% случаев воспалительного РМЖ и является индикатором агрессивного течения и худшего прогноза [1, 2]. Именно поэтому больные местнораспространенным или воспалительным РМЖ особенно сильно нуждаются в эффективном системном лечении. Трастузумаб (Герцептин®) – рекомбинантное гуманизированное моноклональное антитело против HER2 – обладает эффективностью в качестве монотерапии [3] и улучшает результаты химиотерапевтического лечения как у больных с НЕR2-позитивным метастатическим РМЖ [4, 5], так и у больных с НЕR2-позитивным ранним операбельным РМЖ [6–9].
Препарат широко одобрен в качестве монотерапии и в комбинации с химиотерапией или гормонoтерапией, однако без спецификации в отношении местнораспространенного РМЖ или воспалительного РМЖ. В пилотном исследовании [10] антрациклины и паклитаксел были успешно скомбинированы с трастузумабом у больных метастатическим РМЖ. Для снижения риска кардиотоксического эффекта терапии в пилотном исследовании проводилось только 3 цикла доксорубицина, что соответствует кумулятивной дозе в 180 мг/м2 [11]. Ни у одной из больных не наблюдалось симптоматической дисфункции сердечной мышцы, однако у 4 больных (из 16) было отмечено обратимое бессимптомное снижение фракции выброса левого желудочка до 50% и ниже.
Неоадъювантная химиотерапия, дополненная трастузумабом
Исследование неоадъювантного применения Герцептина NOAH (NeOAdjuvant Herceptin) было запланировано с целью оценки эффективности применения неоадъювантной химиотерапии, дополненной анти-НЕR2-терапией препаратом трастузумаб, с последующим адъювантным применением трастузумаба против одной неоадъювантной химиотерапии у больных НЕR2-позитивным местнораспространенным или воспалительным РМЖ. В исследовании NOAН (основные участники: НИИ онкологии им. проф. Н.Н. Петрова и Городской клинический онкологический диспансер Санкт-Петербурга) было рандомизировано 228 больных с подтвержденным в центральной лаборатории HER2-позитивным РМЖ на получение химиотерапевтического лечения: 3 циклов доксорубицина в сочетании с паклитакселом (АТ), 4 циклов паклитаксела (Т) и 3 циклов циклофосфамида, метотрексата и 5-фторурацила (CMF) с и без добавления трастузумаба. Добавление трастузумаба значительно увеличивало частоту ответа на лечение (81% против 73%, р = 0,18) и частоту полных патоморфологических регрессов (pCR, complete pathomorphological response) (43% против 23%, р = 0,002) [12].
Первичной целью являлась оценка продолжительности периода от момента рандомизации до возникновения неблагоприятных событий, то есть появления местного рецидива, прогрессирования заболевания (местное, регионарное, отдаленные метастазы или поражение контралатеральной молочной железы) или смерти от любой причины у больных НЕR2-позитивным РМЖ, получавших лечение трастузумабом. Трастузумаб значительно улучшал показатели выживаемости «без событий» (events) у больных НЕR2-позитивным РМЖ (трехлетняя выживаемость «без событий» (EFS, event-free survival) 71% (95% доверительный интервал (ДИ) 61–78, n = 36 событий) против 56% (95% ДИ 46–65, n = 51 событие) без добавления трастузумаба; ОР (отношение рисков) 0,59 (95% ДИ 38–90, р = 0,013)). Трастузумаб хорошо переносился, и, несмотря на одновременное назначение с доксорубицином, только у двух больных (2%) было отмечено симптоматическое нарушение сердечной деятельности. Обе больные ответили на терапию кардиологическими лекарственными средствами.
Результаты исследования NOAН показали, что добавление одногодичного лечения трастузумабом (сначала в качестве неоадъювантной терапии, затем в качестве компонента адъювантной терапии и далее) увеличивает частоту ответа на лечение, удваивает частоту полных патоморфологических регрессов, снижает риск рецидива, прогрессии и смерти от заболевания у больных НЕR2-позитивным местнораспространенным или воспалительным РМЖ по сравнению с больными, не получающими лечения препаратом. Исследователи определили особую эффективность трастузумаба в подгруппе больных с воспалительным РМЖ (27% НЕR2-позитивных больных) [13].
Результаты исследования NOAН подтверждают данные других испытаний неоадъювантного применения трастузумаба. В этих, в основном нерандомизированных, исследованиях частота полного патоморфологического регресса (определяемого различными способами) варьировала от 17% до 73% и была выше, чем в любой активно набранной или ретроспективно оцененной когорте НЕR2-негативных больных [14, 15]. Одно рандомизированное исследование, проведенное в центре M.D. Anderson (США) у больных операбельным невоспалительным РМЖ, было преждевременно прекращено из-за того, что частота патоморфологических регрессов в группе получавших трастузумаб вдвое превысила таковую в контрольной группе (65% против 26%) [16]. В этом исследовании обе группы больных были малы, однако предварительные результаты, полученные из другого рандомизированного исследования, тоже говорят об удвоении частоты полных патоморфологических регрессов при добавлении трастузумаба. Частота полного регресса при проведении первичной системной терапии является суррогатным маркером безрецидивной и общей выживаемости без выборки больных по HER2-статусу.
Несмотря на сочетанное применение доксорубицина, паклитаксела и трастузумаба в исследовании NOAН, частота симптоматического нарушения сердечной функции была низкой (< 2%), даже ниже, чем ожидалось (2,8–4,1%) на основании данных из исследований адъювантной терапии, в которых терапия трастузумабом проводилась сочетанно с паклитакселом после окончания терапии доксорубицином, и исследований, в которых Герцептин® предлагался в качестве монотерапии после завершения лечения различными режимами цитотоксической терапии (2%). Эти данные свидетельствуют о том, что трастузумаб может назначаться одновременно с терапией антрациклинами с низкой частотой симптоматического нарушения сердечной функции при условии снижения кумулятивной дозы антрациклинов и качественного мониторирования сердечной функции.
Добавление трастузумаба к неоадъювантной химиотерапии с последовательным применением антрациклинов и таксанов (с капецитабином или без него) также изучалось в исследовании III фазы GeparQuattro. Оно привело к удвоению частоты pCR (31,8% против 15,4%, р > 0,001) [17]. С появлением лапатиниба (Тайверб®), двойного ингибитора тирозинкиназы рецепторов HER1 и HER2, было запущено рандомизированное исследование III фазы CALGB (Cancer and Leukemia Group B), направленное на оценку эффективности применения паклитаксела в сочетании с трастузумабом или лапатинибом или в сочетании с обоими препаратами в неоадъювантном режиме. Также одновременно проводятся несколько других исследований оценки эффективности этих препаратов в неоадъювантном режиме, включая исследования III фазы NeoALTTO (Neoadjuvant Lapatinib and/or Trastuzumab Treatment Optimisation) и II фазы CHERLOB (Chemotherapy, Herceptin and Lapatinib in Operable Breast cancer).
Неоадъювантная терапия, включающая комбинацию «трастузумаб + пертузумаб»
Трастузумаб (Н) в сочетании с химиотерапией улучшает результаты лечения у больных с НЕR2-позитивным РМЖ и является общепризнанной составляющей частью лечебной схемы адъювантной терапии для таких пациенток. Однако у ряда больных все же наступает прогрессирование заболевания. Пертузумаб (Р) и трастузумаб (Н) направленно действуют на различные эпитопы HER2, их использование в комбинации приводит к повышению частоты ответа на лечение. Исследование NeoSphere (Neoadjuvant Study of Pertuzumab and Herceptin in an Early Regimen Evaluation) проводилось с целью оценки эффективности и безопасности неоадъювантной химиотерапии на основе трастузумаба при добавлении пертузумаба у женщин с НЕR2-позитивным местнораспространенным или воспалительным РМЖ, ранее не получавших химиотерапевтического лечения.
Положительные показатели эффективности применения трастузумаба стимулировали разработку новых HER2-таргетных препаратов, способных улучшить терапевтический эффект трастузумаба в комбинации или при последовательном назначении [18]. Пертузумаб является исследуемым гуманизированным моноклональным антителом, направленным на домен димеризации HER2 [19] в связи с наличием разных сайтов связывания. Трастузумаб и пертузумаб обладают комплементарными механизмами действия. В то время как трастузумаб блокирует отделение HER2 [20] и лиганд-независимую передачу сигнала [21], основной эффект пертузумаба обусловлен подавлением лиганд-зависимой передачи сигнала, в частности между НЕR2 и НЕR3.
Этот сигнальный путь играет важную роль в процессах активации пролиферации и выживания клеток [22]. Оба антитела являются индукторами антителоопосредованной клеточной цитотоксичности [23]. В недавно проведенном клиническом исследовании II фазы у больных НЕR2-позитивным метастатическим РМЖ частота эффекта от применения пертузумаба и трастузумаба у больных с прогрессией после терапии трастузумабом достигла 50% [24]. Исследование было разработано и проводилось фондом Микеланджело (Милан) в сотрудничестве с компанией «Хоффман-Ля Рош» при участии НИИ онкологии им. проф. Н.Н. Петрова и Городского и Областного клинических онкологических диспансеров Санкт-Петербурга и Ленинградской области.
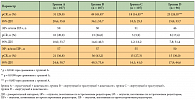
В целом в исследование NeoSphere включались больные из 59 центров в 16 странах с декабря 2007 по декабрь 2009 г. Всего было обследовано 603 больных, из которых 417 подошли для рандомизации. Большинство больных (n = 392) было подвергнуто хирургическому лечению, как и планировалось. Характеристики больных были сбалансированы по исследуемым группам (табл.), и средняя продолжительность лечения варьировала от 16 до 18 недель. Средний размер опухоли по данным клинического обследования на момент включения составил ≥ 50 мм во всех группах исследования.
Частота pCR в 29,0%, наблюдавшаяся в группе «трастузумаб + доцетаксел» (группа А), оказалась меньше, чем в группе «пертузумаб и трастузумаб + доцетаксел» (группа В, 45,8%) (р = 0,0141) (табл.). В сравнении, при комбинации «пертузумаб + доцетаксел» (группа D), была зафиксирована частота полных регрессов в 24,0%. Примечательно, что комбинированное таргетное лечение (пертузумаб и трастузумаб) без химиотерапии привело к полному исчезновению опухоли в молочной железе лишь у 16,8% больных (группа С).
В соответствии с данными, полученными из более ранних исследований [12], частота полных патоморфологических регрессов (pCR) была ниже при гормон-рецептор-положительных опухолях. У больных с гормон-рецептор-негативными опухолями частота pCR достигала 63,2% при применении трех препаратов (группа В) и 27,3% после всего лишь четырех курсов таргетной терапии без применения цитостатических препаратов (группа С). Доля больных без поражения лимфоузлов по данным хирургического лечения, достигших полного патоморфологического регресса в ткани железы, была самой высокой в группе В (39,3%). У большинства больных (67,6–88,1%) был достигнут клинический общий ответ на лечение (полный регресс (CR – complete response) или частичный регресс (PR – partial response) со стороны первичного новообразования).
Заключение
Исследование продемонстрировало, что добавление ингибитора димеризации HER2 препарата пертузумаб к традиционной схеме терапии «трастузумаб + доцетаксел» существенно повышает частоту полной регрессии опухоли в молочной железе после относительно короткого периода неоадъювантного лечения (12 недель) в популяции больных, третья часть которых имеют местнораспространенную форму РМЖ. И хотя пертузумаб в комбинации с доцетакселом также эффективен, сочетанное применение химиотерапии и двух таргетных антител оказалось более эффективным, чем применение цитотоксической терапии и одного из таргетных препаратов. Примечательно, что полный регресс опухоли был достигнут в 16,8% случаев при использовании одной таргетной терапии (трастузумаб + пертузумаб). Это знаковое наблюдение указывает на то, что определенная доля HER2-позитивных больных может быть излечена без применения химиотерапии. Это может оказать очень существенное влияние на клиническую практику при выборе лечения у больных, которые не могут получать тяжелую цитотоксическую терапию, и будет иметь еще большее значение в перспективе, если удастся выявить более точные биомаркеры, предсказывающие ответ на лечение.