Новое в терапии тяжелых форм акне
- Аннотация
- Статья
- Ссылки
- English
Традиционный подход к терапии тяжелых форм акне: нерешенные вопросы
Наиболее актуальными в последнее время являются вопросы терапии тяжелых форм акне. Традиционные схемы лечения предусматривают применение системных и топических антибактериальных препаратов. К часто используемым относятся доксициклин, эритромицин, левомицетин и линкомицин [1–3]. Отсутствие выраженного эффекта от их применения и развитие резистентности популяций микроорганизмов заставляют искать альтернативные схемы лечения.
Комплексная терапия больных со средней и тяжелой формами акне в большинстве случаев эффективна [4, 5]. Однако при тяжелых торпидных формах она малоэффективна из-за наличия сопутствующих заболеваний, вторичных иммунодефицитов и побочных эффектов от применения ретиноидов. Способствуя нормализации дифференцировки кератиноцитов, последние тормозят гиперпролиферацию эпителия в устьях выводных протоков сальных желез.
В настоящее время наиболее эффективным системным препаратом для лечения тяжелых форм акне является синтетический ретиноид изотретиноин (Роаккутан, 13-цис-ретиноевая кислота). Для терапии акне он используется с 1979 г. Его широкое применение ограничено потенциальным риском развития побочных эффектов (артралгии, скованность суставов и тендинит, сухость слизистых оболочек и кожи, эритемы, конъюнктивит, головные боли, нарушение липидного обмена в печени). Кроме того, отмечен тератогенный эффект препарата.
Резистентность к антибактериальным препаратам
Последнее время ученые все больше внимания уделяют проблеме развития резистентности, в том числе перекрестной, к различным группам антибактериальных препаратов.
Так, исследование чувствительности к антибиотикам микроорганизмов, полученных от больных акне, показало низкую чувствительность к линкомицину, эритромицину и доксициклину [6].
Установлена связь между количеством Propionibacterium acnes, резистентных к клиндамицину, тетрациклину и эритромицину, и ответом на терапию соответствующими антибиотиками [7–12].
Согласно данным ряда исследований при использовании нескольких препаратов с разными, но взаимодополняющими механизмами действия наблюдается значительный биологический суммарный эффект [13, 14].
Резистентные штаммы P. аcnes могут быть следствием недостаточного клинического ответа на применение топических антибиотиков. Так, по результатам двойного слепого исследования, увеличение количества резистентных P. аcnes отмечалось уже через восемь недель после начала монотерапии клиндамицином [15].
По данным российского исследования (2013), средний возраст больных, от которых были выделены штаммы, устойчивые к ципрофлоксацину, оказался больше на 1,6 года среднего возраста пациентов, от которых были получены чувствительные штаммы. Разница в возрасте пациентов, рандомизированных по показателю «чувствительность к офлоксацину», составила более двух лет [16].
Доказана связь между чувствительностью к тетрациклину и сообщенным опытом использования антибиотиков разных групп в течение года перед началом исследования. Однако разница в доле устойчивых штаммов варьировала от 4,5 до 12,5%. Для доксициклина она оказалась выше (26,4% при использовании тетрациклина и 22,1% – других или неустановленных антибиотиков). Кроме того, от пациентов, использовавших эритромицин наружно, устойчивые к доксициклину штаммы стафилококков выделяли на 9,8% чаще [16].
Иммунный статус больных акне
У больных акне выявлены существенные изменения на уровне всех звеньев иммунитета: снижение активности Т- и В-лимфоцитов, изменение количественного состава субпопуляций лимфоцитов, содержания иммуноглобулинов. Описаны изменения как в системе фагоцитоза, так и в цитокиновом профиле, что обусловливает формирование иммунодефицитного состояния и, как следствие, длительное, затяжное течение заболевания. Продолжительная интоксикация в результате бактериальной инфекции в свою очередь приводит к снижению неспецифической иммунологической реактивности организма.
Однако анализ литературы показывает, что единого мнения о характере иммунных изменений при акне не существует – данные разрозненны и противоречивы [17].
При исследовании иммунного статуса больных акне выявлено снижение количества Т-лимфоцитов (CD3+ и CD8+). При этом содержание В-лимфоцитов оказалось повышено [18].
Установлено, что при первой и второй степени тяжести акне существует обратная связь между уровнями фактора некроза опухоли альфа (ФНО-альфа) и эстрадиола, а при третьей – их синергетическое повышение. Последнее свидетельствует об усилении нарушений в эндокринной и иммунной системах. У больных акне выявлен дефицит интерлейкинов (ИЛ) 3, 4 и 10, интерферона гамма (ИФН-гамма), при достоверном повышении ФНО-альфа у пациентов с первой степенью тяжести заболевания. При третьей степени тяжести заболевания отмечены повышение концентрации ИЛ-12, ИЛ-2, ИФН-гамма, ИЛ-4 и ИЛ-13 и дефицит гранулоцитарно-макрофагального колониестимулирующего фактора, что является признаком развития иммунного ответа по смешанному T-хелперному типу [19].
Иммуномодулирующая терапия
Активность P. acnes приводит к выработке большого количества провоспалительных цитокинов, миграции моноцитов, нейтрофилов и лимфоцитов в тканях, окружающих сальную железу. Устойчивость этих бактерий и дефект В-клеточного иммунного ответа обусловливают персистенцию возбудителя и выработку еще большего количества цитокинов. Возникает порочный круг, и интенсивное хроническое воспаление становится основным симптомом заболевания [20].
Для того чтобы повысить эффективность проводимой терапии, пациентам нередко назначают иммуномодулирующие препараты [19]. К данной группе относится препарат Стемокин. Стемокин – это натриевая соль синтетического пептида, состоящего из L-аминокислотных остатков изолейцила, глутаминовой кислоты и триптофана. Препарат обладает иммуномодулирующим действием, увеличивает резистентность организма в отношении локальных и генерализованных инфекций, способствует нормализации иммунологических показателей.
В основе механизма действия лежит прямое воздействие на пролиферацию и дифференцировку ранних клеток – предшественников гемопоэза, регуляторное воздействие на реакцию клеточного и гуморального иммунитета и неспецифическую резистентность организма.
Препарат влияет на процессы дифференцировки лимфоидных клеток, индуцируя экспрессию дифференцировочных антигенов на лейкоцитах. Показанием к применению Стемокина является хронический фурункулез.
Опыт применения Стемокина
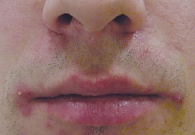
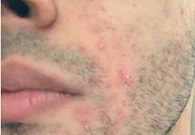
Под наблюдением находилось 14 пациентов, страдающих среднетяжелой и тяжелой формами акне, с сопутствующим поражением гепатобилиарной системы. Возраст больных – от 21 до 37 лет. Длительное применение различных системных антибиотиков не привело к значимому эффекту. Ранее для топической терапии использовали ретиноиды и антибиотики, которые также не способствовали положительной динамике (рис. 1 и 2).
Проведенное микробиологическое исследование выявило резистентных к антибиотикам Staphylococcus aureus, Staphylococcus epidermidis, Pantoea agglomerans и т.д. В связи с этим в комплексную терапию был добавлен Стемокин в дозе 1 мл внутримышечно ежедневно в течение 10 дней, затем интраназально в течение двух-трех недель (в зависимости от степени клинических проявлений). Кроме того, применялись косметические средства: гель для умывания и лосьон.
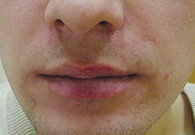
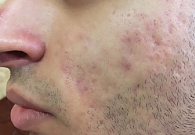
Через 10 дней терапии отмечалось отсутствие пустулезных высыпаний (рис. 3), к 21-му дню – отсутствие папулезных высыпаний (рис. 4).
К 21-му дню при микробиологическом исследовании выявлено уменьшение количества бактериальной микрофлоры, в том числе антибиотикорезистентных штаммов.
По окончании терапии Стемокином больным рекомендовано продолжить использование косметических средств для проблемной кожи.
В течение двух месяцев после окончания лечения рецидивов заболевания не отмечалось.
Заключение
Приведенное наблюдение свидетельствует о том, что включение Стемокина в комплексную терапию торпидных форм акне высокоэффективно и может быть рекомендовано в качестве альтернативного лечения у больных с соматической отягощенностью и при наличии резистентной к антибиотикам микрофлоры.
L.R. Sakaniya, K.T. Pliyeva, I.V. Golembiovskaya, I.M. Korsunskaya
Center for Theoretical Problems of Physico-Chemical Pharmacology of the Russian Academy of Sciences
Russian Peoples' Friendship University
Contact person: Irina Markovna Korsunskaya, marykor@bk.ru
Traditional protocols for treating acne envisage administration of systemic and topical antibacterial agents. However, in some severe torpid acne such therapy is ineffective. In particular, it results from developing antimicrobial resistance and immunodeficiency. In this case, use of immunomodulatory therapy may be one of potential solutions. In our paper we present the data regarding administration of Stemokine in patients suffering from modest and severe acne accompanied by hepatobiliary disorders.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


