количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Новые возможности лечения HER2-позитивного рака молочной железы
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Онкология, гематология и радиология." № 1 (14)
- Аннотация
- Статья
- Ссылки
- English
Несмотря на эффективность трастузумаба в адъювантной терапии HER2-позитивного рака молочной железы (РМЖ), существует группа пациентов, у которых развивается рецидив заболевания, а при наличии отдаленных метастазов резистентность развивается неизбежно. В обзорной статье представлены клинические данные о HER2-таргетных препаратах, находящихся в стадии изучения, а также рассмотрены биологические обоснования для разработки агентов, направленных на преодоление анти-HER2-резистентности. В настоящее время в стадии клинического исследования находится множество HER2-таргетных агентов, например, моноклональные антитела, малые молекулы и конъюгаты «антитело – лекарственное средство». В клиническую практику уже внедрена концепция двойной анти-HER2-блокады, при этом пертузумаб в комбинации с трастузумабом и доцетакселом одобрен в качестве терапии первой линии метастатического РМЖ. Клинические испытания проходит активный агент T-DM1, анти-HER2-конъюгат «антитело – лекарственное средство». В качестве терапевтических мишеней рассматриваются некоторые молекулярные механизмы резистентности к блокаторам HER2; проводится разработка экспериментальных соединений.
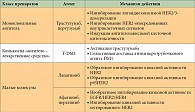
Таблица 1. Механизмы действия анти-HER2-блокирующих агентов
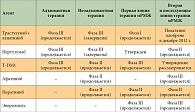
Таблица 2. Статус клинических исследований таргетных агентов при HER2-позитивном РМЖ различной степени распространенности
Введение
HER2-позитивный рак молочной железы (РМЖ) представляет собой молекулярный подтип РМЖ, характеризующийся агрессивным биологическим течением. Революцию в лечении данного заболевания произвел трастузумаб. Лапатиниб, показавший эффективность при метастатическом РМЖ (мРМЖ), одобрен для лечения пациентов, получавших предварительную терапию трастузумабом [1]. Тем не менее резистентность к анти-HER2-агентам является основной клинической проблемой, касающейся как ранних, так и поздних стадий заболевания, что определяет актуальность разработки новых вариантов лечения. Имеющееся в настоящее время многообразие анти-HER2-таргетных агентов клинически представлено следующими группами препаратов: моноклональные антитела, малые молекулы, конъюгаты «антитело – лекарственное средство». Комбинация HER2-таргетных агентов в режимах двойной блокады HER2 (human epidermal growth factor receptor 2 – рецептор эпидермального фактора роста 2-го типа) уже применяется в клинической практике при мРМЖ, подтверждая доклиническую эффективность широкого спектра HER2-блокаторов. Были получены обнадеживающие результаты при применении данной группы препаратов в неоадъювантном лечении. Кроме того, в рамках крупных рандомизированных исследований продолжается поиск доказательств эффективности двойной анти-HER2-блокады в адъювантном режиме. Использование конъюгатов «антитело – лекарственное средство» представляет собой еще одно перспективное направление улучшения результатов лечения HER2-позитивного РМЖ, о чем свидетельствуют положительные результаты клинических испытаний трастузумаба эмтансина (T-DM1). Более того, понимание молекулярных механизмов промежуточной резистентности к HER2-блокирующим агентам открывает новые терапевтические возможности изучения нескольких таргетных агентов в ряде клинических исследований. В этой статье представлены клинические данные о HER2-таргетных препаратах, находящихся в стадии изучения, а также дан обзор биологических обоснований для разработки агентов, направленных на преодоление анти-HER2-резистентности.
Стратегии таргетной терапии HER2-позитивного РМЖ
Рецептор эпидермального фактора роста 2-го типа (EGFR2; HER2/new, ErbB2), трансмембранный рецептор 2-го типа, представляет собой хорошо изученный онкоген, опосредующий множество онкогенных эффектов через взаимосвязанную активацию PI3K/Akt/mTOR- и Ras/Raf/MEK/ERK-сигнальных путей [2]. Амплификация гена и/или гиперэкспрессия белка обнаруживаются примерно у 20% больных РМЖ и отвечают за агрессивный биологический фенотип заболевания и худшие клинические исходы [3].
Внедрение трастузумаба, гуманизированного моноклонального антитела, направленного на IV домен HER2, представляет собой первую значительную веху в развитии анти-HER2-таргетных агентов. Трастузумаб является основным блокирующим HER2 агентом при всех стадиях HER2-позитивного РМЖ, изменяющим при этом естественное течение заболевания [4]. Лапатиниб – еще один важный анти-HER2-блокатор – представляет собой двойной EGFR/HER2-обратимый ингибитор тирозинкиназы, в настоящее время рекомендованный в сочетании с капецитабином или летрозолом для лечения пациентов с HER2-позитивным мРМЖ [4].
Несмотря на противоопухолевую активность этих двух агентов, у определенной подгруппы пациентов с ранними стадиями HER2-позитивного РМЖ отмечаются рецидивы, при метастатическом заболевании первичная или вторичная резистентность развивается неизбежно. Именно поэтому ведется разработка методов лечения с использованием множества новых анти-HER2-таргетных агентов с различными механизмами действия (табл. 1), некоторые из них сегодня проходят стадию клинического изучения (табл. 2). Одним из перспективных подходов представляется двойная анти-HER2-блокада. Комбинированное использование различных анти-HER2-таргетных агентов демонстрирует повышенную противоопухолевую активность, основанную на комплементарности их механизмов действия, что приводит к более полной блокаде HER2. Эта стратегия уже внедрена в клиническую практику при мРМЖ и продемонстрировала более высокую частоту полных патоморфологических регрессов (complete pathomorphological response – pCR) при проведении неоадъювантного лечения. Второй подход заключается в разработке анти-HER2-конъюгатов «антитело – лекарственное средство», примером которого служит внедрение препарата T-DM1. Третий подход, изучавшийся в клинической практике раньше других, предполагает уточнение молекулярных механизмов резистентности к анти-HER2-блокирующим агентам. Эта стратегия комбинирует HER2-блокирующие агенты со сложным блокирующим молекулярным медиатором анти-HER2-резистентности для «(ре)сенсибилизации» HER2-позитивных клеток РМЖ с целью блокирования HER2.
Трастузумаб и лапатиниб
Трастузумаб и лапатиниб обладают комплементарным механизмом HER2-блокады (см. табл. 1), и в доклинических исследованиях было выявлено синергическое взаимодействие между этими двумя агентами – показана повышенная антителозависимая клеточная цитотоксичность и усиленная индукция апоптоза на моделях опухолей ксенотрансплантатов [5, 6].
Комбинированное применение трастузумаба и лапатиниба при мРМЖ было оценено в III фазе исследования EGF104900, в котором пациентов, получавших трастузумаб, рандомизировали на получение только лапатиниба или лапатиниба в сочетании с трастузумабом. Результаты двойного HER2-блокирования привели к достоверному увеличению медианы беспрогрессивной выживаемости (progression-free survival – PFS; 11,1 недели и 8,1 недели соответственно, р = 0,011) и общей выживаемости (overall survival – OS; 14 месяцев и 9,5 месяца соответственно, p = 0,026), несмотря на значительный перекрест (52%) [7]. Токсичность режима «лапатиниб + трастузумаб» была приемлемой, отмечалось повышение частоты диареи 1-й и 2-й степени (р = 0,03) и более высокая частота 20%-ного снижения фракции выброса левого желудочка (5,4 против 2,1%) по сравнению с монотерапией лапатинибом.
В неоадъювантном исследовании III фазы Neo-ALTTO (Neo-Adjuvant Lapatinib and/or Trastuzumab Treatment Optimization trial) 455 пациентов с HER2-позитивным операбельным РМЖ были рандомизированы на получение лапатиниба, трастузумаба или их комбинации сроком до 6 недель. После этого периода больные получали комбинацию анти-HER2-агентов с паклитакселом в течение последующих 12 недель. Двойная HER2-блокада показала более значительное повышение частоты pCR по сравнению с группами, получавшими монотерапию трастузумабом или лапатинибом (pCR 51,3%, 29,5% и 24,7% соответственно, р = 0,0001 для группы «трастузумаб + лапатиниб» в сравнении с монотерапией трастузумабом) [8]. Полные патоморфологические регрессы (pCR) наблюдались чаще у пациентов с гормон-рецептор-негативным РМЖ. Выраженной сердечной дисфункции не отмечено. В группе, получавшей лапатиниб, регистрировались нежелательные явления 3-й и 4-й степени, а также более высокая частота отмены лечения.
Похожие результаты были получены в исследовании CHER-LOB (Chemotherapy, Herceptin, and Lapatinib in Operable Breast Cancer study) [9]. Во II фазе исследования 121 пациент с операбельным HER2-позитивным РМЖ получал неоадъювантную таксан-антрациклинсодержащую химиотерапию в сочетании с лапатинибом (группа А), трастузумабом (группа В) или комбинацией «лапатиниб + трастузумаб» (группа С). В группе, получавшей комбинацию «лапатиниб + трастузумаб», отмечалась более высокая частота pCR (48%), чем в группе, получавшей только лапатиниб
(pCR 28%) или только трастузумаб (pCR 32%). В еще одном неоадъювантном исследовании TBCRC 006 (Translational Breast Cancer Research Consortium) оценивали эффективность комбинации «лапатиниб + трастузумаб» с любым режимом химиотерапии в течение
12 недель (в сочетании с гормональной терапией для пациентов с гормон-рецептор-позитивным РМЖ) [10]. Во II фазе исследования среди 64 пациентов с HER2-позитивным РМЖ со средним размером опухоли 6 см pCR был достигнут у 28%; и в этой работе было подтверждено, что у больных с гормон-рецептор-негативными опухолями чаще, чем при эстроген-рецептор-позитивной опухоли, отмечается pCR (42% и 21% соответственно).
В настоящее время комбинированное применение трастузумаба и лапатиниба изучается в ряде клинических исследований адъювантной терапии. В исследовании ALTTO (NCT00490139) – количество больных в III фазе исследования превышало 8300 пациентов – сравнивали эффективность монотерапии лапатинибом, монотерапии трастузумабом, трастузумаба с последующим применением лапатиниба и комбинации «трастузумаб + лапатиниб» у пациентов с ранними стадиями HER2-позитивного РМЖ. Первичной конечной целью данного исследования было сравнение показателей безрецидивной выживаемости (disease-free survival – DFS) между группами, получавшими монотерапию трастузумабом или комбинацию препаратов. Отметим: первый промежуточный анализ исследования ALTTO привел к закрытию группы, получавшей монотерапию лапатинибом, так как оказалось маловероятным, что результаты в данной группе будут лучше минимально допустимых пределов [11].
Пертузумаб
Пертузумаб, являясь человеческим моноклональным антителом, связывается с доменом II димеризации HER2, блокируя лиганд-индуцированную HER2/HER3-гетеродимеризацию [12]. Эта димеризация является важным молекулярным событием, отвечающим за злокачественную прогрессию клеток HER2-позитивного РМЖ через свою потенциальную способность активировать сигнальный путь PI3K/Akt/mTOR. Доклинические данные свидетельствуют о синергетическом эффекте пертузумаба в комбинации с трастузумабом. В настоящее время продолжаются клинические исследования, оценивающие стратегию двойной HER2-блокады [13].
В нескольких исследованиях I фазы, проводимых при мРМЖ, изучали эффективность пертузумаба либо в качестве монотерапии, либо в комбинации с цитотоксическими агентами. В небольшом исследовании II фазы оценивали комбинацию пертузумаба и трастузумаба у 11 пациентов с HER2-позитивным мРМЖ, получавших предварительно терапию трастузумабом [14]. Общая частота ответов (overall response rate – ORR) составила 18%, частота клинической пользы (clinical benefit rate – CBR) – 44,5%, однако набор в данное исследование был преждевременно прекращен из-за проявлений кардиотоксичности. У 6 пациентов было зарегистрировано снижение фракции выброса левого желудочка, в двух случаях оно составило более 15%, а у одного пациента развилась симптоматическая застойная сердечная недостаточность. В другом исследовании II фазы оценивали комбинацию пертузумаба с продолженной терапией трастузумабом у 66 больных HER2-позитивным мРМЖ, прогрессирующим на фоне терапии трастузумабом. В этой работе была показана многообещающая противоопухолевая активность данной комбинации: ORR достигла 24,2%, CBR равнялась 50%, при этом у пяти пациентов был получен полный ответ (complete response – CR; 7,6%)
и у 11 пациентов – частичный ответ (partial response – PR; 16,7%) [15]. Профиль сердечно-сосудистой безопасности в данном исследовании был более благоприятным по сравнению с другими небольшими исследованиями; более того, ни одного пациента не исключили из исследования вследствие развития кардиотоксичности. Кардиальная безопасность пертузумаба была доказана по результатам объединенного анализа данных 598 пациентов, получавших пертузумаб либо в качестве монотерапии, либо в комбинации с другими агентами. Было показано, что пертузумаб не приводит к значительному увеличению частоты побочных эффектов со стороны сердца [16].
Исследование CLEOPATRA (Clinical Evaluation of Pertuzumab and Trastuzumab; NCT00567190) представляет собой рандомизированное клиническое исследование III фазы, в которое было включено 808 пациентов с HER2-позитивным мРМЖ, ранее не получавших лечение и рандомизированных на получение или комбинации «доцетаксел + трастузумаб», или комбинации той же схемы с пертузумабом [17]. Двойная блокада HER2 продемонстрировала значительно более высокие показатели в отношении достижения первичной конечной точки исследования – выживаемости без прогрессирования заболевания (PFS) по сравнению с контрольной группой (медиана PFS равнялась 18,5 и 12,4 месяца соответственно, отношение рисков (ОР) 0,65, 95%-ный доверительный интервал (ДИ) 0,5–0,75, р < 0,001). Промежуточный анализ OS продемонстрировал тенденцию в пользу группы, получавшей пертузумаб. Второй анализ ОS, проведенный среди 69% запланированных случаев для окончательного анализа, показал статистически значимое преимущество группы, получавшей пертузумаб (в этой группе медиана OS не была достигнута, в то время как в группе плацебо составила 37,6 месяца; ОР 0,66, 95% ДИ 0,52–0,84, р = 0,0008) [18]. Коэффициент объективного ответа (ORR) равнялся 69,3% в контрольной группе и 80,2% в группе, получавшей пертузумаб. Следует отметить, что только 10% пациентов, включенных в исследование CLEOPATRA, получали трастузумаб как часть (нео)адъювантной терапии. Тем не менее исследовательский анализ не выявил различий в эффективности у больных, получавших пертузумаб в соответствии с первичной терапией трастузумабом. Что касается токсичности, диарея, сыпь, мукозиты, фебрильная нейтропения и сухость кожи любой степени наблюдались чаще в группе, получавшей пертузумаб. Профили сердечной безопасности между двумя группами были сопоставимы. Левожелудочковая систолическая дисфункция 3-й степени и выше была отмечена у 2,8% пациентов в контрольной группе и у 1,2% пациентов в группе, получавшей пертузумаб. На основании этих результатов пертузумаб одобрен для применения в терапии первой линии при HER2-позитивном мРМЖ, в комбинации с трастузумабом и доцетакселом.
Пертузумаб был также оценен в комбинации с трастузумабом в неоадъювантном режиме. В исследовании II фазы NeoSphere (Neoadjuvant Study of Pertuzumab and Herceptin in Early Regimen Evaluation; NCT00545688) 417 пациентов были рандомизированы на получение 4 циклов (12 недель) одного из следующих 4 режимов предоперационной химиотерапии: «трастузумаб + пертузумаб + доцетаксел», «трастузумаб + доцетаксел», «пертузумаб + доцетаксел» или «трастузумаб + пертузумаб» [19]. Частота pCR (первичная конечная точка данного исследования) равнялась 45,8% для триплета, 29% в группе получения комбинации «трастузумаб + доцетаксел», 24% – «пертузумаб + доцетаксел» и 16,8% в группе, получавшей комбинацию пертузумаба и трастузумаба без химиотерапии. Во всех группах частота pCR была выше в подгруппе женщин с эстроген-рецепор-негативным РМЖ, при этом частота pCR равнялась 27,3% для женщин, получающих комбинацию «пертузумаб + трастузумаб» без химиотерапии. Данные результаты позволяют предположить, что от 17 до 27% женщин с HER2-позитивным РМЖ могут избежать назначения цитотоксической химиотерапии. В исследовании II фазы TRYPHAENA (NCT00976989) 225 пациентов были рандомизированы на получение одного из трех неоадъювантных режимов: пертузумаб в сочетании с трастузумабом, назначаемые одновременно с антрациклин/таксансодержащей химиотерапией (5-фторурацил, эпирубицин, циклофосфамид (FEC), а затем доцетаксел), или двойная HER2-комбинация, назначаемая последовательно после схемы FEC, но одновременно с доцетакселом, или данный анти-HER2-дублет назначался одновременно с карбоплатином и доцетакселом [20]. Первичной целью данного исследования была сердечная безопасность, профиль которой оказался сопоставимым среди всех трех исследуемых групп. Частота pCR равнялась 61,6% в 1-й группе, 57% – во 2-й группе и 66,2% – в 3-й группе, при этом эстроген-рецептор-негативный статус опухоли коррелировал с более высокой частотой pCR (79,4%, 65,0% и 83,8% для соответствующей подгруппы 1, 2 и 3-й групп).
Указанные клинические данные стали основанием для проведения проспективных многоцентровых клинических исследований III фазы по оценке эффективности пертузумаба в адъювантном режиме – APHINITY (Adjuvant Pertuzumab and Herceptin in Initial Therapy of Breast Cancer, BIG 4-11; NCT01358877) является продолжающимся международным исследованием, в котором около 4800 пациентов с ранними стадиями HER2-позитивного РМЖ рандомизированы на получение либо трастузумаба, либо трастузумаба с пертузумабом в сочетании с цитотоксической химиотерапией.
Поколение низкомолекулярных ингибиторов
Нератиниб, являясь пероральным, необратимым ингибитором тирозинкиназы пан-HER-рецепторов, воздействующим на ErbB1 (EGFR), ErbB2 (HER2) и ErbB4 (HER4), находится в стадии клинического исследования. Исследование II фазы оценивало эффективность нератиниба у пациентов с HER2-позитивным мРМЖ, которые ранее либо получали терапию трастузумабом (66 пациентов), либо не получали лечения (70 пациентов) [21]. Нератиниб продемонстрировал выраженную противоопухолевую активность, при этом 16-недельный показатель выживаемости без прогрессирования (PFS) составил 59% для пациентов, которые предварительно получали трастузумаб, и 78% для пациентов, не получавших трастузумаб. Медиана PFS равнялась 22,3 и 39,6 недели соответственно. Наиболее частыми побочными явлениями были диарея (чаще 3-й и 4-й степени), тошнота, рвота и слабость. На фоне терапии нератинибом проявлений кардиотоксичности 3-й или 4-й степени не наблюдалось. Эффективность нератиниба в комбинации с трастузумабом также оценивали в исследовании I/II фазы, включавшем 45 пациентов, которые предварительно получали терапию трастузумабом по поводу HER2-позитивного мРМЖ [22]. В данном исследовании отмечалась значимая противоопухолевая активность комбинации: 16-недельный показатель выживаемости без прогрессирования (PFS) был достигнут у 47%, и медиана PFS составила 19 недель. В ходе исследования не наблюдалось новых проявлений токсичности. Были представлены предварительные итоги первого этапа исследования по оценке комбинации еженедельного применения паклитаксела с нератинибом и трастузумабом у женщин, предварительно получавших терапию трастузумабом по поводу HER2-позитивного мРМЖ. У 10 пациентов были получены положительные результаты, при этом был отмечен только один случай полного ответа (CR) и три случая частичного ответа (PR). Из нежелательных явлений наиболее часто регистрировали диарею 3-й и 4-й степени [23]. В другом исследовании I фазы, проведенном для оценки практической значимости нератиниба в сочетании с эверолимусом, выявлена противоопухолевая активность комбинации: из 8 пациентов, предварительно получавших терапию по поводу HER2-позитивного мРМЖ, у половины был получен частичный ответ (PR) и у остальных достигнута стабилизация заболевания (stabilization of disease – SD). ОRR был отмечен у 67% [24]. В рандомизированном исследовании II фазы сравнивали эффективность нератиниба с комбинацией «лапатиниб + капецитабин» во второй линии терапии мРМЖ. Нератиниб продемонстрировал высокий уровень противоопухолевой активности (общий объективный ответ (ORR) – 29%), однако он уступал комбинации «лапатиниб + капецитабин» по показателю медианы PFS, являющемуся главной целью исследования (медиана PFS – 4,5 и 6,8 месяца соответственно, ОР 1,3, 95% ДИ 1,0–1,8) [25]. В настоящее время проводится исследование III фазы по оценке эффективности нератиниба у пациентов с ранними стадиями HER2-позитивного РМЖ после завершения стандартной терапии трастузумабом в сочетании с адъювантной химиотерапией (NCT00878709).
Афатиниб является еще одним перспективным пероральным необратимым ингибитором тирозинкиназы пан-HER-рецепторов, находящимся в стадии клинического исследования. В одногрупповом исследовании II фазы оценили эффективность афатиниба у 41 пациента, получавшего предварительно терапию трастузумабом по поводу HER2-позитивного мРМЖ, при среднем количестве до трех линий химиотерапии (интервал 0–15) [26]. В данном исследовании была продемонстрирована значимая клиническая активность:
у 4 пациентов (10%) наблюдался частичный регресс (PR), у 15 пациентов (37%) – стабилизация процесса как наилучший ответ, медиана PFS достигла 15,1 недели (95% ДИ 8,1–16,7). Наиболее частыми побочными явлениями 3-й степени были диарея и сыпь. В настоящее время продолжаются исследования, оценивающие эффективность афатиниба при HER2-позитивном РМЖ. В исследовании III фазы (LUX-Breast 1, NCT01125566) пациенты с HER2-позитивным мРМЖ были рандомизированы на получение комбинации «афатиниб + винорелбин» или комбинации «трастузумаб + винорелбин» в качестве первой или второй линии терапии.
T-DM1
T-DM1 является конъюгатом «антитело – лекарственное средство», состоит из DM1 (антимикротрубочковый агент, производное майтансиноида), связанного с трастузумабом через неразрушенные тиоэфирные связи. Т-DM1 доставляет данный сильнодействующий цитотоксический агент непосредственно к HЕR2-экспрессирующим клеткам. Как только Т-DM1 связывается с HER2 на поверхности клетки, комплекс T-DM1-HER2 активируется, и антитело-компонент протеолитически разрушается, выпуская DM1 в цитоплазму [27]. Важно отметить, что T-DM1 сохраняет биологическую активность трастузумаба (то есть блокаду HER2-сигнального пути и индукцию антителозависимой клеточной цитотоксичности) [28]. Эти свойства являются биологическим основанием для дальнейшего изучения T-DM1 при HER2-позитивном РМЖ.
В исследовании I фазы, включающем 24 пациента с поздними стадиями HER2-позитивного РМЖ, получавших предварительно интенсивное лечение (в среднем до 4 первичных химиотерапевтических агентов при метастатическом заболевании), оценивали безопасность и переносимость T-DM1 в трехнедельном режиме с возрастающей дозой [29]. Максимальная переносимая доза Т-DM1 равнялась 3,6 мг/кг, причем преходящая тромбоцитопения была дозолимитирующим проявлением токсичности. Профиль токсичности оказался благоприятным, общими нежелательными явлениями 2-й и более низкой степени являлись тромбоцитопения, повышение уровня трансаминаз, слабость, тошнота и анемия. Были также получены предварительные признаки противоопухолевой активности, при этом показатель CBR (определяемый как объективный ответ и стабилизация болезни в течение шести месяцев) среди 15 пациентов, получавших максимально переносимую дозу, составил 73%. Два последовательных одногрупповых исследования II фазы изучали T-DM1 при HER2-позитивном мРМЖ. В первом из них ОRR составил 25,9% (95% ДИ 18,4–34,4) при независимой оценке 112 интенсивно предлеченных пациентов [30]. Для оценки медианы продолжительности ответа не было получено достаточно доказательств; медиана PFS равнялась 4,6 месяца (95% ДИ 3,9–8,6). Другое исследование II фазы оценивало монотерапию T-DM1 у 110 пациентов с HER2-позитивным мРМЖ, которые ранее получали терапию трастузумабом, лапатинибом, антрациклинами, таксанами и капецитабином (в среднем до семи противоопухолевых препаратов при метастатическом заболевании) [31]. ORR равнялся 34,5% (95% ДИ 26,1–43,9), CBR – 48,2% (95% ДИ 38,8–57,9%), медиана PFS – 6,9 месяца (95% ДИ 4,2–8,4), а средняя длительность ответа составила 7,2 месяца (95% ДИ от 4,6 месяца до показателей, не поддающихся оценке). Оба исследования продемонстрировали благоприятный профиль токсичности. Чаще отмечались побочные явления 1-й и 2-й степени; наиболее частыми побочными явлениями 3-й и более низкой степени токсичности были тромбоцитопения и слабость.
В ходе рандомизированного исследования II фазы 137 ранее не получавших лечения пациентов были рандомизированы на получение или T-DM1, или трастузумаба с доцетакселом [32]. T-DM1 продемонстрировал значимое увеличение mPFS по сравнению с контрольной группой (14,2 и 9,2 месяца, p = 0,035), в то же время не отмечалось никаких существенных различий в показателе ORR
(64% для Т-DM1 против 58% для контрольной группы) или в показателе CBR (75% для Т-DM1 против 81% в контрольной группе). Профиль токсичности Т-DM1 был благоприятным по сравнению с таковым при стандартном лечении, при этом частота нейтропении 3-й или 4-й степени равнялась 5,8% и 61%, а частота алопеции – 4,3% и 67% соответственно.
Недавно были опубликованы положительные результаты рандомизированного исследования III фазы EMILIA (NCT00829166) [33], подтверждающие противоопухолевую активность Т-DM1 при HER2-позитивном мРМЖ. В этом исследовании 991 пациент, ранее получавший трастузумаб и таксаны, был рандомизирован на получение препарата T-DM1 или лапатиниба в сочетании с капецитабином. Независимый анализ показал, что в группе приема T-DM1 отмечалось значительное увеличение показателя беспрогрессивной выживаемости (медиана PFS) по сравнению с группой, леченной комбинацией «лапатиниб + капецитабин» (9,6 и 6,4 месяца, ОР 0,65, 95% ДИ 0,55–0,77, р < 0,001). Показатель ORR также был выше в группе, получавшей T-DM1 (43,6% и 30,8% соответственно, р < 0,001), так же как и медиана длительности ответа (12,6 месяца против 6,5 месяца). Во втором промежуточном анализе значение медианы ОS превзошло пороговое значение отсутствия эффективности (30,9 и 25,1 месяца соответственно, ОР 0,68, 95% ДИ 0,55–0,85, р < 0,001) в группе приема T-DM1. Частота токсичных явлений 3-й или 4-й степени в общем была ниже в группе, получавшей T-DM1 (41% против 57%). На фоне терапии T-DM1 чаще отмечали случаи тромбоцитопении и повышения уровня печеночных ферментов и реже – диареи, тошноты, рвоты и ладонно-подошвенного синдрома по сравнению с группой, получавшей комбинацию «лапатиниб + капецитабин».
Несмотря на то что результаты исследования EMILIA продемонстрировали достоверные доказательства в пользу применения T-DM1 в качестве препарата выбора во второй линии терапии HER2-позитивного мРМЖ, было инициировано еще одно рандомизированное исследование III фазы MARIANNE (NCT01120184), в котором предпринята попытка доказать возможность использования Т-DM1 в первой линии терапии. В исследовании MARIANNE, включающем 1092 пациента, сравнивается эффективность комбинаций «T-DM1 + пертузумаб», «T-DM1 + плацебо» и «трастузумаб + таксаны». Еще одно исследование III фазы TH3RESA (NCT01419197) оценивает эффективность T-DM1 в третьей и последующих линиях терапии. В этой работе пациенты с HER2-позитивным мРМЖ, получавшие ранее трастузумаб, лапатиниб или химиотерапию, были рандомизированы на получение T-DM1 или терапии по выбору врача. Другие продолжающиеся в настоящее время исследования II фазы изучают возможность и/или противоопухолевый потенциал Т-DM1 в адъювантной (NCTO1196052) и неоадъювантной терапии (NCT01745965) HER2-позитивного РМЖ.
Блокаторы PI3K/Akt/mTOR-сигнального пути
PI3K/Akt/mTOR представляет собой внутриклеточный путь передачи сигнала, дерегулирующийся при РМЖ и потенциально отвечающий за развитие резистентности к анти-HER2-блокирующим агентам [34]. На сегодняшний день эверолимус и его аналоги представляют собой наиболее клинически значимые таргетные препараты, направленные на данный сигнальный путь. В исследовании I фазы проводилось изучение триплета эверолимуса с паклитакселом и трастузумабом, применяющимся еженедельно у 33 пациентов, получавших предварительное лечение (медиана двух линий химиотерапии при мРМЖ в диапазоне от 0 до 17 линий) по поводу HER2-позитивного мРМЖ [35]. Были продемонстрированы обнадеживающие показатели противоопухолевой активности, при этом при длительности контроля заболевания в течение 6 месяцев или менее данный показатель составил 74% и значение медианы PFS достигало 34 недель (95% ДИ 29,1–40,7). Нейтропения 3-й и 4-й степени являлась наиболее распространенным проявлением токсичности (17 пациентов; 52%). В другом исследовании I фазы проводили оценку комбинации эверолимуса с винорелбином и трастузумабом у подобной популяции из 47 пациентов. Показатель ORR достиг 19,1%, срок наблюдения составил 6 или менее месяцев в 83% случаев, медиана PFS равнялась 30,7 недели (95% ДИ 28–44,9) [36]. Нейтропения (92%) и стоматит (70%) любой степени были наиболее частыми побочными явлениями. Результаты оценки двойной комбинации эверолимуса с трастузумабом при мРМЖ были получены в ходе объединенного анализа (47 пациентов) двух исследований I/II фазы, проводимых одновременно: показатель CBR равнялся 34%, медиана PFS – 4,1 месяца. В качестве наиболее частых побочных явлений регистрировали слабость, инфекционные осложнения и мукозиты [37]. В настоящее время продолжаются 2 исследования III фазы, в ходе которых изучают эффективность эверолимуса при HER2-позитивном мРМЖ: исследование BOLERO-1 (NCT00876395), оценивающее эффективность триплета «эверолимус + трастузумаб + паклитаксел» в первой линии терапии, и исследование BOLERO-3 (NCT01007942), оценивающее дополнительное значение винорелбина в комбинации с двумя таргетными агентами у пациентов, предварительно получавших лечение. Важно отметить, что клиническая активность аналогов эверолимуса объясняется молекулярным механизмом их действия, который заключается в ингибировании mTORC1, в то время как mTORC2 остается неповрежденным [38]. Для преодоления этого ограничения в настоящее время проводятся исследования целого ряда таргетных препаратов, блокирующих различные молекулярные компоненты сигнального пути PI3K/Akt/mTOR при HER2-позитивном РМЖ, а именно панблокаторы PI3K, блокаторы селективных изоформ PI3K, селективные блокаторы mTORC1/2, двойные блокаторы РI3К/mTOR и ингибиторы Akt [39].
Другие экспериментальные стратегии анти-HER2-блокады
Понимание молекулярной биологии HER2-позитивного РМЖ в сочетании с уточнением молекулярных механизмов резистентности к HER2-блокирующим агентам может привести к разработке эффективных таргетных препаратов. Продолжающиеся исследования комбинированного применения анти-HER2-таргетных агентов с соединениями, блокирующими другие сигнальные пути, должны в дальнейшем улучшить клинические исходы у пациентов с HER2-позитивным РМЖ. Представляется перспективным сочетание анти-HER2-терапии с препаратами, блокирующими рецептор инсулиноподобного фактора роста 1 (IGF-1R). Перекрестный механизм HER2 и IGF-1R хорошо изучен. Ингибирование IGF-1R восстанавливает чувствительность к трастузумабу, что подтверждено в доклинических исследованиях [40, 41]. В настоящее время продолжаются клинические испытания, оценивающие эту гипотезу.
Другим рациональным подходом считается комбинированная блокада HER2 и SRC. SRC представляет собой не связанную с клеточным рецептором тирозинкиназу и является одним из общих механизмов развития резистентности к трастузумабу, как приобретенной, так и развившейся de novo [42]. Блокирование SRC в комбинации с трастузумабом показывает повышенную синергическую противоопухолевую эффективность трастузумаба при трастузумаб-резистентных опухолях in vivo, что свидетельствует о потенциальной клинической значимости данного подхода. HER3, как уже было показано в доклинических испытаниях, является еще одной рациональной молекулярной мишенью при HER2-позитивном РМЖ. HER3 может быть потенциальным активатором PI3K/Akt-сигнального пути, и, как было показано, его активация происходит при HER2-блокаде [43]. Недавно были получены данные о том, что двойная HER2-блокада не полностью выключает функцию HER3 в клетках HER2-позитивного РМЖ, и, таким образом, добавление анти-HER3-таргетных моноклональных антител к двойной комбинации трастузумаба и пертузумаба или трастузумаба и лапатиниба может привести к увеличению противоопухолевой активности [44].
Заключение
Вышеупомянутые данные подчеркивают противоопухолевый потенциал вновь разработанных анти-HER2-таргетных препаратов при HER2-позитивном РМЖ. Двойная HER2-блокада привела к клиническому успеху как при неоадъювантной терапии, так и при терапии мРМЖ. Изучение новых анти-HER2-конъюгатов «антитело – лекарственное средство» будет способствовать разработке новых вариантов лечения для таких пациентов, достигая потенциальной эффективности химиотерапии в сочетании с HER2-блокадой. Дальнейшие варианты лечения должны быть направлены на изучение молекулярных механизмов преодоления резистентности к анти-HER2-агентам. Тем не менее остается ряд нерешенных вопросов. В частности, не ясно, как выбрать лучшую оптимальную стратегию HER2-блокады для конкретного пациента. Очевидно, что для ответа на этот вопрос необходима разработка надежных предсказательных биомаркеров. На сегодняшний день только HER2 остается подходящим биомаркером для выбора тактики анти-HER2-терапии. В недавнем анализе исследования CLEOPATRA не обнаружено других признаков для применения в качестве индивидуальных предсказательных маркеров [45].
Еще один актуальный вопрос: какие пациенты могут быть эффективно лечены анти-HER2-препаратами без добавления цитотоксической химиотерапии? Последние данные показывают, что позитронно-эмиссионная томография с 18F-фтордезоксиглюкозой (ФДГ-ПЭТ/КТ) может служить ценным диагностическим методом для достижения этой цели. В исследовании NEO-ALTTO при помощи ПЭТ оценивали способность картины метаболической реакции в опухоли предсказывать полный патоморфологический регресс (pCR) к моменту хирургического лечения при применении анти-HER2-терапии; частота pCR была в 2 раза выше у пациентов, у которых регистрировался ответ по данным ФДГ-ПЭТ/КТ (с использованием критериев Европейской организации по исследованию и лечению рака – European Organization for Research and Treatment of Cancer (EORTC) [46]) по сравнению с пациентами, у которых не наблюдалось ответа (41% против 21% при ПЭТ/КТ, выполненной после 2 недель анти-HER2-терапии без химиотерапии) [47]. Полагаясь на эти многообещающие результаты, Международная группа по изучению рака молочной железы (Breast International Group – BIG) планирует исследование DREAM с целью определения наиболее эффективной HER2-таргетной стратегии и раннего выявления группы пациентов, которые потенциально могли бы избежать назначения системной химиотерапии.
Перечислим еще несколько вопросов, ожидающих своего решения. Какова оптимальная последовательность лечения среди всего многообразия вариантов терапии, постоянно появляющихся в арсенале врача? Возможно ли для дальнейшего улучшения противоопухолевой эффективности двойной анти-HER2-блокирующей терапии использовать либо триплеты анти-HER2-препаратов, либо добавлять другие агенты, влияющие на механизмы анти-HER2-резистентности? Наконец, будут ли определены более эффективные анти-HER2-режимы адъювантной терапии с приемлемым профилем токсичности? Ответы на эти вопросы можно получить только при надлежащем проведении широкомасштабных клинических испытаний, что представляется затруднительным в условиях ограниченного финансирования национальных проектов здравоохранения.
Тем не менее очевидно, что необходимо дальнейшее развитие новых направлений более эффективного лечения HER2-позитивного РМЖ.
1. Семиглазов В.Ф., Семиглазов В.В., Манихас А.Г. Химиотерапия и таргетная терапия. М.: МЕДпресс-информ, 2012. 360 с.
2. Yarden Y., Sliwkowski M.X. Untangling the ErbB signalling network // Nat. Rev. Mol. Cell Biol. 2001. Vol. 2. № 2. P. 127–137.
3. Slamon D.J., Clark G.M., Wong S.G. et al. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene // Science. 1987. Vol. 235. № 4785. P. 177–182.
4. Arteaga C.L., Sliwkowski M.X., Osborne C.K. et al. Treatment of HER2-positive breast cancer: current status and future perspectives // Nat. Rev. Clin. Oncol. 2011. Vol. 9. № 1. P. 16–32.
5. Xia W., Gerard C.M., Liu L. et al. Combining lapatinib (GW572016), a small molecule inhibitor of ErbB1 and ErbB2 tyrosine kinases, with therapeutic anti-ErbB2 antibodies enhances apoptosis of ErbB2-overexpressing breast cancer cells // Oncogene. 2005. Vol. 24. № 41. P. 6213–6221.
6. Scaltriti M., Verma C., Guzman M. et al. Lapatinib, a HER2 tyrosine kinase inhibitor, induces stabilization and accumulation of HER2 and potentiates trastuzumab-dependent cell cytotoxicity // Oncogene. 2009. Vol. 28. № 6. P. 803–814.
7. Blackwell K.L., Burstein H.J., Storniolo A.M. et al. Overall survival benefit with lapatinib in combination with trastuzumab for patients with human epidermal growth factor receptor 2-positive metastatic breast cancer: final results from the EGF104900 Study // J. Clin. Oncol. 2012. Vol. 30. № 21. P. 2585–2592.
8. Baselga J., Bradbury I., Eidtmann H. et al. Lapatinib with trastuzumab for HER2-positive early breast cancer (NeoALTTO): a randomised, open-label, multicentre, phase 3 trial // Lancet. 2012. Vol. 379. № 9816. P. 633–640.
9. Guarneri V., Frassoldati A., Bottini A. et al. Preoperative chemotherapy plus trastuzumab, lapatinib, or both in human epidermal growth factor receptor 2-positive operable breast cancer: results of the randomized phase II CHER-LOB study // J. Clin. Oncol. 2012. Vol. 30. № 16. P. 1989–1895.
10. Chang J.C.N., Mayer I.A., Forero-Torres A. et al. TBCRC 006: a multicenter phase II study of neoadjuvant lapatinib and trastuzumab in patients with HER2-overexpressing breast cancer // J. Clin. Oncol. 2011. Vol. 29. № 15. Suppl. Abstr. 505.
11. Bozovic I., Capelan M., de Azambuja E. Breast International Group. Newsletter: accrual target reached and changes after IDMC recommendation. December, 2011 // http://www.breastinternationalgroup.
12. Franklin M.C., Carey K.D., Vajdos F.F. et al. Insights into ErbB signaling from the structure of the ErbB2-pertuzumab complex // Cancer Cell. 2004. Vol. 5. № 4. P. 317–328.
13. Scheuer W., Friess T., Burtscher H. et al. Strongly enhanced antitumor activity of trastuzumab and pertuzumab combination treatment on HER2-positive human xenograft tumor models // Cancer Res. 2009. Vol. 69. № 24. P. 9330–9336.
14. Portera C.C., Walshe J.M., Rosing D.R. et al. Cardiac toxicity and efficacy of trastuzumab combined with pertuzumab in patients with [corrected] human epidermal growth factor receptor 2-positive metastatic breast cancer // Clin. Cancer Res. 2008. Vol. 14. № 9. P. 2710–2716.
15. Baselga J., Gelmon K.A., Verma S. et al. Phase II trial of pertuzumab and trastuzumab in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer that progressed during prior trastuzumab therapy // J. Clin. Oncol. 2010. Vol. 28. № 7. P. 1138–1144.
16. Lenihan D., Suter T., Brammer M. et al. Pooled analysis of cardiac safety in patients with cancer treated with pertuzumab // Ann. Oncol. 2012. Vol. 23. № 3. P. 791–800.
17. Baselga J., Cortés J., Kim S.B. et al. Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer // N. Engl. J. Med. 2012. Vol. 366. № 2. P. 109–119.
18. Swain S.M., Kim S., Cortes J. et al. Confirmatory overall survival (OS) analysis of CLEOPATRA: a randomized, double-blind, placebo-controlled phase III study with pertuzumab (P), trastuzumab (T), and docetaxel (D) in patients (pts) with HER2-positive first-line (1L) metastatic breast cancer (MBS) // San Antonio Breast Cancer Symposium. 2012. Abstr. P5-18-26.
19. Gianni L., Pienkowski T., Im Y.H. et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial // Lancet Oncol. 2012. Vol. 13. № 1. P. 25–32.
20. Schneeweiss A., Chia S., Hickish T. et al. Neoadjuvant pertuzumab and trastuzumab concurrent or sequential with an anthracycline-containing or concurrent with an anthracycline-free standard regimen: a randomized phase II study (TRYPHAENA) // Cancer Res. 2011. Vol. 71. Suppl. 24. P. 112s.
21. Burstein H.J., Sun Y., Dirix L.Y. et al. Neratinib, an irreversible ErbB receptor tyrosine kinase inhibitor, in patients with advanced ErbB2-positive breast cancer // J. Clin. Oncol. 2010. Vol. 28. № 8. P. 1301–1307.
22. Swaby R., Blackwell K., Jiang Z. et al. Neratinib in combination with trastuzumab for the treatment of advanced breast cancer: a phase I/II study // J. Clin. Oncol. 2009. Vol. 27. Suppl. 15S. Abstr. 1004.
23. Jankowitz R., Abraham J., Tan A.R. et al. A phase I dose-escalation study evaluating weekly paclitaxel with neratinib and trastuzumab in women with metastatic HER2-positive breast cancer, NSABP FB-8 // J. Clin. Oncol. 2012. Vol. 30. № 15. Suppl. Abstr. 611.
24. Gajria D., King T., Pannu H. et al. Combined inhibition of mTORC1 with Temsirolimus and HER2 with Neratinib: a phase I/II study in patients with metastatic HER2-amplified or triple-negative breast cancer // Cancer Res. 2011. Vol. 71. Suppl. P. PD09–08.
25. Martin M., Bonneterre J., Geyer C.E. Jr. et al. A phase 2, randomized, open-label study of neratinib (HKI 272) vs lapatinib plus capecitabine for 2nd/3rd-line treatment of HER2+ locally advanced or metastatic breast cancer // San Antonio Breast Cancer Symposium. 2011. Abstr. S5–7.
26. Hickish T., Wheatley D., Lin N. et al. Use of BIBW 2992, a novel irreversible EGFR/HER 1 and HER2 tyrosine kinase inhibitor to treat patients with HER2-positive metastatic breast cancer after failure of treatment with trastuzumab // J. Clin. Oncol. 2009. Vol. 27. Suppl. 15S. Abstr. 1023.
27. Erickson H.K., Park P.U., Widdison W.C. et al. Antibody-maytansinoid conjugates are activated in targeted cancer cells by lysosomal degradation and linker-dependent intracellular processing // Cancer Res. 2006. Vol. 66. № 8. P. 4426–4433.
28. Lewis Phillips G.D., Li G., Dugger D.L. et al. Targeting HER2-positive breast cancer with trastuzumab-DM1, an antibody-cytotoxic drug conjugate // Cancer Res. 2008. Vol. 68. № 22. P. 9280–9290.
29. Krop I.E., Beeram M., Modi S. et al. Phase I study of trastuzumab-DM1, an HER2 antibody-drug conjugate, given every 3 weeks to patients with HER2-positive metastatic breast cancer // J. Clin. Oncol. 2010. Vol. 28. № 16. P. 2698–2704.
30. Burris H.A. 3rd, Rugo H.S., Vukelja S.J. et al. Phase II study of the antibody drug conjugate trastuzumab-DM1 for the treatment of human epidermal growth factor receptor 2 (HER2)-positive breast cancer after prior HER2-directed therapy // J. Clin. Oncol. 2011. Vol. 29. № 4. P. 398–405.
31. Krop I.E., LoRusso P., Miller K.D. et al. A phase II study of trastuzumab emtansine in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer who were previously treated with trastuzumab, lapatinib, an anthracycline, a taxane, and capecitabine // J. Clin. Oncol. 2012. Vol. 30. № 26. P. 3234–3241.
32. Perez E.A., Dirix L., Kocsis J. et al. Efficacy and safety of trastuzumab-DM1 versus trastuzumab plus docetaxel in HER2-positive metastatic breast cancer patients with no prior chemotherapy for metastatic disease: preliminary results of a randomized, multicenter, open-label phase 2 study // 35th ESMO Congress. 2010. Abstr. LBA3.
33. Verma S., Miles D., Gianni L. et al. Trastuzumab emtansine for HER2-positive advanced breast cancer // N. Engl. J. Med. 2012. Vol. 367. № 19. P. 1783–1791.
34. Berns K., Horlings H.M., Hennessy В.Т. et al. A functional genetic approach identifies the PI3K pathway as a major determinant of trastuzumab resistance in breast cancer // Cancer Cell. 2007. Vol. 12. № 4. P. 395–402.
35. Andre F., Campone M., O’Regan R. et al. Phase I study of everolimus plus weekly paclitaxel and trastuzumab in patients with metastatic breast cancer pretreated with trastuzumab // J. Clin. Oncol. 2010. Vol. 28. № 34. P. 5110–5115.
36. Jerusalem G., Fasolo A., Dieras V. et al. Phase I trial of oral mTOR inhibitor everolimus in combination with trastuzumab and vinorelbine in pre-treated patients with HER2-overexpressing metastatic breast cancer // Breast Cancer Res. Treat. 2011. Vol. 125. № 2. P. 447–455.
37. Morrow P.K., Wulf G.M., Ensor J. et al. Phase I/II study of trastuzumab in combination with everolimus (RAD001) in patients with HER2-overexpressing metastatic breast cancer who progressed on trastuzumab-based therapy // J. Clin. Oncol. 2011. Vol. 29. № 23. P. 3126–3132.
38. O’Reilly K.E., Rojo F., She Q.B. et al. mTOR inhibition induces upstream receptor tyrosine kinase signaling and activates Akt // Cancer Res. 2006. Vol. 66. № 3. P. 1500–1508.
39. Sledge G.W., Cardoso F., Winer E.P. et al. A Dickens tale of the treatment of advanced breast cancer: the past, the present, and the future // ASCO Educational Book. 2012. P. 28–38.
40. Nahta R., Yuan L.X., Zhang B. et al. Insulin-like growth factor-I receptor/human epidermal growth factor receptor 2 heterodimerization contributes to trastuzumab resistance of breast cancer cells // Cancer Res. 2005. Vol. 65. № 23. P. 11118–11128.
41. Huang X., Gao L., Wang S. et al. Heterotrimerization of the growth factor receptors erbB2, erbB3, and insulin-like growth factor-i receptor in breast cancer cells resistant to herceptin // Cancer Res. 2010. Vol. 70. № 3. P. 1204–1214.
42. Zhang S., Huang W.C., Li P. et al. Combating trastuzumab resistance by targeting SRC, a common node downstream of multiple resistance pathways // Nat. Med. 2011. Vol. 17. № 4. P. 461–469.
43. Garrett J.T., Olivares M.G., Rinehart C. et al. Transcriptional and posttranslational up-regulation of HER3 (ErbB3) compensates for inhibition of the HER2 tyrosine kinase // Proc. Natl. Acad. Sci. U.S.A. 2011. Vol. 108. № 12. P. 5021–5026.
44. Garrett J.T., Sutton C.R., Kuba M.G. et al. Dual blockade of HER2 in HER2-overexpressing tumor cells does not completely eliminate HER3 function // Clin. Cancer Res. 2013. Vol. 19. № 3. P. 610–619.
45. Baselga J., Cortes J., Im S.A. et al. Biomarker analyses in CLEOPATRA: a phase III, placebo-controlled study of pertuzumab in HER2-positive, first-line metastatic breast cancer (MBC) // Abstracts: 35th Annual CTRC-AACR San Antonio Breast Cancer Symposium. San Antonio, TX: American Association for Cancer Research, 2012. Abstr. S5-1.
46. Young H., Baum R., Cremerius U. et al. Measurement of clinical and subclinical tumour response using [18F]-fluorodeoxyglucose and positron emission tomography: review and 1999 EORTC recommendations. European Organization for Research and Treatment of Cancer (EORTC) PET Study Group // Eur. J. Cancer. 1999. Vol. 35. № 13. P. 1773–1782.
47. Gamez C., Flamen P., Holmes E. et al. FDG-PET/CT for early prediction of response to neoadjuvant lapatinib, trastuzumab, and their combination in HER2 positive breast cancer patients: the Neo-ALTTO PET study results // Eur. J. Cancer. 2011. Vol. 47. Suppl. 1. Р. S333–S334.
Novel opportunities for treatment of HER2-positive breast cancer
V.F. Semiglazov, V.V. Semiglazov, K.S. Nikolayev, G.A. Dashyan, R.M. Paltuyev, R.V. Donskikh
Petrov Research Institute of Oncology, St. Petersburg
St. Petersburg Pavlov State Medical University
N.A. Semashko Railroad Hospital of the Russian Railways JSC, St. Petersburg
Contact person: Vladimir Fyodorovich Semiglazov, vsemiglazov@mail.ru
Despite efficacy of trastuzumab in adjuvant therapy of HER2-positive breast cancer (BC) there are patients who develop recurrences, and if distant metastases are present then therapeutic resistance develop inevitably. Clinical data on investigative HER2-targeting drugs are presented in the review and biological background for designing agents aimed at overcoming anti-HER2-resistance is described. Currently, a number of HER2-targeting agents go through a clinical study stage, e.g. monoclonal antibodies, molecules and antibody-drug conjugates. A concept of a double anti-HER blockade has been already introduced into clinical practice, and pertuzumab combined with trastuzumab and docetaxel was approved as a first line therapy of metastatic BC. An active agent T-DM1 which is an antibody-drug conjugate now undergoes a clinical trial. Some molecular mechanisms of resistance to HER2 blockers as therapeutic targets are being investigated; novel experimental compounds are being developed.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.