Ландшафт мутаций генов эпидермального фактора роста у больных раком легкого в Республике Башкортостан
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – определить частоту различных типов EGFR-мутаций в Республике Башкортостан.
Материал и методы. В работе оценивались результаты исследования EFGR-мутаций среди пациентов с метастатической или местнораспространенной неплоскоклеточной формой РЛ за период 2016–2019 гг. Материалом для исследования служили биоптаты опухоли и плазма крови, когда тканевая биопсия была невозможна. Исследование диагностического материала выполнялось с помощью ПЦР-анализа на основные мутации ex19del, L858R и редкие мутации L861Q, G719X, ex20ins и S768I. Всего протестировано 1135 образцов.
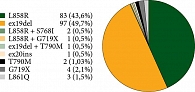
В 195 (17,2%) случаях обнаружена EGFR-мутация. При анализе различных мутаций в гене EGFR ex19del выявлена у 97 (49,7%) пациентов, L858R – у 83 (42,6%), L861Q – у трех (1,5%), G719X – у четырех (2,1%), ex20ins – у одного (0,5%). Мутация S768I определена в двух (1,03%) случаях, причем в обоих совместно с ко-мутацией L858R. Еще у трех пациентов имела место комбинация мутаций ex19del + T790M, L858R + G719X и L858R + L861Q. Среди пациентов, никогда не получавших лечение, у двух (1,03%) выявлена мутация T790M.
Заключение. Из полученных результатов мутационного ландшафта EGFR-мутаций при аденокарциноме легкого следует, что возникновение соматических мутаций обусловлено территориальной особенностью населения и характером воздействия канцерогенных факторов. Согласно результатам анализа частоты выявления мутаций в гене EGFR, для жителей Республики Башкортостан свойственны территориальные особенности. Принимая во внимание высокую эффективность ингибиторов тирозинкиназы, при выявлении конкретных мутаций в гене EGFR следует назначать соответствующие таргетные препараты с учетом драйверных мутаций.
Цель исследования – определить частоту различных типов EGFR-мутаций в Республике Башкортостан.
Материал и методы. В работе оценивались результаты исследования EFGR-мутаций среди пациентов с метастатической или местнораспространенной неплоскоклеточной формой РЛ за период 2016–2019 гг. Материалом для исследования служили биоптаты опухоли и плазма крови, когда тканевая биопсия была невозможна. Исследование диагностического материала выполнялось с помощью ПЦР-анализа на основные мутации ex19del, L858R и редкие мутации L861Q, G719X, ex20ins и S768I. Всего протестировано 1135 образцов.
В 195 (17,2%) случаях обнаружена EGFR-мутация. При анализе различных мутаций в гене EGFR ex19del выявлена у 97 (49,7%) пациентов, L858R – у 83 (42,6%), L861Q – у трех (1,5%), G719X – у четырех (2,1%), ex20ins – у одного (0,5%). Мутация S768I определена в двух (1,03%) случаях, причем в обоих совместно с ко-мутацией L858R. Еще у трех пациентов имела место комбинация мутаций ex19del + T790M, L858R + G719X и L858R + L861Q. Среди пациентов, никогда не получавших лечение, у двух (1,03%) выявлена мутация T790M.
Заключение. Из полученных результатов мутационного ландшафта EGFR-мутаций при аденокарциноме легкого следует, что возникновение соматических мутаций обусловлено территориальной особенностью населения и характером воздействия канцерогенных факторов. Согласно результатам анализа частоты выявления мутаций в гене EGFR, для жителей Республики Башкортостан свойственны территориальные особенности. Принимая во внимание высокую эффективность ингибиторов тирозинкиназы, при выявлении конкретных мутаций в гене EGFR следует назначать соответствующие таргетные препараты с учетом драйверных мутаций.
![Рис. 1. Доля известных драйверных мутаций при различных типах НМРЛ [1]](/upload/resize_cache/iblock/6c8/195_350_1/Neretdinov1.jpg)
![Рис. 2. Erk-клеточный сигнальный путь [2]](/upload/resize_cache/iblock/2ac/195_350_1/Neretdinov2.jpg)
![Рис. 4. Доля редких мутаций в структуре всех EGFR-мутаций [6]](/upload/resize_cache/iblock/f65/195_350_1/Neretdinov4.jpg)
![Рис. 5. Доля редких мутаций в структуре всех EGFR-мутаций [7]](/upload/resize_cache/iblock/f94/195_350_1/Neretdinov5.jpg)
Введение
Все виды злокачественных новообразований, в том числе рак легкого (РЛ), имеют гетерогенную природу и вызываются соматическими мутациями. Однако понимание биологических процессов, порождающих эти мутации, ограниченно. В канцерогенезе важную роль играют генетические факторы и внешние канцерогены. Соматические мутации определяют развитие как канцерогенеза, так и чувствительности РЛ к препаратам, что представляет сложную и многогранную проблему клинической онкологии. С учетом наличия мутаций практикующему врачу при лечении пациентов с РЛ особое внимание необходимо уделять чувствительности опухолевой ткани к противоопухолевым препаратам. Тем не менее при генерализованных формах рака выбор схемы системной лекарственной терапии осложняется.
При метастатическом РЛ на фоне применения любой схемы противоопухолевой лекарственной терапии следует учитывать наличие драйверных мутаций, играющих основную роль в канцерогенезе и назначении лекарственных препаратов.
Несмотря на очевидную связь продолжительности жизни пациента с возникновением соматических мутаций, сведения о генетических факторах детерминации точечных мутаций и мутационном ландшафте крайне ограниченны. Известно, что РЛ ассоциирован с возрастом и имеет многофакторную природу, обусловленную генетическими и эпигенетическими изменениями, что определяет ландшафт проявления соматических мутаций.
Одна из ведущих ролей в онкогенезе опухолей легкого принадлежит повреждению рецепторов тирозинкиназ. Так называемые драйверные мутации приводят к перманентной активации сигнальных путей и, как следствие, ингибированию апоптоза, неконтролируемому росту и размножению клеток. До 60% аденокарцином и 50–80% плоскоклеточного РЛ имеют известные онкогенные драйверные мутации (рис. 1) [1].
В настоящее время практическое применение имеют лишь мутации в генах EGFR, BRAF, ALK, NTRK и ROS1. Самой частой среди этих мутаций считается мутация в гене EGFR, что вкупе с ее прогностической ценностью как маркера для таргетной терапии определяет важность изучения и диагностики всех EGFR-мутаций.
Актуальность
Семейство рецепторов эпидермального фактора роста (EGFR) относится к тирозинкиназам, представленным в группах HER и ErbB, и включает в себя четыре вида: EGFR (HER1/ErbB1), HER2 (ErbB2), HER3 (ErbB3) и HER4 (ErbB4). Представители данного семейства участвуют в регуляции клеточной пролиферации, клеточной смерти, неоангиогенезе и являются важными звеньями в процессе канцерогенеза. Активация EGFR происходит после соединения с лигандом на внеклеточном домене и запуска двух основных промежуточных сигнальных путей PIK3CA/AKT1/MTOR и RAS/RAF1/MAP2K1/MAPK1 (рис. 2) [2].
Соматические мутации в гене EGFR делают активацию сигнального пути независимой от присутствия лиганда и провоцируют клеточное деление, выживаемость и антиапоптические сигналы. Ингибирование EGFR вызывает усиление регуляции проапоптических молекул, что в конечном итоге способствует активации внутреннего митохондриального апоптического сигнального пути [3].
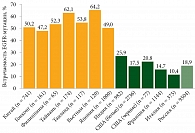
Встречаемость мутации EGFR колеблется среди разных наций: у представителей восточной группы она может достигать 50–60%, западной группы – 10–20%. В России EGFR определяется примерно у 18,9% больных неплоскоклеточным РЛ (рис. 3) [4, 5].
Среди всех типов EGFR-мутаций преобладают две самые частые и наиболее изученные: замена лейцина аргинином в 858-м кодоне 21-го экзона (L858R) и внутрирамковая делеция в 19-м экзоне (del E746_A750 – самая частая). Встречаемость этих мутаций, по данным литературных источников, может составлять 40–50%, тогда как более редкие мутации наблюдаются не более чем в 20% случаев. В частности, по данным S. Byeon и соавт., среди исследованных 1479 пациентов с распространенным неплоскоклеточным РЛ у 758 (50,8%) выявлена делеция в 19-м экзоне, 558 (37,7%) имели L858R-мутацию, 49 (3,3%) – G719X, 49 (3,3) – L861Q, 27 (1,8%) – инсерцию в 20-м экзоне и 17 (1,1%) – S768I (рис. 4) [6]. K. Li и соавт. установили, что в азиатской и европейской популяциях те же показатели распределяются следующим образом: делеция в 19-м экзоне – 40–49 и 46–59%, L858R – 39–47 и 25–38%, G719X – 2–3 и 2,8–3,2%, L861Q – 1,3–1,9 и 3,2%, инсерция в 20-м экзоне – 2,3–4,5 и 4–8%, S768I – 1,3–1,9 и 1,6% соответственно (рис. 5) [7].
Изучению клинической значимости редких мутаций посвящен ряд научных работ. Исследователи установили, что не все подтипы EGFR-мутаций обладают одинаковой чувствительностью к ингибиторам тирозинкиназ (ИТК). Так, в исследовании K. Li и соавт. [7] анализировали чувствительность к терапии мутации G719X. G719X – это точковая мутация, при которой происходит замена глицина в позиции 719 другим остатком: аланином, цистеином, серином. В азиатской и кавказской (европейской) популяциях встречаемость мутации примерно 3%. Самая распространенная и наиболее исследованная мутация в группе редкиx мутаций. Согласно анализу проведенных исследований, частота объективных ответов опухолей с G719X более низкая: примерно 35,1% при использовании ИТК 1-го поколения (эрлотиниб/гефитиниб) [7].
L861Q также является точечной мутацией гена EGFR. В проводимых клинических исследованиях встречаемость мутации примерно 2%. Ее также принято считать чувствительной к терапии ИТК. В работе S. Watanabe и соавт. [8] L861Q в целом не отличалась по результатам терапии ИТК от G719X и составила около 40% объективных ответов среди редких EGFR-мутаций, что ниже ответов на ИТК при стандартных мутациях (62–83%) [9–11].
Встречаемость мутации ex20INS достигает 2–12% среди всех мутаций в гене EGFR [6, 7, 12]. Экзон 20 включает в себя нуклеотиды, которые транслируются в аминокислоту в позициях 762–823, где инсерция способна вызвать активацию лиганд-независимого пути и запустить процесс канцерогенеза. Доклинические и клинические исследования показали, что мутантные опухоли ex20ins (за исключением субтипов EGFR A763_Y764insFQEA) резистентны к ИТК 1-го и 2-го поколений [6, 7, 12].
Мутация S768I – редкая точечная мутация, которая встречается в 0,59–1,9% случаев [13]. В исследовании K. Leventakos и соавт. [13] из девяти выявленных пациентов четыре имели одиночную мутацию S768I, в пяти случаях сопутствовали мутации G719X и L858R. Исследуя эту группу пациентов на чувствительность к эрлотинибу, ученые установили, что собственно мутация не показала эффективности, однако совместно с ко-мутациями G719X и L858R был зарегистрирован противоопухолевый ответ. Тем не менее, на основании результатов метаанализа семи исследований (MERIT, SATURN, TITAN, TRUST, ATLAS, BeTa, FASTACT-2) [14] на чувствительность к эрлотинибу редких EGFR-мутаций, S768I признана относительно чувствительной к эрлотинибу. Интересны данные анализа исследований LUX-Lung 2, LUX-Lung 3 и LUX-Lung 6 [15], которые показывают, что S768I-мутированные опухоли обладают удивительно высокой чувствительностью к терапии афатинибом: частота объективных ответов достигает 100%, а медиана выживаемости без прогрессирования – 14,7 месяца.
Среди представленных данных обращает на себя внимание наличие географической корреляции мутаций гена EGFR, что может быть обусловлено как генетической предрасположенностью, так и воздействием канцерогенов, характерных для рассматриваемых территорий.
Для более глубокого понимания природы развития соматических мутаций, связанных с особенностью воздействия канцерогенов, порождающих эти изменения, необходимо изучить частоту развития конкретных генетических «поломок» в рассматриваемом регионе. Владение информацией о частоте возникновения мутаций в регионе позволит планировать и подбирать эффективные схемы с использованием таргетных препаратов.
Цель нашего исследования – выяснить частоту выявления различных типов EGFR-мутаций, в том числе редких, в Республике Башкортостан.
Материал и методы
Проведен анализ результатов исследования EFGR-мутаций среди пациентов Республики Башкортостан с метастатической или местнораспространенной неплоскоклеточной формой РЛ за период 2016–2019 гг. В регионе все пациенты с подозрением на РЛ для установления диагноза и определения тактики лечения обращаются в Республиканский клинический онкологический диспансер (г. Уфа). Материалом для исследования послужили биоптаты опухоли и плазма крови, когда тканевая биопсия была невозможна. Исследование диагностического материала выполнялось с помощью ПЦР-анализа на основные мутации ex19del, L858R и редкие мутации L861Q, G719X, ex20ins и S768I.
Всего протестировано 1135 образцов. В 195 (17,2%) случаях обнаружена EGFR-мутация, что в целом укладывается в рамки данных крупных статистических анализов. При анализе различных мутаций в гене EGFR ex19del выявлена у 97 пациентов (49,7%), L858R – у 83 (42,6%), L861Q – у трех (1,5%), G719X – у четырех (2,1%), ex20ins – у одного (0,5%) больного. Мутация S768I имела место в двух случаях (1,03%), причем в обоих совместно с ко-мутацией L858R. Еще у трех пациентов также наблюдалась комбинация мутаций ex19del + T790M, L858R + G719X и L858R + L861Q. Среди пациентов, никогда не получавших лечение, у двух (1,03%) выявлена мутация T790M (рис. 6). Y. Liu и соавт., выполнив метаанализ 22 исследований, обнаружили, что прогноз пациентов (по выживаемости без прогрессирования (относительный риск (ОР) 2,23; p < 0,001) и общей выживаемости (ОР 1,55; p = 0,003)) хуже при наличии de novo Т790М-мутации [16].
В исследовании AURA участвовали пять пациентов с мутацией Т790М de novo (у четырех пациентов совместно с L858R и у одного изолированно). У всех пациентов был достигнут частичный ответ при использовании осимертиниба. На момент публикации ответ сохранялся у четырех пациентов. У пятого он сохранялся более года [17].
Всем пациентам с распространенными формами РЛ при наличии EGFR-мутации назначались ИТК.
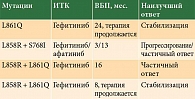
Среди 15 пациентов с редкими мутациями лишь четверо получали терапию ИТК 1-го и 2-го поколений по поводу метастатической аденокарциномы (таблица).
Пациенту с L861Q назначали гефитиниб в качестве первой линии терапии, длительность терапии по состоянию на май 2020 г. составила 24 месяца, наилучший зарегистрированный ответ – стабилизация заболевания, пациент продолжает терапию. Случай лечения EGFR-мутированной опухоли с комбинацией L858R + S768I включает лечение двумя ИТК – гефитинибом и афатинибом. Гефитиниб не показал эффективности: на первом контроле через три месяца терапии зарегистрировано прогрессирование заболевания. Однако терапия афатинибом не только продемонстрировала неплохие показатели выживаемости без прогрессирования – 14 месяцев терапии, но и сопровождалась частичным ответом. Спустя 14 месяцев терапии афатинибом пациент скончался из-за прогрессирования метастазов в головном мозге.
Комбинация L858R + L861Q определена у двух пациентов, получавших терапию ИТК. В первом случае отмечался частичный ответ на терапию гефитинибом в течение 16 месяцев до прогрессирования заболевания, во втором – стабилизация в течение восьми месяцев терапии гефитинибом, пациент продолжает терапию. Среди 15 пациентов с редкими мутациями 11 больных в связи с проведением стандартной химиотерапии и тяжестью состояния лечение ИТК EGFR не получали.
Важно отметить, что осимертиниб также эффективен у пациентов с редкими мутациями. Так, в исследовании KCSG-LU15-09 выявлены следующие типы мутаций: G719A/C/D/S/X (19 (52,8%)), L861Q (9 (25%)), S7681 (8 (22%)) и другие (4 (11%)). Частота объективного ответа составила 77,8% у пациентов с мутацией L861Q, 52,6% – у пациентов с мутациями G719A/C/D/S/X и 37,5% – у пациентов с мутацией S7681 [18].
Все пациенты, которые получали лечение ИТК 1-го и 2-го поколений и у которых на фоне этого лечения отмечалось прогрессирование заболевания, проходили тестирование на T790M. Материалом в данном случае всегда служила плазма крови. За 2016–2019 гг. протестировано 47 пациентов, у девяти из них выявлена мутация T790M, что послужило показанием для назначения ИТК 3-го поколения (осимертиниба). Для сравнения: в других исследованиях частота T790M-позитивных пациентов после прогрессирования заболевания на ИТК 1-го и 2-го поколений оказалась намного выше (30–60%) [19, 20]. Скорее всего такая разница обусловлена сравнительно низкой чувствительностью жидкостной биопсии, а также малым количеством выборки.
Из полученных результатов мутационного ландшафта EGFR-мутаций при аденокарциноме легкого следует, что возникновение соматических драйверных мутаций обусловлено территориальной особенностью населения и характером воздействия канцерогенных факторов. В настоящее время EGFR-тестирование не рассматривается в качестве дополнительной опции. Его проведение позволяет выбрать наиболее эффективную схему терапии. Разнообразие вариантов EGFR-мутаций требует тщательного анализа и дополнительных исследований. Владение необходимой информацией (в частности, о резистентности ex20ins-мутированных опухолей к терапии ИТК, неожиданно высокой чувствительности S768I-мутации (в сочетании с мутацией L858R) к афатинибу) способно существенно повлиять на стратегию лечения и прогноз. Такая информация должна быть отражена в клинических рекомендациях.
Заключение
EGFR-исследование должно войти в рутинные методы исследования пациентов с аденокарциномой легкого во всех учреждениях, в которых осуществляется соответствующее лечение.
Результаты анализа частоты выявления мутаций в гене EGFR среди жителей Республики Башкортостан продемонстрировали характерные территориальные особенности проявления генетических нарушений. Учитывая высокую эффективность терапии препаратами анти-EGFR, при выявлении мутаций следует назначать соответствующие ИТК.
A.F. Nasretdinov, A.V. Sultanbayev, PhD, K.V. Menshikov, PhD, I.R. Minniakhmetov, PhD, M.G. Gordeyev, PhD, N.I. Sultanbayeva, Sh.I. Musin, PhD, A.A. Izmaylov, PhD, D.U. Fattakhova
Republican Clinical Oncological Dispensary, Ufa
Republican Medical and Genetic Center, Ufa
Bashkir State Medical University, Ufa
National Bioservice, LLC, St. Petersburg
Contact person: Aleksandr V. Sultanbayev, rkodrb@yandex.ru
Genetic factors and external carcinogens play an important role in carcinogenesis. This determines the frequency of mutations in the region under consideration. Somatic mutations affect the development of carcinogenesis and sensitivity of lung cancer (LC) to antitumor drugs, which is a complex and multifaceted problem of clinical oncology. In metastatic LC, the presence of driver mutations should be considered against the background of any antitumor drug therapy regimen. It is known that LC is associated with age and has the multifactorial nature of development due to genetic and epigenetic changes, which determines the landscape of somatic mutations.
The aim of the study was to determine the frequency of various types of EGFR mutations in the Republic of Bashkortostan.
Material and methods. We evaluated the results of the study of EFGR mutations in patients with metastatic or locally advanced non-squamous cell lung cancer for the period 2016-2019. The material for the study was tumor biopsies and blood plasma, when tissue biopsy was not possible. The study of diagnostic material was performed using PCR analysis for the main mutations ex19del, L858R and rare mutations L861Q, G719X, ex20ins and S768I. Totally 1,135 samples were tested. Of these, an EGFR mutation was detected in 195 (17.2%) cases. When analyzing various mutations in the EGFR gene, ex19del was detected in 97 (49.7%) patients, L858R – in 83 (42.6%), L861Q – in 3 (1.5%), G719X – in 4 (2.1%), and ex20ins – in 1 (0.5%). The s768i mutation was detected in 2 (1.03%) cases, and in both cases – together with the L858r co-mutation. A combination of ex19del + T790M, L858R + G719X, and L858R + L861Q mutations was also found in 3 other patients. Among patients who have never received treatment, 2 (1.03%) were found to have the T790m mutation.
Conclusion. From the obtained results of the mutational landscape of EGFR mutations in lung adenocarcinoma it can be done the conclusion that the occurrence of somatic mutations is due to the territorial feature of the population and the peculiarity of the impact of carcinogenic factors. According to the results of the analysis of detection of mutations frequency in the EGFR gene, residents of the Republic of Bashkortostan are characterized by territorial features. Taking in account the high effectiveness of tyrosine kinase inhibitors, when identifying specific mutations in the EGFR gene, appropriate targeted drugs should be prescribed, taking into account driver mutations.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.