Клинический опыт применения двойной таргетной блокады (пертузумаб + трастузумаб + доцетаксел) в неоадъювантной терапии раннего HER2-положительного рака молочной железы
- Аннотация
- Статья
- Ссылки
- English
Введение
Как в мире, так и в России рак молочной железы (РМЖ) сохраняет ведущие позиции в структуре заболеваемости злокачественными новообразованиями. В общей структуре онкологической заболеваемости в РФ в 2017 г. РМЖ (11,5%) занимал второе место после рака кожи (12,5%, с меланомой – 14,2%). РМЖ (21,0%) является ведущей онкологической патологией у женского населения РФ [1].
В 2018 г. в Российской Федерации с впервые установленным диагнозом РМЖ поставлено на учет 64 544 больных. В Сибирском федеральном округе зарегистрирована 7971 пациентка, в том числе в Иркутской области – 1165 [2].
Несмотря на то что свыше 70% пациенток имеют раннюю стадию РМЖ [2], смертность от него среди женского населения сохраняется на высоком уровне – почти 30 на 100 тыс. населения [1].
Общая и бессобытийная выживаемость при раннем РМЖ зависит не только от стадии заболевания, но и от молекулярно-биологического подтипа опухоли. Основной фактор высокого риска рецидива – гиперэкспрессия рецептора эпидермального фактора роста человека 2-го типа (HER2) на поверхности опухолевой клетки, относящегося к трансмембранным рецепторам с активностью тирозинкиназы, что является следствием амплификации гена HER2 в 17-й хромосоме [3].
План лечения также зависит от молекулярно-биологического подтипа РМЖ и стадии заболевания. Согласно клиническим рекомендациям RUSSCO, неоадъювантная лекарственная терапия может улучшить безрецидивную и общую выживаемость лишь в случае достижения полного патоморфологического ответа [4].
Анализ результатов крупных клинических иcследований с доступными данными о полном морфологическом ответе (pCR) показал, что стандартные режимы химиотерапии (антрациклины ± таксаны) перед или после операции не демонстрируют достоверных отличий [5].
Добавление трастузумаба (рекомбинантное гуманизированное моноклональное антитело против HER2) к стандартным режимам химиотерапии в неоадъювантном режиме в рамках исследования NOAH значительно увеличивало частоту объективного ответа на лечение – 81 против 73% (р = 0,18) и частоту полных патоморфологических ответов – до 43 против 23% (р = 0,002) [6].
Примерно у 15% больных HER2-положительным РМЖ отмечается первичная или приобретенная резистентность к трастузумабу [7].
С целью преодоления одного из механизмов резистентности к трастузумабу разработано еще одно моноклональное антитело пертузумаб (Перьета). Пертузумаб связывается с доменом II HER2, блокируя лиганд-индуцированную HER2/HER3-гетеродимеризацию (то есть удвоение рецепторов и, как следствие, их активация) [8].
В исследовании NeoSphere оценивали достижение полного патоморфологического ответа при назначении комбинации трастузумаба и доцетаксела с пертузумабом в неоадъювантном режиме. Полный патоморфологический ответ в группе пертузумаба и трастузумаба с доцетакселом отмечался практически в два раза чаще, чем в группе стандартной терапии трастузумабом и доцетакселом. Частота pCR составила 45,8% [9]. На основании проведенных клинических исследований получено разрешение на использование этой схемы в клинической практике и включение ее в стандартное лечение в соответствии с рекомендациями NCCN [10].
Материал и методы исследования
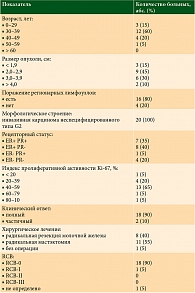
Исследование выполнено на базе Иркутского областного онкологического диспансера. Проведен ретроспективный анализ результатов лечения 20 пациенток, получавших лечение в отделении дневного стационара противоопухолевой лекарственной терапии солидных опухолей Иркутского областного онкологического диспансера в 2017–2019 гг. Основными критериями включения в исследование стали возраст старше 18 лет, наличие раннего HER2-позитивного РМЖ, подтвержденного результатами морфологического исследования (гистологического, иммуногистохимического, генетического), наличие опухоли молочной железы более 2 см или пораженных регионарных лимфоузлов (подтвержденных результатами морфологического исследования – цитологического или гистологического), состояние на момент включения по ECOG 0–1, удовлетворительные лабораторные показатели. У всех пациенток был диагностирован HER2-позитивный РМЖ в стадии IIB–IIIA. Все больные имели по одному и более признаку неблагоприятного прогноза: опухоль более 2 см, метастатическое поражение подмышечных лимфоузлов, эстроген-негативный статус опухоли, высокий индекс пролиферации Ki-67.
Индивидуальные планы лечения пациенток были составлены на основании решения общего мультидисциплинарного консилиума диспансера. Больные получали неоадъювантную терапию по схеме:
1) четыре курса – комбинация с антрациклинами в первый день каждого 21-дневного цикла:
- доксорубицин 60 мг/м2 – внутривенная инфузия;
- циклофосфамид 600 мг/м2 – внутривенная инфузия;
2) четыре курса – комбинация двойной блокады рецептора HER2/neu с доцетакселом в первый день каждого 21-дневного цикла:
- пертузумаб: первое введение, нагрузочная доза – 840 мг в виде внутривенной капельной инфузии в течение 60 минут, со второго введения – в дозе 420 мг;
- трастузумаб: первое введение, нагрузочная доза – 8 мг/кг в виде 90-минутной внутривенной капельной инфузии, далее со второго введения – в дозе 6 мг/кг;
- доцетаксел 75 мг/м2 внутривенно капельно в течение часа.
Лечение проводилось на фоне профилактической антиэметогенной, десенсибилизирующей и дезинтоксикационной инфузионной терапии.
Эффект оценивали клинически в процессе лекарственного противоопухолевого лечения с применением инструментальных методов исследования – рентгенологического (маммография) и ультразвукового. Отмечался полный ответ (исчезновение всех опухолевых очагов, уменьшение лимфоузлов до 10 мм и менее) и частичный ответ (уменьшение опухолевых очагов от 30% и более).
Следует отметить, что достижение полного клинико-рентгенологического ответа опухоли создает некоторые сложности на этапе планирования и выполнения хирургической операции, а также на этапе морфологической оценки лечебного патоморфоза из-за отсутствия макроскопического опухолевого узла и возможности визуального контроля. В связи с этим большинству пациенток провели маркировку первичной опухоли для эффективного контроля опухолевого очага на хирургическом и морфологическом этапах. По окончании неоадъювантного лечения пациенткам выполнено хирургическое вмешательство в объеме радикальной резекции молочной железы, радикальной мастэктомии. На основании заключения гистологического исследования оценивали патоморфологический ответ. Для оценки патоморфологического ответа использовали системы определения методом Лавниковой и систему RCB. Затем в адъювантном режиме назначали терапию исходя из гормонально-рецепторного статуса опухоли и патоморфологического ответа на неоадъювантную терапию.
Критерии полного патоморфологического ответа
Показано, что при использовании разных систем имеют место отличия в оценке частоты полного морфологического регресса, что усложняет прогнозирование эффективности лечения. В клинических рекомендациях Европейского общества онкологов (ESMO) для определения выраженности лечебного эффекта первичного РМЖ приводится система «ложа остаточной опухоли» (Residual Cancer Burden – RCB), подразделяющая изменения от полного патоморфологического ответа (pCR) до выраженной остаточной опухоли [11].
Система RCB – математическая модель, предложенная W. Symmans и соавт. в 2007 г. на основании оценки некоторых характеристик остаточной опухоли и кривых безрецидивной выживаемости больных. Авторы исследования предложили формулу, учитывающую микроскопические размеры ложа опухоли, выраженность инвазивного компонента, рассчитанную на основании процента карциномы in situ и инвазивного рака в опухоли, число лимфатических узлов с метастазами, наибольший диаметр метастаза в лимфоузле [12].
Класс остаточной опухоли (остаточная опухолевая нагрузка):
- RCB-0 (pCR, полный патоморфологический ответ) – значение индекса 0;
- RCB-I (минимальная остаточная опухоль) – менее 1,36, низкий риск прогрессирования заболевания;
- RCB-II (умеренная остаточная опухоль) – 1,36–3,28, промежуточный риск прогрессирования заболевания;
- RCB-III (выраженная остаточная опухоль) – более 3,28, высокий риск прогрессирования заболевания [13].
Результаты
В исследование с июля 2017 по август 2019 г. было включено 20 пациенток, большинство из них (60%) молодого возраста – от 30 до 39 лет. У всех больных наблюдалась стадия IIB либо IIIA, опухоли имели морфологическое строение инвазивной карциномы неспецифицированного типа G2, рецепторный статус различный. У большинства пациенток регистрировался высокий индекс пролиферативной активности Ki-67 (таблица). У одной больной в процессе лечения выявлено метастатическое поражение головного мозга, назначена терапия трастузумабом эмтанзином. 95% пациенток получили восемь курсов неоадъювантной терапии. У 90% больных на фоне лечения клинически достигнут полный ответ. Этим пациенткам выполнено хирургическое лечение, объем оперативного пособия определялся исходным размером опухоли, объемом молочной железы. У всех больных оценивали патоморфологический ответ по системе RCB.
В результате проведенной неоадъювантной терапии с применением двойной таргетной блокады полный патоморфологический ответ pCR достигнут в 90% случаев.
Обсуждение
В рутинную клиническую практику Иркутского областного онкологического диспансера давно вошло определение рецептора эпидермального фактора роста 2-го типа (HER2-статус) на поверхности опухолевых клеток иммуногистохимическим методом и определение амплификации гена HER2 (ERBB2) методом FISH-гибридизации. Для прогнозирования заболевания, подбора адекватной противоопухолевой, в том числе таргетной, терапии необходимо установить молекулярно-биологический подтип опухоли молочной железы, а также индекс пролиферации Ki-67 [14].
При раннем РМЖ особое значение придается неоадъювантной или предоперационной лекарственной терапии – одному из перспективных и активно развивающихся направлений онкологии. Эффективное предоперационное системное лечение модифицирует последующий хирургический этап, способствует элиминации субклинических микрометастазов, а также позволяет оценить чувствительность карциномы к проводимой терапии. Однако основной ее целью является достижение полной морфологической регрессии, выражающейся в повышении выживаемости без прогрессирования и, как следствие, общей выживаемости. Таким образом, для проведения неоадъювантного лечения необходимо подбирать наиболее эффективную схему, при которой достижение pCR будет более вероятным [11].
Добавление трастузумаба к стандартной химиотерапии в неоадъювантном режиме при раннем HER2-позитивном РМЖ изучали в рамках рандомизированного исследования NOAH. 228 пациенток получали химиотерапию: три цикла доксорубицина и паклитаксела, четыре цикла паклитаксела, три цикла циклофосфамида, метотрексата и 5-фторурацила с добавлением или без добавления трастузумаба. В итоге добавление трастузумаба не только достоверно увеличило частоту полных патоморфологических ответов до 81%, но и улучшило показатель бессобытийной трехлетней выживаемости до 71% по сравнению с 56% в группах больных, не получавших трастузумаб [6].
Трастузумаб связывается с субдоменом IV HER2-рецептора, маркирует опухолевую клетку для распознавания естественными киллерами (NK-клетки), а также нарушает работу сигнал-трансдукторных систем внутри клетки, что приводит к прекращению роста клетки и апоптозу [6].
Пертузумаб связывается с внеклеточным доменом II рецептора HER2 опухоли и препятствует димеризации (образованию пар) рецепторов. Пертузумаб и трастузумаб имеют разные точки приложения на рецепторе HER2. Понимание механизма действия пертузумаба позволяет предположить, что пертузумаб и трастузумаб должны использоваться одновременно для блокирования различных субдоменов рецептора HER2 и прерывания нескольких сигнальных путей [8].
В крупном многоцентровом открытом рандомизированном клиническом исследовании II фазы, посвященном оценке эффективности пертузумаба и/или трастузумаба в комбинации с препаратами из группы таксанов в качестве неоадъювантной терапии, NeoSphere (Neoadjuvant Study of Pertuzumab and Herceptinin Early Regimen Evaluation; NCT00545688) доказана достоверно более высокая эффективность комбинации «пертузумаб + трастузумаб + доцетаксел». В рамках исследования 417 пациенток с ранним HER2-позитивным РМЖ были рандомизированы на четыре группы по четыре цикла терапии комбинациями:
- трастузумаб + доцетаксел;
- пертузумаб + трастузумаб + доцетаксел;
- пертузумаб + трастузумаб;
- пертузумаб + доцетаксел.
Наибольшая частота полного патоморфологического ответа наблюдалась в группе триплета – 45,8%. Пятилетняя безрецидивная выживаемость достигла 84%. При этом частота нежелательных явлений была сопоставима во всех группах [9].
Частота pCR во всех группах была на высоком уровне – не только на фоне применения комбинаций цитотоксической терапии с таргетным агентом (доцетаксел + трастузумаб – 29%, доцетаксел + пертузумаб – 24%), но и в группе трастузумаба и пертузумаба (16,8%). Следовательно, добиться полного ответа опухоли удалось в отсутствие цитостатиков, что может оказаться ценным клиническим решением для пациенток с противопоказаниями к назначению химиотерапии. Интересно, что частота полного патоморфологического ответа во всех группах чаще регистрировалась у пациенток с эстроген-отрицательным рецепторным статусом – 63,2% в группе терапии пертузумабом, трастузумабом и доцетакселом [9].
Еще одно крупное многоцентровое рандомизированное исследование II фазы TRYPHAENA (NCT00976989) было посвящено анализу токсичности, прежде всего кардиотоксичности, при назначении комбинации пертузумаба и трастузумаба с одним из трех неоадъювантных режимов:
- одновременное применение пертузумаба, трастузумаба и антрациклин-содержащей химиотерапии;
- антрациклин-содержащая химиотерапия с последующим назначением пертузумаба и трастузумаба;
- отсутствие антрациклинов, назначение анти-HER2-дуплета одновременно с карбоплатином и доцетакселом [12].
По результатам исследования, какого-либо достоверного различия между группами не выявлено. Ни в одной из исследуемых групп не зафиксировано нежелательных явлений со стороны сердечно-сосудистой системы [15].
Выводы
Достижение полной морфологической регрессии опухоли стало рутинным в клинической практике благодаря персонифицированному подходу к терапии, а также активному применению интервенционных технологий на всех этапах лечения.
Актуальным остается вопрос эскалации и деэскалации таргетной терапии раннего РМЖ. Данные международных клинических исследований показывают, что при назначении комбинации пертузумаба и трастузумаба с химиотерапией в неоадъювантном режиме значительно большая доля пациенток достигает полного патоморфологического ответа (в отличие от групп сравнения).
В настоящее время применение двойной таргетной терапии HER2-позитивного раннего РМЖ рассматривается прежде всего при наличии факторов неблагоприятного прогноза, таких как размер опухоли более 2 см, наличие метастатического поражения подмышечных лимфоузлов, эстроген-негативный статус опухоли, высокий индекс пролиферации Ki-67. Высока вероятность, что именно на фоне этой терапии будет достигнут полный патоморфологический ответ [16].
S.S. Sidorova, D.M. Ponomarenko, D.Yu. Yukalchuk, Ye.A. Rybkina, Z.V. Dyakonenko, D.A. Bogomolov, I.D. Klimova
Irkutsk Regional Oncology Dispensary
Contact person: Svetlana S. Sidorova, s_koninina@mail.ru
A retrospective analysis of the results (clinical and pathomorphological response) of treatment of 20 patients received neoadjuvant therapy with the combination of pertuzumab, trastuzumab and docetaxel on the basis of the of Antitumor Drug Therapy of Solid Tumors Hospital Department of the Irkutsk Regional Oncology Dispensary in 2017–2019. Proved the expediency of dual targeted blockade in neoadjuvant mode in patients with early HER2-positive breast cancer with an unfavorable prognosis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.