Новые возможности в лечении бронхиальной астмы
- Аннотация
- Статья
- Ссылки
- English
Введение
Бронхиальная астма (БА) является одним из самых распространенных хронических заболеваний дыхательных путей. По оценкам экспертов Всемирной организации здравоохранения, в настоящее время БА страдает около 235 млн человек. На лечение пациентов с астмой и ассоциированными с ней состояниями, по некоторым данным, расходуется до 10% ресурсов общественного здравоохранения [1]. Распространенность БА среди взрослого населения в разных странах варьируется от 0,7 до 18% (в среднем – 4–9%) [2–5]. БА гетерогенно проявляется в отношении возраста дебюта, триггеров, паттерна воспаления, тяжести клинических проявлений, причины возникновения, разнообразия клинических проявлений и ответа на скоропомощную и базисную терапию.
Несмотря на то что сегодня в клинической практике все реже встречаются пациенты с астматическим статусом, достичь идеального контроля над симптомами заболевания удается далеко не всегда. Как следствие, во всем мире сохраняются высокие показатели госпитализации и нетрудоспособности, влекущие за собой крайне высокие социально-экономические затраты на лечение данной нозологии. Например, в США на лечение пациентов с БА правительство тратит 56 млрд долларов в год [6].
Астма представляет проблему для общественного здравоохранения всех стран независимо от уровня их развития [7]. Причем в экономически развитых государствах за последние три десятилетия число больных с этим диагнозом возросло более чем в три раза [8]. Согласно официальным данным Министерства здравоохранения РФ, количество пациентов с БА в стране достигает 1 млн. При этом, по экспертным оценкам Российского респираторного общества, пациентов с БА около 7 млн [9].
С учетом социально-экономической составляющей в России значимым аспектом являются суммарные затраты на лечение и профилактику БА. Согласно экспертным оценкам, за год они превышают 13 млрд руб. Причем только медицинские затраты за год составляют более 8 млрд руб. [10].
Оптимизация затрат – актуальная задача не только для организаторов здравоохранения, но также для врачей и пациентов. Решить ее можно в том числе за счет более активного применения в клинической практике генерических лекарственных препаратов. Следует отметить, что в отличие от терапии кардиологических, неврологических и других заболеваний в лечении таких социально значимых респираторных заболеваний, как БА и хроническая обструктивная болезнь легких, выбор генериков крайне ограничен.
В настоящее время по-прежнему актуальны и вопросы эффективности терапии и соответственно приверженности ей пациентов. Не всегда и в полном объеме выполняются рекомендации специалиста и не всегда терапия принимается системно и постоянно. Причины неэффективности терапии гетерогенны – от неправильной техники ингаляции, недостаточной дозы лекарственного препарата, недооценки сопутствующей патологии до отсутствия у пациента желания проводить систематическую противоастматическую терапию. Количество пациентов с БА, прибегающих к терапии исключительно «по требованию», увеличивается, что не соответствует тактике лечения согласно Федеральным клиническим рекомендациям и международным рекомендациям. Кроме названных причин немаловажную роль в отсутствии достижения контроля над симптомами БА играет недоступность высокоэффективных препаратов или нерегулярность обеспечения пациентов лекарственными препаратами [11]. При рассмотрении проблемы неэффективности лечения с этих позиций становится очевидной необходимость создания российских генерических препаратов, которые не уступали бы по эффективности зарубежным аналогам и были бы доступны большинству пациентов, нуждающихся в качественной противоастматической терапии [12]. Подобная практика давно введена в Европейских странах, США, странах Юго-Восточной Азии.
В рамках реализации государственной программы «Фарма-2020», Стратегии лекарственного обеспечения населения Российской Федерации на период до 2025 г. и Указа Президента РФ от 7 мая 2012 г. № 598 (пункты 1а и 2б) осуществляется развитие отечественной фармацевтической отрасли с целью доведения объема производства российских лекарственных средств по номенклатуре перечня стратегически значимых лекарственных средств и перечня жизненно необходимых и важнейших лекарственных препаратов до 90% [13, 14].
Российская фармацевтическая компания полного цикла «Натива» – одна из немногих, кто активно участвует в данной государственной программе, курируемой Министерством промышленности и торговли РФ. Компания «Натива» является исполнителем 43 госконтрактов. В 2016 г. в России был зарегистрирован, согласно установленному порядку, лекарственный препарат для терапии БА Формисонид®-натив (порошок для ингаляций; будесонид + формотерол) – первый отечественный генерик иностранного препарата Симбикорт® Турбухалер®.
Для оценки эквивалентности препарата Формисонид®-натив, порошок для ингаляций дозированный (ООО «Натива», Россия), иностранному аналогичному препарату Симбикорт® Турбухалер®, порошок для ингаляций дозированный («АстраЗенека АБ», Швеция), было проведено открытое сравнительное рандомизированное многоцентровое клиническое исследование у пациентов с БА. Цель данного исследования состояла в сравнительной оценке клинической эффективности, безопасности и переносимости препарата Формисонид®-натив (будесонид + формотерол, 320 + 9 мкг/доза), порошок для ингаляций дозированный, и препарата Симбикорт® Турбухалер® (будесонид + формотерол, 320 + 9 мкг/доза), порошок для ингаляций дозированный, у пациентов с неконтролируемой и частично контролируемой персистирующей БА (протокол № FMS-NTV03-2012).
Задачи исследования
- Продемонстрировать достаточное совпадение профиля клинической эффективности исследуемого препарата Формисонид®-натив и препарата сравнения Симбикорт® Турбухалер® в терапии пациентов с неконтролируемой и частично контролируемой персистирующей БА.
- Продемонстрировать достаточное совпадение профиля безопасности и переносимости исследуемого препарата Формисонид®-натив и препарата сравнения Симбикорт® Турбухалер® в терапии пациентов с неконтролируемой и частично контролируемой персистирующей БА.
Центры исследования
- ФГБУ «ГНЦ „Институт иммунологии“ ФМБА России».
- ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России.
- ГУЗ ГКБ № 23 «Медсантруд» Департамента здравоохранения г. Москвы.
- ГБУЗ Ярославской области «Областная клиническая больница».
- ГБОУ ВПО «Ивановская государственная медицинская академия Министерства здравоохранения Российской Федерации».
- ОБУЗ «Ивановская клиническая больница имени Куваевых».
Материал и методы исследования
В исследовании участвовали 100 пациентов обоего пола с неконтролируемой и частично контролируемой персистирующей БА, получавших как минимум в течение четырех месяцев до визита скрининга стабильную базисную терапию БА ингаляционными глюкокортикостероидами (иГКС) в сочетании с бета-2-агонистами длительного действия (ДДБА). Средняя стабильная эквипотентная доза иГКС определялась как эквипотентная доза беклометазона дипропионата от ≥ 500 мкг до ≤ 1000 мкг или эквивалентного препарата.
Ежедневная потребность в бета-2-агонистах короткого действия (КДБА) – не более восьми ингаляций в день в течение двух последовательных дней. Возраст больных – от 18 до 70 лет. В исследование вошли пациенты с показателями теста по контролю над БА по опроснику АСТ (Asthma Control Test) 19 баллов и менее и с показателем Total Score по опроснику ACQ (Asthma Control Questionnaire) более 1.
Пациенты были рандомизированы на две равные группы (по 50 человек), сопоставимые по половозрастным характеристикам. Пациенты первой группы получали Формисонид®-натив, пациенты второй – Симбикорт® Турбухалер®. Общая продолжительность исследования – три месяца (12 недель, 84 ± 2 сут) + 1–7 сут (скрининг) + 5 сут (визит последующего наблюдения безопасности). На протяжении всего исследования каждый пациент обследовался семь раз на семи визитах.
Результаты и обсуждение
Группы пациентов были сопоставимы по половозрастным характеристикам, исходным показателям функции внешнего дыхания (ФВД), сопутствующей патологии. При сравнении начальных характеристик качества жизни между группами зафиксированы достоверные различия данных средних значений опросников АСТ, АСQ, AQLQ. Различие подтверждено результатом непараметрического теста Манна – Уитни (за исключением ACQ).
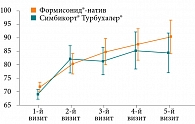
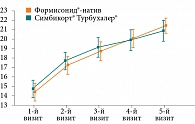
Первым критерием эффективности в данном исследовании была динамика показателей объема форсированного выдоха за 1-ю секунду (ОФВ1) (рис. 1).
Как видно из графика, конечная динамика показателей сопоставима (р < 0,01). Достоверность проверена с применением попарных сравнений значений на каждом визите с начальной величиной ОФВ1 (%). При построении графиков в дальнейшем использовались 95%-ные доверительные интервалы и среднее значение. Незначительные отличия отмечались на втором и третьем визитах, но полностью исчезали к четвертому визиту. Сравнимая эффективность сохранялась до конца лечебного периода. Таким образом, по основному показателю эффективности ОФВ1 (%) исследуемый препарат Формисонид®-натив не уступал оригинальному препарату Симбикорт® Турбухалер®. Иными словами, доказана не меньшая эффективность изучаемого препарата по основному критерию эффективности в случае избрания границы не меньшей эффективности для прироста ОФВ1 7%.
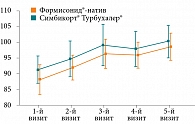
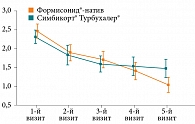
Изменения показателя форсированной жизненной емкости легких (ФЖЕЛ) в группах представлены на рис. 2 и 3. Различий между показателями у пациентов, получавших Формисонид®-натив, и пациентов, применявших Симбикорт® Турбухалер®, при оценке в динамике и конечных значений ФЖЕЛ как в абсолютном, так и в процентном соотношении фактически не установлено.
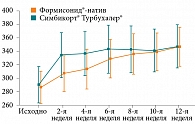
Третьим критерием эффективности терапии служила вариабельность показателей пикфлоуметрии (%) при изучении пиковой скорости выдоха (ПСВ) по данным дневников пациентов обеих групп. На протяжении всего исследования (рис. 4) динамика прироста ПСВ в группах препаратов Формисонид®-натив и Симбикорт® Турбухалер®, а также конечные значения достоверно не различались и становились аналогичными к 12-й неделе исследования. Это свидетельствует о том, что по влиянию на показатель вариабельности ПСВ исследуемый препарат Формисонид®-натив не уступает препарату сравнения Симбикорт® Турбухалер®.
Для сравнения среднесуточной потребности в КДБА использовали тест Манна – Уитни (рис. 5). Различий между группами препаратов Формисонид®-натив и Симбикорт® Турбухалер® не выявлено (р = 0,909).
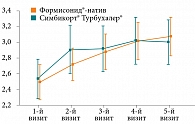
В рамках клинического исследования проведена оценка эффективности лечения с использованием валидизированных опросников АСТ и ACQ. Доля пациентов, достигших уровня контроля более 20 баллов, по результатам теста АСТ, была сопоставима в обеих группах. Клинических различий в динамике между группами, а также конечными значениями не обнаружено. Таким образом, по влиянию на среднее значение уровня контроля БА, по данным опросника ACT, исследуемый препарат Формисонид®-натив не уступает препарату сравнения Симбикорт® Турбухалер® (рис. 6). Анализ индивидуальных дневников также не выявил существенных различий в отношении потребности в КДБА и развития нежелательных явлений (НЯ).
Как следует из данных анализа, к моменту завершения исследования наблюдалась эквивалентность с незначительным различием в динамике между группами, заключавшимся в достижении чуть более лучшего значения контроля БА по опроснику в группе изучаемого препарата (р = 0,004) Формисонид®-натив (рис. 7).
Таким образом, результаты клинического исследования продемонстрировали, что исследуемый препарат Формисонид®-натив не уступает препарату сравнения Симбикорт® Турбухалер® по влиянию на динамику среднего значения по опроснику контроля БА ACQ.
Сходный с предыдущим опросником результат был получен и по опроснику AQLQ(S) (The Standardised Asthma Quality of Life Questionnaire). Установлено различие в динамике между группами: в группе изучаемого препарата достигнуто более высокое конечное значение (р = 0,02).
Таким образом, динамика состояния по опроснику качества жизни больных БА AQLQ(S) в группе препарата Формисонид®-натив была не хуже, чем в группе препарата Симбикорт® Турбухалер®.
Оценка безопасности
В группе препарата Формисонид®-натив зарегистрировано два обострения БА, в группе пациентов, принимавших Симбикорт® Турбухалер®, – три обострения. Повторные обострения не выявлены ни у одного участника исследования.
Таким образом, по количеству обострений и времени до первого обострения группы пациентов, получавших препарат Формисонид®-натив, и пациентов, получавших Симбикорт® Турбухалер®, были сопоставимы.
О безопасности и переносимости препаратов судили по количеству зарегистрированных НЯ, касающихся клинического состояния пациентов, а также отклонений показателей лабораторных и инструментальных методов обследования. Контроль безопасности и переносимости осуществлялся на протяжении всего периода исследования и в ходе последующего наблюдения.
Частота и тяжесть НЯ в группе пациентов, принимавших Формисонид®-натив, достоверно не отличались от таковых в группе препарата сравнения Симбикорт® Турбухалер®.
Дозированный порошковый ингалятор
Для доставки препарата Формисонид®-натив в легкие путем ингалирования используется оригинальный для РФ ингалятор Инхалер CDM (CDM-Haler®), разработанный и запатентованный немецким и английским инженерами и в настоящее время производимый крупной южноамериканской компанией (Emphasys Industrial). Данный ингалятор уже не один год успешно используется в других странах, например Бразилии, Индии. Для России это новое ингаляционное устройство.
В иностранном клиническом исследовании комбинированных препаратов ингалятор Инхалер CDM (CDM-Haler®) сравнивали с ингалятором Diskus (используемый для ингаляционных препаратов компанией GSK). Исследователи оценивали однородность дозы освобождения и аэродинамического мелкодисперсного распределения частиц с помощью каскадного импактора Андерсена (Westech, Англия). Результаты показали однородность дозы освобождения и аэродинамического распределения в начале, середине и конце испытания [15, 16]. Инхалер CDM прост, удобен и надежен в качестве средства доставки порошка для ингаляций, выпускаемого в капсулах, при терапии БА и хронической обструктивной болезни легких [17]. Применение такой формы, как капсулы с порошком для ингаляций, позволяет надежно контролировать прием лекарственного препарата, о чем свидетельствуют:
- слегка сладковатый привкус, который ощущается при вдохе из-за лактозы, содержащейся в качестве носителя (которая безопасна, в том числе для пациентов с сахарным диабетом);
- легкий звук вибрации капсулы в ингаляторе при прохождении сквозь нее воздушного потока во время вдоха лекарственного препарата;
- возможность комфортного контроля количества доз по количеству капсул, оставшихся в блистерах в упаковке, что не всегда позволяют оценить счетчики доз на ингаляторах другого типа.
Кроме того, возможность визуализации содержимого прозрачной капсулы позволяет надежно контролировать использование дозы лекарственного препарата. В отличие от ингаляторов другого типа данный ингалятор можно применять фактически в любом положении. Угол наклона ингалятора при приеме препарата решающего значения не имеет.
Выводы
В многоцентровом открытом сравнительном рандомизированном исследовании доказана клиническая эффективность лекарственного препарата Формисонид®-натив (будесонид 320 мкг + формотерол 9 мкг), порошок для ингаляций дозированный (ООО «Натива», Россия), у пациентов с неконтролируемой и частично контролируемой персистирующей БА. При этом профиль улучшения первичных и вторичных параметров эффективности, а также их конечные значения достоверно не уступали аналогичным параметрам препарата сравнения Симбикорт® Турбухалер®.
На основании полученных данных о безопасности можно утверждать, что исследуемый препарат Формисонид®-натив характеризуется безопасностью и хорошей переносимостью у пациентов с неконтролируемой и частично контролируемой персистирующей БА. При этом частота и степень изменения всех анализируемых параметров безопасности не отличались от аналогичных показателей препарата сравнения Симбикорт® Турбухалер®.
При обобщении всех данных проведенного открытого сравнительного рандомизированного исследования клинической эффективности и безопасности препарата Формисонид®-натив, порошок для ингаляций дозированный, и препарата Симбикорт® Турбухалер®, порошок для ингаляций дозированный, у пациентов с БА можно сделать следующие выводы:
- Формисонид®-натив эффективен и безопасен у пациентов с неконтролируемой и частично контролируемой персистирующей БА.
- Профиль клинической эффективности по всем первичным и вторичным показателям препарата Формисонид®-натив сопоставим с таковым препарата сравнения Симбикорт® Турбухалер®.
- Профиль безопасности и переносимости препарата Формисонид®-натив не отличается от профиля безопасности и переносимости препарата Симбикорт® Турбухалер®.
L.V. Luss, Yu.B. Belousov, O.I. Sidorovich, Ye.F. Glushakova
Institute of Immunology of the Russian Federal Medical and Biological Agency
N.I. Pirogov Russian National Research Medical University
Contact person: Lyudmila Vasilyevna Luss, lusslv@yandex.ru
It is not a secret that in Russia high-efficiency foreign drugs are unavailable to the majority of patients with bronchial asthma. As a consequence, it results in lack of control over disease symptoms. One of the ways to solve this is to create domestic analogues for high-cost foreign drugs. Since 2016 a new domestic drug containing a combination of inhaled corticosteroid and long-acting beta-2-agonist (formoterol/budesonide) Formisonid®-nativ appeared on Russian pharmaceutical market. There was performed a multi-center study aimed at conducting a comparative assessment on efficacy and safety for Formisonid®-nativ (9 mcg formoterol + 320 mcg budesonide per dose) (LLC Nativa, Russia) and its foreign analogue Symbicort® Turbuhaler® (9 mcg formoterol + 320 mcg budesonide per dose) (AstraZeneca AB, Sweden). It was shown that efficacy and safety profile for Formisonid®-nativ were similar to those of Symbicort® Turbuhaler®.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.