Лечение пациента с инфекцией внутриклеточной этиологии
- Аннотация
- Статья
- Ссылки
- English
Введение
Инфекции хламидийной и микоплазменной этиологии широко распространены среди взрослых и детей. Интерес к этим заболеваниям возрос в конце 1980-х гг., когда впервые была установлена этиология хламидийной инфекции у новорожденных, матери которых были инфицированы Chlamydia trachomatis. В то время приоритетным считалось изучение именно Ch. trachomatis. В связи с этим на протяжении ряда лет бытовало мнение, что Ch. trachomatis передается исключительно половым путем, инфицирует беременных и вызывает внутриутробное и интранатальное поражение плода и новорожденного.
Первые исследования хламидийной инфекции начались в 1989 г. в Морозовской больнице. Тогда диагностические возможности были крайне ограниченны. Фактически использовались два метода – иммунофлуоресцентный и иммуноферментный. Причем они предназначались только для исследования патогена в мазках. Основным объектом подобного обследования были женщины (область гинекологии) и новорожденные (по контакту с матерями).
Позднее, благодаря многочисленным исследованиям и появлению новых методов диагностики, например метода полимеразной цепной реакции, в России и за рубежом были доказаны и описаны иные пути передачи инфекции: воздушно-капельный, контактный, гематогенный. Кроме того, были открыты другие виды хламидий – Ch. pneumoniae, Сh. psittaci. Появились новые знания о микоплазменной инфекции, в частности Mycoplasma pneumoniae, M. hominis. В 1990-е гг., когда стало возможным обследование детей разного возраста, представления о клинических формах хламидийной и микоплазменной инфекций расширились. В детской популяции были выделены клинические формы, такие как острый стенозирующий ларингит (синдром крупа), бронхит, пневмония, бронхиальная астма, реактивный артрит, уретрит, вульвит, конъюнктивит, лимфаденит.
Как показывает многолетний опыт наблюдения за детьми с хламидийной и микоплазменной инфекциями, в случае коротких курсов антибактериального лечения, недолеченной инфекции высок риск развития рецидивов, осложнений, вторичной дисфункции иммунитета, внутрисемейного распространения инфекции.
Макролиды
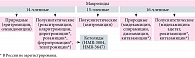
Основными антибиотиками, используемыми в лечении пациентов с внутриклеточными инфекциями, являются макролиды (рисунок). Механизм их действия связан с каталитическим пептидил-трансферазным центром 50s-cубъединицы рибосом. Эффект обусловлен нарушением транслокации и транскрипции, подавлением синтеза белка в рибосомах микробных клеток. Макролиды действуют бактериостатически. В высоких концентрациях макролиды второго поколения способны оказывать бактерицидное действие [1]. В целом спектр действия всех макролидов одинаков. Они эффективны в отношении грамположительных микроорганизмов, грамотрицательных кокков, а именно стрептококка, пневмококка, менингококка, гонококка, трепонем, клостридий, листерий, коринебактерий дифтерии и эритразмы, бациллы сибирской язвы, пенициллинобразующего стафилококка (за исключением метициллин-резистентного), частично энтерококка, а также ряда грамотрицательных бактерий – Haemophilus influenzae, Moraxella (Branchamella), а также Bordetella, Helicobacter, Borrelia, внутриклеточных патогенов (хламидий, микоплазм, уреаплазм), Gardnerella, Coxiella, Rickettsia. Однако большинство грамотрицательных микроорганизмов устойчивы к макролидам. Умеренно чувствительны анаэробы: клостридии, бактероиды, актиномицеты, пропионобактерии, анаэробные кокки. Атипичные микобактерии (Mycobacterium avium, M. leprae) чувствительны к азитромицину, кларитромицину, рокситромицину [1].
Мидекамицин и кларитромицин превосходят прочие макролиды в отношении влияния на грамположительные микроорганизмы. Мидекамицин наиболее чувствителен к M. hominis. Кларитромицин превосходит азитромицин и рокситромицин по действию на внутриклеточные возбудители. Спирамицин воздействует на токсоплазмы. 16-членные макролиды могут быть активны в отношении штаммов пневмококка и Streptococcus pyogenes, устойчивого к 14- и 15-членным макролидам [2].
Описан также постантибиотический и иммуномодулирующий эффект макролидов.
Резистентность MLS-типа (способность к модификации рибосомальной 50s-субъединицы) не вырабатывается к 16-членным макролидам (мидекамицину). Согласно результатам исследования ПеГАС [1–3], резистентность к макролидам невысока – от 2 до 6%.
Как показал анализ лечения макролидами, на практике, в частности в Морозовской больнице, чаще применяли мидекамицин, азитромицин и кларитромицин.
Показания к назначению макролидов
Основные показания к назначению макролидов рассмотрим на примере Макропена (мидекамицина):
- инфекционно-воспалительные заболевания;
- инфекции дыхательных путей, в том числе вызванные внутриклеточными возбудителями;
- тонзиллофарингит;
- острый средний отит;
- синусит;
- обострение хронического бронхита;
- внебольничные пневмонии;
- инфекции мочеполового тракта, вызванные бактериями родов Mycoplasma, Legionella, Chlamydia, а также Ureaplasma urealyticum;
- инфекции кожи и подкожной клетчатки;
- энтерит, вызванный Сampilobacter;
- лечение и профилактика дифтерии и коклюша.
Макропен (мидекамицин) в отличие от других макролидов разрешен к применению у детей с рождения. Взрослым и детям с массой тела более 30 кг препарат назначают по одной таблетке 400 мг три раза в день. Детям с массой тела до 30 кг суточную дозу 40 мг/кг массы делят на три приема. При тяжелых инфекциях суточная доза составляет 50 мг/кг массы, разделенной на три приема. При двукратном приеме суточная доза – 50 мг/кг.
Согласно новой инструкции по применению, схема назначения суспензии Макропена детям следующая:
- при массе тела до 30 кг (~ 10 лет) – 175 мг/5 мл;
- до 20 кг (~ 6 лет) – 22,5 мл (787 мг) два раза в сутки;
- до 15 кг (~ 4 года) – 10 мл (350 мг) два раза в сутки;
- до 10 кг (~ 1–2 года) – 7,5 мл (262,5 мг) два раза в сутки;
- до 5 кг (~ 2 месяца) – 3,75 мл (131,25 мг) два раза в сутки.
Продолжительность лечения – 7–14 дней. Профилактика дифтерии – 7 дней (50 мг/кг/сут), два приема (7 дней). Профилактика коклюша – 50 мг/кг/сут в течение 7–14 дней в первые 14 дней после контакта.
Эффективность лечения миокамицином в Аргентине была доказана у 2322 больных и составила 90,8% при инфекциях дыхательных путей, 100% – при заболеваниях кожи, 92,8% – скарлатине, 100% – кампилобактере.
Как правильно выбрать препарат стартовой терапии
Установлено, что последние годы свыше 65% пациентов с тонзиллофарингитами получали лечение антибиотиками необоснованно. Нередко стартовыми препаратами при стрептококковых инфекциях являются представители группы феноксиметилпенициллина, амоксициллина. Однако на фоне их применения высока вероятность развития аллергической сыпи [3]. Аналогичная ситуация наблюдается при стартовом лечении данными препаратами больных инфекционным мононуклеозом, поэтому рекомендуется назначать макролиды или цефалоспорины.
Макролиды характеризуются хорошей переносимостью. В отличие от эритромицина при использовании Макропена нежелательные явления возникают в 2–15 раз реже.
Как не ошибиться при постановке диагноза в случае выявленной инфекции внутриклеточной этиологии? Рассмотрим это на конкретном примере.
Клинический случай
Девочка Р., 14 лет, находилась в инфекционном отделении Морозовской больницы с 10 октября 2013 г.
Из анамнеза известно, что 26 сентября 2013 г. отмечалось переохлаждение, затем появился озноб. 27 сентября на фоне непродуктивного кашля наблюдалось повышение температуры тела до 39,6 °С. По результатам осмотра педиатр установил диагноз острого респираторного заболевания. 30 сентября после постановки диагноза «ангина» назначены Флемоксин Солютаб и полоскание. Температура сохранялась. На рентгенограмме грудной клетки от 2 октября выявлена правосторонняя пневмония (обширные участки инфильтрации легочной ткани). Назначен Цефабол внутримышечно. Однако температура тела не снижалась. 4 октября вызванный из платной клиники врач заподозрил двустороннюю пневмонию. В схему терапии был включен второй антибиотик. 5 октября добавлены ингаляции с Лазолваном. Кашель и субфебрильная температура сохранялись. 10 октября (16-й день болезни) больная «самотеком» поступила в Морозовскую детскую городскую клиническую больницу.
При поступлении состояние средней тяжести, лихорадка отсутствовала. Зев гиперемирован, налетов нет. Лимфоузлы не увеличены. Носовое дыхание затруднено из-за слизистого отделяемого. В легких дыхание жесткое, в нижних отделах справа ослабленное, в подмышечной области и по задней поверхности отмечалось укорочение перкуторного звука, выслушивались единичные крепитирующие и влажные хрипы. Тоны сердца ритмичные. Со стороны паренхиматозных органов – без патологии.
Обследование. Общий анализ крови: лейкоциты – 12,9 × 109/л, лейкоцитарная формула со сдвигом влево (ядерный сдвиг) – 90%. К моменту выписки из стационара (22 октября) количество ядерных элементов уменьшилось – 67%. Показатели биохимического анализа крови, включая антистрептолизин-О, не изменены. Уровни общих иммуноглобулинов классов G и M увеличены по сравнению с референсными значениями. На рентгенограмме органов грудной клетки от 10 октября (по сравнению с амбулаторным исследованием от 2 октября) отмечалось нарастание инфильтрации легочной ткани. Диагноз: правосторонняя нижнедолевая пневмония.
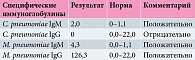
Результаты серологического исследования крови (иммуноферментного анализа) приведены в таблице.
Были назначены:
- Трифамокс ИБЛ внутривенно 1,5 г три раза в сутки + Макропен 400 мг три раза в сутки в течение десяти дней;
- ингаляции через небулайзер с Лазолваном;
- симптоматическая терапия – местная (туалет носа, нафтизин 0,05%), полоскание зева хлоргексидином;
- флуконазол 50 мг один раз в сутки в течение трех дней;
- физиотерапия, УВЧ на грудную клетку (десять дней);
- ЛФК.
Бактериологическое исследование мазков из зева и носа – отрицательное.
На компьютерной томограмме грудной клетки от 16 октября – картина правосторонней нижнесреднедолевой пневмонии. В S8 нижней доли правого легкого регистрировалась крупная зона консолидации с просветами бронхов до уровня субсегментов. В других сегментах правой нижней доли, в большей степени в S8–S10, выявлялась распространенная мелкоочагово-сливная инфильтрация легочной паренхимы. Единичные очаги размером 0,8 × 0,6 и 0,4 × 0,3 см регистрировались в S4 средней доли правого легкого. Гидроперикард в незначительном объеме.
Ультразвуковое исследование плевральных полостей – справа в плевральном синусе незначительное количество анэхогенной жидкости высотой 8,7 мм.
Электрокардиограмма от 14 октября: ритм синусовый, регулярный. Вертикальное положение электрической оси сердца.
Эхокардиография от 17 октября: локальная сепарация листков перикарда за верхушкой правого желудочка.
Повторная эхокардиография от 22 октября: сепарация до 6 мм.
Консультация кардиолога 18 октября: реактивный экссудативный перикардит, малый выпот. В схему лечения был введен Вольтарен 50 мг два раза в сутки.
Консультация оториноларинголога 16 октября: обострение хронического тонзиллита. Миндалины с казеозными массами в лакунах.
При выписке состояние удовлетворительное. В легких дыхание везикулярное, без хрипов. Со стороны сердца тоны ритмичные, шума нет. Пациентка выписана с рекомендациями по наблюдению у участкового педиатра и кардиолога.
Основной клинический диагноз (при выписке из стационара): внебольничная правосторонняя нижнедолевая пневмония. Сопутствующий диагноз: реактивный экссудативный перикардит.
Комментарий
Прежде всего необходимо обратить внимание на анамнез заболевания: сначала отмечались симптомы острого респираторного заболевания, впоследствии появились осложнения, гипертермия сохранялась на фоне антибактериального лечения. В такой ситуации врачей, наблюдавших ребенка на амбулаторном этапе, должно было насторожить следующее. Как известно, в 2013 г. в Москве наблюдалась эпидемия микоплазменной инфекции. И даже при назначении антибиотика из группы аминопенициллинов следовало в схему терапии включать не цефалоспорин, а макролид либо их комбинацию. Обратите внимание: при использовании аминопенициллинов пациентами с текущей хламидийной инфекцией высока вероятность формирования L-формы возбудителя, что впоследствии снизит эффективность макролидов.
Ребенок поступил в стационар поздно – на 16-й день болезни, причем «самотеком». Очевидно, что на амбулаторном этапе тяжесть заболевания недооценили.
В стационаре диагноз внутриклеточной инфекции был быстро подтвержден. Причиной пневмонии стала выявленная смешанная инфекция (острая хламидийная и обострение микоплазменной). К сожалению, полученные результаты не отражены в выписке из стационара, хотя это следовало сделать в целях дальнейшего наблюдения за ребенком в условиях поликлиники.
Врачам хорошо известно, что внутриклеточные инфекции даже в остром периоде пневмонии обычно протекают без выраженных сдвигов в лейкоцитарной формуле (то есть количество лейкоцитов и нейтрофилов не увеличивается, а лимфоциты, реже моноциты, преобладают). В данном случае уже результаты первого анализа крови показали содержание лейкоцитов около верхней границы нормы. Нейтрофилы преобладали – 90%. Дело в том, что в случае смешанной инфекции (хламидийной и микоплазменной) (например, со стрептококком или другими бактериями) в общем анализе крови может наблюдаться нейтрофилез.
Почему в таком случае в мазках из зева другие возбудители не выделены? Отрицательный результат вполне закономерен: ребенок к моменту поступления в стационар несколько дней получал аминопенициллины и цефалоспорины.
При поступлении пациентки в стационар в схему лечения добавили Макропен, что обеспечило положительную динамику.
Ранее, исходя из собственного опыта, мы предлагали алгоритм лечения пневмонии при микоплазменной инфекции. Как показали результаты исследования, в случае развития пневмонии, особенно двусторонней, в группе детей, применявших одновременно два антибиотика (аминопенициллины или цефалоспорины + макролиды, например: внутривенно кларитромицин или перорально Макропен, кларитромицин, Сумамед), положительная динамика наблюдалась раньше и регресс инфильтратов легких был намного лучше, чем в группе детей, получавших данные препараты последовательно [4].
Поражение сердца при внутриклеточных инфекциях – явление не частое. Однако, как показывает 30-летний опыт наблюдения за детьми с данными инфекциями в Морозовской больнице, функциональные нарушения со стороны сердца (нарушение ритма, артериальная гипотензия, при тяжелой патологии – миокардиты) имеют место. Нередко, по результатам эхокардиографии, приходилось наблюдать сепарацию листков перикарда и небольшой выпот (2–4 мм) у больных респираторными инфекциями разной степени тяжести. Кроме того, выявлялись эхо-плотные включения и миксоматоз клапанов. Что касается рассматриваемого случая, сепарация за верхушкой правого желудочка до 7 мм, согласно классификации, относится к экссудативному перикардиту.
В данном случае пациентка должна наблюдаться у кардиолога и инфекциониста. Обязателен серологический контроль крови на внутриклеточные инфекции через 2,5–3 месяца для решения вопроса о необходимости дальнейшего лечения хламидийной и микоплазменной инфекций. Девочка находится в пубертатном возрасте, поэтому целесообразны мероприятия по иммунокоррекции.
M.S. Savenkova, M.P. Savenkov, A.A. Afanasyeva, A.Ye. Andzhel, A.A. Shokin
N.I. Pirogov Russian National Research Medical University
Morozov Children's City Clinical Hospital
Contact person: Marina Sergeyevna Savenkova, mpsavenkov@mail.ru
As shown by many years of monitoring the children with chlamydial and mycoplasmal infections, short courses of antibiotic therapy can lead to the development of recurrences, complications and secondary immune system dysfunction, as well as the intrafamily spread of the disease. How to avoid mistakes in the diagnosis in case of intracellular etiology infection detection and to choose appropriate therapeutic algorithm of actions?
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.