Патогенетические механизмы влияния дефицита тестостерона на симптомы нижних мочевых путей у мужчин
- Аннотация
- Статья
- Ссылки
- English

Введение
Термин «симптомы нижних мочевых путей (СНМП)» длительное время ассоциировался преимущественно с различными нарушениями мочеиспускания, характерными для доброкачественной гиперплазии предстательной железы (ДГПЖ) [1]. Однако в настоящее время он получил более широкое трактование, объединив спектр нарушений функций нижних мочевых путей, связанных с любыми заболеваниями данного сегмента урогенитального тракта. Его все чаще стали использовать для описания дисфункции нижних мочевых путей при нейрогенном мочевом пузыре, цистите и уретрите у женщин, раке простаты, хроническом простатите, стриктурах уретры у мужчин, что связано с универсальностью патогенеза СНМП, который не зависит от конкретной урологической нозологии [2].
Расширение клинического применения данного термина обусловлено еще и тем, что СНМП сегодня рассматриваются не только как нарушение анатомо-функционального состояния нижних мочевых путей при урологической патологии, но и как многофакторное состояние и междисциплинарная проблема, поскольку могут встречаться в практике врача любой специальности [3].
СНМП значительно ухудшают качество жизни пациентов независимо от пола и возраста. По негативному влиянию любые СНМП (особенно ноктурия) превосходят даже, например, сахарный диабет 2 типа и артериальную гипертензию [4]. Кроме того, часто в отсутствие необходимого лечения СНМП прогрессируют и усугубляются с возрастом.
Существенная, если не ключевая характеристика нижних мочевых путей у обоих полов – выраженная гормонозависимость. В частности, в нижних отделах урогенитального тракта наблюдается высокая экспрессия рецепторов к гормонам, прежде всего половым стероидным гормонам (прогестерону, тестостерону, эстрогенам) и витамину (гормону) D, которые обеспечивают нормальное анатомо-функциональное состояние практически всех структур тазового дна, мочевого пузыря, уретры, предстательной железы. Это привносит в патогенез СНМП, наряду с васкулогенным, миогенным, нейрогенным компонентами, дополнительный гормональный компонент, который нужно учитывать при диагностике и планировании фармакотерапии СНМП как у мужчин, так и у женщин [5].
Тестостерон – уникальный полифункциональный стероидный половой гормон. Многие клетки организма мужчины активно экспрессируют андрогеновые рецепторы, посредством которых тестостерон реализует клеточные эффекты, в том числе в нижних отделах мужского урогенитального тракта [6]. По мере старения у большинства мужчин уровень тестостерона постепенно снижается вплоть до дефицита [7, 8]. Частота СНМП у мужчин тоже увеличивается с возрастом, достигая после 50 лет 50% [9, 10]. Таким образом, дефицит тестостерона может быть вовлечен в патогенез СНМП у мужчин. В данной статье будут рассмотрены наиболее важные механизмы влияния дефицита тестостерона на инициацию и прогрессирование СНМП у мужчин.
Дефицит тестостерона – ожирение –симптомы нижних мочевых путей
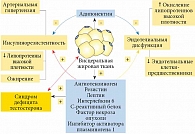
Согласно современной точке зрения, жировая ткань признается самостоятельным активным эндокринным органом, который секретирует целый ряд биологически активных субстанций (адипокинов). Они относятся к различным химическим классам и способны, кроме прочих негативных метаболических эффектов, уменьшать синтез тестостерона в клетках Лейдига у мужчин (рис. 1) [11, 12].
Неблагоприятное влияние избыточной массы тела и ожирения на уровень тестостерона у мужчин, как и обратная достоверная корреляция между окружностью талии и уровнем тестостерона, давно и хорошо известно [13, 14].
За отрицательное воздействие жировой ткани на стероидогенез у мужчин ответственен лептин («голос» жировой ткани) – белок с молекулярной массой 16 кДа, синтезируемый и секретируемый главным образом клетками жировой ткани (адипоцитами). Постоянный избыток лептина, с одной стороны, нарушает механизм обратной отрицательной связи между клетками Лейдига яичек и соответствующим гипофизарным гонадотропином (лютеинизирующим гормоном), а с другой – усиливает ароматизацию тестостерона в 17-бета-эстрадиол под влиянием ароматазы жировой ткани [15]. В результате развиваются гипоандрогенемия и относительная гиперэстрогенемия, которые способны нарушать различные гормональные сигналы в гормонозависимых клетках урогенитального тракта. Кроме того, в жировой ткани происходит активный синтез кортизола, как известно, одного из важных контргонадных гормонов.
S. Kaplan и соавт. (2007) обнаружили достоверную положительную корреляцию между окружностью талии и выраженностью СНМП, а также отрицательную корреляцию между окружностью талии и максимальной скоростью потока мочи [16]. Согласно имеющимся метаанализам, увеличение окружности талии ассоциируется с повышенным риском развития всех СНМП у мужчин [17], и в том числе после лапароскопической радикальной простатэктомии [18].
В одном из крупнейших исследований было достоверно показано, что ожирение – ключевой метаболический фактор, связанный со стрессовым недержанием мочи и у мужчин, и у женщин [19]. Кроме того, ожирение способно приводить к нарушению структуры и функций тазового дна, играющего важную роль в патогенезе СНМП [20].
Дефицит тестостерона – инсулинорезистентность – симптомы нижних мочевых путей
Инсулинорезистентность – патологическое состояние, при котором взаимодействие инсулина с рецепторами в инсулинчувствительных тканях (печени, скелетных мышцах и жировой ткани) не обеспечивает физиологические эффекты инсулина. Инсулинорезистентность создает условия для развития гипергликемии, которая длительное время (иногда десятки лет) компенсируется повышенной продукцией инсулина – компенсаторной гиперинсулинемией.
Достоверная обратная связь между низким уровнем тестостерона и высоким уровнем инсулина в крови установлена достаточно давно и сегодня не вызывает сомнений [21, 22]. Более того, по данным молекулярных исследований, патология инсулинового рецептора и полиморфизм гена андрогенового рецептора (с увеличенным количеством CAG-повторов, то есть метаболически неактивным) часто сочетаются, что в определенной степени может служить дополнительным обоснованием связи дефицита тестостерона и инсулинорезистентности [22, 23].
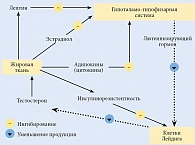
При дефиците тестостерона нарушается инсулиновый клеточный сигнальный путь регуляции клеток. Несмотря на нормальное содержание глюкозы в крови, этот процесс сопровождается выраженным дефицитом глюкозы в клетках. В результате они не могут адекватно производить энергию в митохондриях и бороться со свободнорадикальным окислением, что сопровождается клеточной гипоксией, индуцированной митохондриальной дисфункцией [24]. В дальнейшем это может усиливать уже имеющийся дефицит тестостерона, поскольку клетки Лейдига как основные продуценты данного гормона крайне неустойчивы к любой гипоксии. Так замыкается порочный круг дефицита тестостерона при инсулинорезистентности, усугубляя его недостаточное поступление в клетки урогенитального тракта, которые в ответ на гипоксию подвергаются викарной гипертрофии, чтобы хоть как-то обеспечить себя необходимым для жизнедеятельности кислородом (рис. 2) [25, 26].
Важным опосредованным механизмом влияния инсулинорезистентности на уродинамику нижних мочевых путей является индуцируемое ею нарушение нейрогенной регуляции тазовых органов (автономная вегетативная симпатическая гиперактивность) [27]. Инсулинорезистентность повышает симпатическую активность альфа-адренергических нейронов, нарушая метаболизм глюкозы в вентромедиальных гипоталамических нейронах, что в свою очередь усиливает системную активность центральных и периферических альфа-1-адренорецепторов, в том числе гладких мышц простатической капсулы, шейки мочевого пузыря и тазового дна с развитием в них повышенной контрактильности [28]. По данным ряда авторов, следствием такой контрактильности в мышцах нижних мочевых путей может стать появление СНМП даже при нормальном объеме ткани предстательной железы [29].
В лабораторных моделях автономная симпатическая гиперактивность на фоне инсулинорезистентности приводила к стимулированному росту предстательной железы, что заканчивалось формированием ДГПЖ, как полагают, посредством активизации инсулиноподобного фактора роста 1 и 3 в ткани простаты [28]. K. McVary и соавт. (2005) обследовали мужчин на фоне индуцированной повышенной автономной симпатической активности после тилт-теста и выявили, что маркеры автономной симпатической гиперактивности (повышение артериального давления и частоты сердечных сокращений, а также уровня катехоламинов в сыворотке крови или моче) положительно коррелировали с субъективными маркерами СНМП и качеством жизни [30].
В роли дополнительного механизма, усиливающего негативное влияние на нижние мочевые пути автономной вегетативной симпатической гиперактивности при инсулинорезистентности, можно рассматривать усугубление нарушений тазово-простатической оксигенации на фоне эндотелиальной дисфункции, индуцируемой инсулинорезистентностью и сопряженной с атерогенезом. С учетом повышения симпатического тонуса и активности альфа-1-адренорецепторов это может привести к формированию и персистенции обструктивных и ирритативных СНМП либо в отсутствие ДГПЖ, либо после ее хирургического лечения [31, 32].
Дефицит витамина D – дефицит тестостерона – симптомы нижних мочевых путей
Согласно современным данным, витамин D рассматривается как активный D-гормон, который регулирует от 3 до 10% всего генома человека, включая гены углеводного обмена, стероидогенеза, иммунитета, репродукции, неспецифической противораковой защиты, что делает его одним из ключевых гормонов, необходимых человеку в достаточном количестве с рождения и до самой смерти [33].
Современные эпидемиологические данные свидетельствуют о высокой частоте нераспознанного дефицита/недостаточности витамина (гормона) D у больных урологического профиля. Так, M.S. Pitman и соавт. (2011) проанализировали результаты обследования 3763 мужчин из урологических баз медицинских данных и пришли к выводу, что в настоящее время 68% урологических пациентов имеют неадекватный уровень витамина D, а 52% из них – нераспознанные дефицит или недостаточность витамина D [34].
Наиболее часто дефицит витамина D выявляется у пациентов моложе 50 лет (44,5%), представителей негроидной расы (53,2%) и испанцев (41,6%) (р < 0,001). В мультивариационном анализе раса, возраст, время года или диагноз рака были независимыми предикторами статуса по витамину D [34].
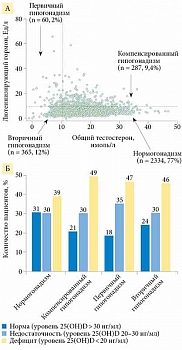
Многочисленные клинико-экспериментальные исследования выявили способность витамина D регулировать экспрессию генов стероидогенеза, которая в свою очередь регулирует экспрессию генов витамина D [35, 36]. В этой связи многие авторы полагают, что дефицит тестостерона гипотетически может усиливать неблагоприятные последствия дефицита витамина D, то есть при обмене между тестостероном и витамином D существует не односторонняя, а двусторонняя патофизиологическая связь [37]. Так, в одном из самых крупномасштабных популяционных исследований (n = 3369) недостаточность витамина D (25(OH)D < 20 нг/мл) у мужчин ассоциировалась с вторичным гипогонадизмом и компенсированным гипогонадизмом. При этом уровень 25(OH)D был прямо пропорционален уровням общего и свободного тестостерона и обратно пропорционален уровню эстрадиола (рис. 3) [38].
На сегодняшний день установлено, что дефицит витамина D у мужчин может играть важную роль в патогенезе гиперактивного мочевого пузыря, особенно в зимнее время, а нормализация уровня витамина D способна облегчить симптомы гиперактивного мочевого пузыря и качество жизни пациентов [39, 40]. Исследование, проведенное среди американских мужчин, показало высокую частоту дефицита витамина D (89%), который ассоциировался с умеренными и выраженными СНМП [41]. Кроме того, установлено, что мужчины с СНМП старше 50 лет имеют более низкий уровень витамина D по сравнению с мужчинами без СНМП [42], а некоторые авторы рассматривают дефицит витамина D как независимый фактор повышенного риска развития СНМП у мужчин [43, 44].
Дефицит тестостерона – эндотелиальная дисфункция – симптомы нижних мочевых путей
Эндотелиальная дисфункция – частичное снижение или полная утрата способности эндотелиальных клеток всех сосудов обеспечивать адекватный синтез сосудосуживающих и сосудорасширяющих факторов, определяющих структурно-функциональную целостность эндотелия и профилактические антиатерогенные эффекты [45].
Эндотелий выполняет целый ряд критически важных функций: контролирует тонус сосудов, местные процессы гемостаза, регулирует апоптоз, пролиферацию и миграцию клеток крови через стенку сосудов в ткани, рост гладкомышечных элементов сосудистой стенки, тромбообразование, фибринолиз, местные иммунные процессы и т.д. Регуляция сосудистого тонуса происходит за счет координированного синтеза огромного количества вазодилататоров (фактора гиперполяризации эндотелия, простациклина, простагландина I2, оксида азота (NO), натрийуретического пептида С-типа, адреномедуллина) и вазоконстрикторов (эндотелина 1, тромбоксана А2, простагландина F2a, эндопероксидов и т.д.) [45]. Именно динамический баланс между сосудосуживающими и сосудорасширяющими эндотелиальными факторами обеспечивает адекватность и полноценность как магистрального (центрального) кровообращения, так и местного (регионарного) состояния микроциркуляторного русла органов и тканей [46].
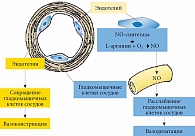
Наиболее критическим модулятором эндотелиальной функции сосудистого русла у мужчин считается NO, представляющий собой крайне нестабильный радикал с периодом жизни не более 12 секунд [47]. Адекватный синтез NO в стенке сосудов требует здорового эндотелия и нейротелия (90% NO имеет нейрональное происхождение), биохимического предшественника NO – L-аргинина, ферментной системы NO-синтаз и достаточного уровня эндогенного тестостерона. В условиях хронического дефицита тестостерона синтез NO в нейроэндотелии сосудов ослабляется, а его место занимает один из самых мощных природных вазоконстрикторов эндотелин 1. В результате развивается стойкий, порой резистентный к стандартным сосудорасширяющим препаратам спазм стенки сосудов различных органов и систем (ишемия) (рис. 4) [48]. Это закономерно приводит к развитию сначала гемической, а затем и клеточно-тканевой гипоксии, а также ишемии соответствующих органов (системному и локальному атеросклерозу). В частности, тазовый атеросклероз, ведущий к гипоксии и ишемии тазово-уретро-простатической зоны, рассматривается важнейшим индуктором СНМП и заболеваний предстательной железы [49–51].
По мнению ряда авторов, СНМП и эректильная дисфункция обычно сосуществуют у одного и того же пациента, и оба заболевания реагируют на ингибиторы фосфодиэстеразы 5 типа, что предполагает общий для них патофизиологический механизм – эндотелиальную дисфункцию [52–54]. Многочисленные исследования на гипогонадных животных доказали связь атеросклероза и хронической ишемии как проявлений эндотелиальной дисфункции, с одной стороны, и фиброза (атрофии) детрузора мочевого пузыря, с другой, что подтверждает важную роль эндотелиальной дисфункции, обусловленной дефицитом тестостерона, в патогенезе СНМП [55, 56].
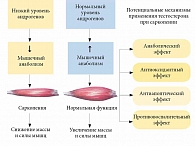
Дефицит тестостерона – саркопения и дисфункция нейротелия детрузора – симптомы нижних мочевых путей
Саркопения – относительно новый термин, который начал применяться в медицине с 1989 г. С его помощью описывался процесс потери массы скелетной мускулатуры, связанной со старением. В 2010 г. терминологию пересмотрели, и на сегодняшний день определение звучит следующим образом: «саркопения – это снижение мышечной массы и ее функциональных характеристик, которое развивается из-за нейрогуморальных сдвигов, нарушения питания или разрушения мышц в результате процессов катаболизма» [57]. В медицинской практике саркопения – важный прогностический маркер при определении прогноза жизни и выздоровления, особенно у тяжелых больных. Объем потери мышечной массы напрямую связан с полиорганными нарушениями. Если потеряно около 5–10% мышечной массы, нарушается работа одного органа, 10–20% – двух-трех органов, свыше 20% – четырех и более органов [57]. В рамках данной статьи речь идет прежде всего о возрастной саркопении детрузора, который представляет собой единый функциональный мышечный синцитий.
В экспериментах на самцах крыс линии Wistar показано, что плотность коллагеновых и мышечных волокон в детрузоре достоверно увеличивается с возрастом, а после орхэктомии у молодых самцов состояние коллагенового статуса их мочевого пузыря напоминает таковое у сенильных самцов [58].
Y. Zhang и соавт. (2012) выявили, что в условиях лабораторной модели андрогенного дефицита у самцов крыс достаточно быстро развивается фиброз стенки детрузора мочевого пузыря с уменьшением его объема и сокращаемости, что сопровождается повышением в нем экспрессии мРНК проколлагена 1 – одного из основных маркеров фиброза [59].
Андрогеновая депривация в эксперименте также усиливает экспрессию мРНК трансформирующего фактора роста бета, играющего, по современным представлениям, важнейшую роль в патогенезе дисфункции мочевого пузыря эндокринной природы, что в перспективе можно будет использовать в клинической практике для разработки новых методов профилактики и лечения СНМП/ДГПЖ у мужчин с дефицитом тестостерона [59].
По данным A. Godoy и соавт. (2011), уже через 14 дней после лабораторного моделирования андрогенного дефицита у самцов мышей при иммуногистохимических исследованиях можно выявить уменьшение диаметра и плотности простатических сосудов [60].
G. Koritsiadis и соавт. (2008) проанализировали результаты трансуретральной резекции простаты и надлобковой простатэктомии у 25 больных ДГПЖ на фоне андрогенного дефицита и нарушений уродинамики. Были выявлены значительные обратные корреляции между значениями тестостерона и детрузорным давлением в конце мочеотделения и на максимальной скорости потока мочи. Кроме того, функциональная активность детрузора мочевого пузыря напрямую зависела от уровня тестостерона в крови [61]. Аналогичные результаты получили и другие авторы [62, 63].
Исследования толщины и структуры детрузора у мальчиков с различным уровнем общего тестостерона продемонстрировали прямую достоверную корреляцию между этим показателем и толщиной стенки мочевого пузыря [64].
При изучении влияния тестостерона на нервно-мышечную передачу в мочевом пузыре крыс и землероек оказалось, что гормон воздействует преимущественно на постфункциональный негеномный рецептор для ингибирования сокращения мышц детрузора мочевого пузыря [65].
Кроме того, получены доказательства, что в физиологических условиях тестостерон в наномолярных концентрациях непосредственно активирует BK-каналы в клетках детрузора, независимые от геномных рецепторов тестостерона, и таким образом регулирует возбудимость детрузора [66].
Тестостерон обладает дополнительными противовоспалительными эффектами в отношении мышечной ткани (в том числе детрузора), поскольку подавляет действие протеолитических ферментов (металлопротеиназ), связанных с деградацией коллагена и вовлеченных в механизмы саркопении [67, 68].
Тестостерон у мужчин также подавляет выработку провоспалительных цитокинов (в частности, интерлейкинов 1, 6, фактора некроза опухоли альфа) и усиливает окисление бета-жирных кислот, оказывающих выраженное катаболическое влияние на мышцы, что способствует предотвращению потери количества и качества мышечной массы [69, 70] (рис. 5).
Дефицит тестостерона – повышенная активность Rho-киназного механизма – симптомы нижних мочевых путей
В настоящее время не вызывает сомнений, что наряду с классической Са2+-зависимой регуляцией функционирование гладкомышечных и эндотелиальных клеток сосудистой стенки регулируется многочисленными сигнальными путями, и их активность может напрямую не зависеть от внутриклеточной концентрации Са2+. Эта сигнализация носит сложный характер, причем разные пути могут иметь общие промежуточные этапы или мишени. Многие из таких путей затрагивают активность Rho-киназы, которая реализует функции практически во всех клетках организма, несмотря на разнообразие протекающих в них процессов [71]. Однако при дефиците тестостерона наблюдается неоправданно высокая активность Rho-системы, что приводит к стойкой патологической вазоконстрикции и зональной гипоксии. Таким образом, Rho-система – важная система, которая регулирует тонические сокращения, обеспечивает высокий уровень базального тонуса и может вносить вклад в тонизирование мышц нижних мочевых путей [72].
Rho-система вызывает гладкомышечное сокращение не за счет изменения внутриклеточного уровня кальция, а путем изменения чувствительности к кальцию контрактильного механизма [72]. Как полагают, Rho-киназа ингибирует фосфатазу легких цепей миозина, в результате происходит фосфорилирование и сокращение гладких мышц, в основе которого лежит взаимодействие актина и миозина. NO противостоит этому, косвенно влияя на активную форму контрактильных белков [73, 74]. Напротив, альфа-адренергическая деятельность стимулирует путь метаболизма Rho-системы, обеспечивая связь между ней и автономной вегетативной гиперактивностью [75]. Таким образом, посредством данного механизма у гипогонадных мужчин могут появляться СНМП даже при интактном детрузоре.
Дефицит тестостерона – системное хроническое субклиническое воспаление – симптомы нижних мочевых путей
Развитие гипогонадизма у мужчин может индуцировать системное хроническое субклиническое воспаление, опосредованное особыми сигнальными молекулами – цитокинами, которые регулируют воспалительные и иммунные реакции организма (рис. 6) [24].
Системное хроническое воспаление – реакция иммунной системы, опосредуемая цитокинами в ответ на любые персистирующие повреждающие агенты. В его этиологии основную роль играют хронический стресс, избыточное по калорийности и содержанию липидов питание, ведущее к ожирению, гиподинамия, хронические бактериальные и вирусные инфекции, генетические особенности иммунной и физиологических систем, реагирующих на внешние стимулы [24].
При хроническом системном субклиническом воспалении в клетках Лейдига наблюдается нарушение цепи трансформации холестерина под влиянием цитохрома Р450 за счет способности фактора некроза опухоли альфа и интерлейкина 1 ингибировать стероидогенез, что также содействует уменьшению синтеза тестостерона и гипогонадизму [76].
Системное хроническое субклиническое воспаление может быть одним из непосредственных механизмов формирования нарушений взаимодействий инсулина со своими рецепторами в инсулинчувствительных клетках и тканях: печени, скелетных мышцах и жировой ткани. В результате не обеспечиваются физиологические эффекты инсулина, что составляет суть инсулинорезистентности, всегда сопровождающейся гиперинсулинемией [77, 78]. Хроническое системное субклиническое воспаление способно повреждать любые органы и ткани за счет нарушения баланса между про- и противовоспалительными цитокинами.
Выявлено, что у пациентов с СНМП уровень интерлейкина 8 в эякуляте положительно коррелирует с выраженностью СНМП по международной шкале оценки симптомов со стороны предстательной железы/шкале качества жизни и уровнем простатического специфического антигена в крови [79]. Длительно текущее хроническое субклиническое воспаление, опосредованное цитокинами, ведет к морфологическим изменениям в мочевом пузыре, включая фиброз (сниженное отношение «мышцы – соединительная
ткань»), лейкоцитарную инфильтрацию, вызванную гипоксией, и усиленную экспрессию маркеров воспаления в мышцах детрузора с развитием в нем хронического асептического (цитокинового) воспаления с клиникой идиопатических СНМП [80–82].
Дефицит тестостерона – дефицит андростендиола – активация альфа-1-адренорецепторов нижних мочевых путей – симптомы нижних мочевых путей без доброкачественной гиперплазии предстательной железы
В клетках предстательной железы экспрессируется фермент 3-бета-редуктаза, способный трансформировать тестостерон в андростендиол – природный блокатор альфа-1-адренорецепторов мочевого пузыря, уретры и предстательной железы. По этой причине дефицит данного метаболита тестостерона рассматривается как один из главных гормональных механизмов развития гиперактивности альфа-1-адренорецепторов указанной зоны и последующих СНМП даже в отсутствие ДГПЖ [83, 84].
Дефицит тестостерона – дефицит серотонина – хроническая депрессия – симптомы нижних мочевых путей
Согласно имеющимся данным, депрессия довольно часто встречается в клинической практике, существенно повышает риск развития СНМП и крайне негативно влияет на качество жизни [85]. В свою очередь медикаментозное или хирургическое лечение СНМП может положительно сказаться на качестве жизни и поэтому на течении депрессии. Однако остается непонятным, как это связано с уровнем эндогенного тестостерона, который характеризуется достоверным антидепрессивным эффектом у мужчин [86].
Вместе с тем есть результаты некоторых исследований, которые показали связь выраженной депрессии, низкого уровня серотонина с низким уровнем тестостерона и тяжелыми СНМП [87]. Безусловно, необходимо и дальше активно изучать это направление, тем более что одной из потенциальных клинических масок депрессии могут быть изолированные СНМП у мужчин без урологической патологии.
Дефицит тестостерона – тазово-простатическая конгестия – симптомы нижних мочевых путей
Хроническая болезнь вен таза – нередкая находка у больных СНМП. И несмотря на то что варикозная болезнь вен малого таза у мужчин мало изучена, общеизвестна роль венозного полнокровия в развитии ряда урологических заболеваний. Необходимость исследования этой проблемы в первую очередь объясняется растущей распространенностью заболевания среди мужчин.
Вены, как известно, не имеют собственной мышечной стенки, и их опорожнение обычно происходит за счет пульсовых волн от расположенных в составе сосудисто-нервного пучка артериальных сосудов. Из всех известных механизмов развития хронической венозной болезни таза, подробно описанных в специальной литературе, нужно обратить внимание на половые дизритмии у мужчин как одну из ее причин. Хорошо известно, что уменьшение сексуальной активности у мужчин способно приводить посредством феномена простато-тестикулярного взаимодействия, также известного как феномен Белова, к снижению уровня тестикулярного стероидогенеза, то есть практически к функциональному гипогонадизму [88].
Тестостерон – ключевой гормон либидо у мужчин, поэтому в данной ситуации длительное половое воздержание и снижение ритма индивидуальных эякуляций, за счет которых происходят опорожнение предстательной железы и отток венозной крови от органов таза и мошонки, могут индуцировать или вызывать прогрессирование уже имеющейся латентной тазово-простатической конгестии, которая распространяется на венозные сплетения шейки мочевого и уретры. Так замыкается порочный круг патогенеза хронической венозной болезни таза при нарушениях ритма половой жизни [89]. У мужчин с данным механизмом возникает периодический болевой тазовый синдром, как правило усиливающийся при длительном стоянии, сидении и любой статической работе и уменьшающийся или вовсе исчезающий при физической активности, стабилизации ритма эякуляций (позиционная зависимость). Одновременно могут развиваться интермиттирующие СНМП, которые связаны с отеком подслизистой оболочки шейки мочевого и уретры, практически резистентны к стандартной терапии и требуют назначения венотоников и флебопротекторов на фоне повышения физической и в большей мере сексуальной активности [90]. Вот почему нередко в подобных случаях проводится трехмесячная заместительная терапия тестостероном, направленная на повышение либидо и сексуальной активности, что способствует более регулярному опорожнению семенных пузырьков и простаты, уменьшению или ликвидации тазово-простатической конгестии, болевого синдрома и соответственно СНМП [90].
Заключение
Проведенный обзор литературы еще раз продемонстрировал уникальные полифункциональные эффекты тестостерона у мужчин. В настоящее время, когда частота коморбидных заболеваний у мужчин достаточно высока и ассоциированные с возрастом заболевания «молодеют», возникает насущная клиническая необходимость максимальной оптимизации фармакотерапии любой патологии у мужчин, особенно такой актуальной и распространенной, как СНМП. Клиницисту следует помнить, что СНМП – междисциплинарная проблема и полиэтиологический синдром, требующий индивидуального подхода к каждому пациенту. Не нужно забывать о выраженной гормонозависимости нижних мочевых путей и предстательной железы у мужчин и ключевой роли тестостерона в обеспечении их нормального анатомо-функционального состояния. Доказано, что дефицит тестостерона негативно влияет на нижние отделы урогенитального тракта у мужчин независимо от других урологических патологий, поэтому его необходимо рассматривать как важный патогенетический механизм и клиническую маску СНМП у мужчин.
I.A. Tyuzikov, PhD
Medical Center ‘Tandem-Plus’, Yaroslavl
Contact person: Igor A. Tyuzikov, phoenix-67@list.ru
In the review article, based on modern clinical and experimental foreign and domestic studies, the issues of multifactorial and polyethological pathogenesis of lower urinary tract symptoms (LUTS) are considered from the standpoint of hormone dependence (primarily, androgen dependence) of the lower parts of the male urogenital tract. In this regard, special attention is paid to testosterone deficiency as the most significant and well-known hormonal disorder in men and its main mechanisms, of participation in the pathogenesis of LUTS in men are considered in detail. According to the results of the literature review, it can be concluded that testosterone is one of the key hormones that ensure the normal anatomical and functional state of the lower urinary tract in men, and its deficiency is a significant factor in the initiation and progression of LUTS in them. Further evidence-based research in this direction is required, but the current literature data suggest that the hypogonadal state in men with LUTS is an unfavorable background, which cannot be ignored in clinical practice.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.