Онкогенный потенциал тканей у пациентов с остроконечными кондиломами гениталий
- Аннотация
- Статья
- Ссылки
- English


Последние годы внимание врачей разных специальностей все больше привлекают заболевания, ассоциированные с вирусом папилломы человека (ВПЧ) [1, 2]. Это связано с резким ростом инфицирования, значительной контагиозностью и способностью данного возбудителя трансформировать эпителиальные клетки, что в конечном итоге приводит к злокачественным новообразованиям [3–6].
Установлено, что у 15–28% женщин с ДНК ВПЧ (даже при нормальной цитологии) в течение нескольких лет развивается интраэпителиальная карцинома. Развитие неоплазии в отсутствие ДНК ВПЧ отмечается лишь в 1–3% случаев.
В настоящее время папилломавирусная инфекция (ПВИ) считается главным этиологическим фактором развития рака шейки матки. В структуре летальных исходов у женщин репродуктивного возраста рак шейки матки занимает первое место среди других типов рака [4, 7, 8].
Течение ПВИ может осложняться усилением онкогенного потенциала тканей, пораженных вирусом. Однако для развития онкологического процесса помимо персистенции генома ВПЧ необходимо нарушение структуры и функции клеточных генов [6]. Инициирующим фактором служит мутация в разных участках генов Е1/Е2, отвечающих за эписомальный статус ДНК ВПЧ.
При повреждении гена Е1 происходит интеграция генома ВПЧ в хромосомы клетки хозяина. Поскольку гены Е1/Е2 регулируют и контролируют вирусную транскрипцию, их разрушение завершается неконтролируемой экспрессией генов Е6/Е7, запускающих процессы опухолевой трансформации.
Аномально повышенная экспрессия генов E6 и Е7 приводит к выработке онкобелков Е6 и Е7 в цитоплазме клетки-хозяина. Онкогенные свойства продуктов Е6/Е7 обусловлены способностью образовывать комплексы с белками р53 (для Е6) и рRb (для Е7). ВПЧ Е6 связывает и приводит к деградации белка р53 – супрессора опухолевого роста, воздействует на теломеразу, стимулирующую клеточную иммортализацию, и на другие белки, регулирующие апоптоз и дифференциацию клетки. Белок Е7 связывает и функционально инактивирует рRb. Указанный опухолевый супрессорный ретинобластомный белок является регулятором ДНК-синтеза (S) фазы клеточного деления и связанных с ним белков р107 и р130. Эта инактивация обусловливает аккумуляцию мутаций, дисрегуляцию цикла клеточной прогрессии и является критической ступенью цервикального канцерогенеза.
При изменении нормальных функций р53 клетка, которая должна была погибнуть, начинает бесконтрольно делиться, и происходит опухолевидный рост. Белок Е7 нейтрализует противовирусную и противоопухолевую активность интерферона альфа благодаря способности избирательно блокировать большинство генов, индуцируемых интерфероном, сводя на нет действие интерферонотерапии. Данный белок также ингибирует экспрессию генов основного комплекса гистосовместимости, затрудняя распознавание опухолевых клеток иммунной системой хозяина. Кроме того, белок Е6 совместно с белком Е7 влияет на экспрессию гена, кодирующего интерлейкин 18, что также обеспечивает ускользание от иммунного ответа [9, 10].
Наличие онкобелков Е6/Е7 в материале из цервикального канала или шейки матки может рассматриваться как начало процесса перестройки в эпителиальных клетках, что имеет важное клиническое значение [9]. Клиническая картина и исход ПВИ зависят не только от типа вируса, но и от формы инфекции. Большинство случаев (80–90%) инфицирования завершаются спонтанной элиминацией ВПЧ, в то время как длительное персистирование ВПЧ способно приводить к злокачественной трансформации клеток эпителия шейки матки, а согласно последним данным, и тканей гениталий [1–3].
Персистенция ВПЧ, включая его онкогенные штаммы, в шейке матки изучена больше, чем в других тканях генитального тракта. К тому же получены данные о повышенной частоте развития рака гениталий у пациентов с такими манифестными формами ВПЧ, как остроконечные кондиломы.
Сказанное означает, что для повышения эффективности прогнозирования и профилактики предопухолевых процессов урогенитального тракта значение имеют не только методы, направленные на выявление ВПЧ, но и методы, позволяющие определить форму течения ПВИ и объективно оценить клиническую ситуацию.
Поскольку пусковой механизм избыточной и атипичной манифестации кондилом остается неясным, изучение иммуногенетических механизмов онкогенеза во взаимосвязи с состоянием иммунной системы, кожи, идентификация высокоонкогенных типов ВПЧ у больных с остроконечными кондиломами и разработка на основе полученных данных методов ранней, адекватной диагностики пускового механизма онкогенеза и комплексных методов лечения являются актуальной проблемой современной дерматовенерологии.
Цель настоящего исследования – оценить влияние того или иного высокоонкогенного типа ВПЧ (16/18, 31/33) на характер экспрессии онкопротеина р53 и течение генитального кондиломатоза.
Материал и методы
В исследовании участвовали пациенты с остроконечными кондиломами гениталий, а также здоровые лица. Первые составили основную группу, вторые – контрольную.
Для микробиологической диагностики использованы прямая микроскопия окрашенных мазков по Граму, среды для обнаружения факультативных анаэробов – кровяной агар, среда Эндо, среда ЭД-1 для выращивания урогенитальных микоплазм. Сопутствующая микрофлора определялась с помощью антибиотикограммы. Лабораторная диагностика внутриклеточных и вирусных возбудителей (Chlamydia trachomatis, Ureaplasma urealyticum, Gardnerella vaginalis, Cytomegalovirus (CMV), Herpesvirus II типа (HVII)) проводилась с использованием молекулярно-генетического метода – полимеразной цепной реакции (ПЦР). Серотипы Human papillomavirus (HPV) 16/18, 31/33 выделялись методом ПЦР при соскобе с эпителия вульвы и очагов скопления остроконечных кондилом.
Материалом для ДНК-типирования служила венозная кровь из локтевой вены в объеме 1 мл.
Для сбора, хранения и транспортировки крови использовали одноразовые пластиковые пробирки объемом 2,5 мл с антикоагулянтом (консерватором) объемом 0,5 мл. Кровь для дальнейшей обработки хранили при температуре не менее +4 ºС.
Выделение ДНК проводилось по стандартному протоколу.
Так, ДНК из цельной крови выделяли с помощью набора реагентов DiatomТМ DNAPrep200 (производство ООО «Лаборатория ИзоГен», Москва). Это лизирующие реагенты с гуанидинтиоцианатом, который предназначен для лизиса клеток, солюбилизации клеточного дебриса, а также для денатурации клеточных нуклеаз. В присутствии лизирующего реагента ДНК активно сорбируется на NucleoSTM-сорбенте. ДНК, элюированную из сорбента ЭкстраГеном ЕТМ, в дальнейшем использовали для проведения анализа.
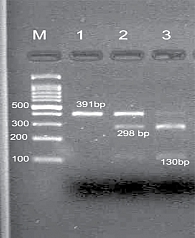
Полиморфизм длины рестрикционных фрагментов (ПДРФ, Restriction fragment length polymorphism, RFLP) – это способ исследования геномной ДНК путем ее разрезания с помощью эндонуклеаз рестрикции и дальнейшего анализа размеров образующихся фрагментов (рестриктов) путем гель-электрофореза (ДНК-электрофореза).
Для исследования ПДРФ гена ТР53 применяли рестрикционный фермент Bsh1236I (FERMENT ASINTERNATIONALINC).
Проведены исследования роли аргининовой замены в гене ТР53 в качестве риск-фактора развития цервикального рака. Полученные результаты коррелировали с генотипами вирусного гена Е6.
Мутация Арг72 в гене р53 определялась методом ПЦР с последующим ПДРФ-анализом.
Наличие мутации Арг72 гена р53 анализировали по разнице длины рестрикционных фрагментов, представленных на рисунке.
Результаты и их обсуждение
Распределение генотипов р53 в контрольной и основной группах было идентичным, в то время как полиморфизм по аргинину гена р53 был достоверно выше в основной группе. Расчет, проведенный методом Харди – Вайнберга, свидетельствовал об увеличении количества аргининовой мутации у пациентов с остроконечными кондиломами по сравнению со здоровыми лицами. Разница оказалась статистически достоверной (р = 0,02).
Распределение типов гена р53 в основной и контрольной группах не получило статистических различий и соответствовало распределению генов по закону Харди – Вайнберга (p = 0,49) (табл. 1).
Полиморфизм Арг72 гена р53 в группах различался. Так, у пациентов с остроконечными кондиломами и ВПЧ 16/18 распределение генотипов RR, PR и PP выглядело следующим образом: четыре (33%), семь (46%) и один (11%) соответственно, у пациентов с остроконечными кондиломами и ВПЧ 31/33 – пять (41%), пять (41%) и два (22%). У пациентов с остроконечными кондиломами без ВПЧ 16/18, 31/33 RR обнаружен в семи (63%) случаях, PR – в четырех (37%). У здоровых лиц показатели были самыми высокими (табл. 2).
Парное сравнение групп не выявило статистически значимых различий в уровне накопления мутантного гена р53. Однако тенденция к повышению экспрессии р53 в группе пациентов с остроконечными кондиломами и ВПЧ 16/18 оказалась более выраженной, чем в группах пациентов с остроконечными кондиломами и ВПЧ 31/33, группе пациентов с остроконечными кондиломами без ВПЧ 16/18 и 31/33, а также группе здоровых лиц. В этой же группе пациентов отмечались наибольшее количество рецидивов и более интенсивный рост кондилом.
Выводы
На основании результатов исследования были сделаны следующие выводы.
Во-первых, необходимо раннее и адекватное реагирование в группе пациентов с остроконечными кондиломами и ВПЧ 16/18. Это не только высоко онкопотенциальные агенты, но и иммуносупрессоры, которые на начальных этапах служат пусковым механизмом дисплазий.
Во-вторых, возможно формирование группы пациентов с риском развития фоновых и предраковых заболеваний гениталий.
T.A. Nabiyev, D.F. Porsokhonova, V.S. Novosyolov, A.I. Yakubovitch, M.A. Abdullayev
Republican Specialized Scientific and Practical Medical Center of Dermatovenereology and Cosmetology Ministry of Healthcare of Uzbekistan
I.M. Sechenov First Moscow State Medical University
Irkutsk State Medical University
Contact person: Delya Fozilovna Porsokhonova, delya.porsokhonova@mail.ru
The article presents the results of the study of p53 oncoproteins in patients with genital warts. Patients of the main group were randomized according to the principle of presence / absence of oncogenic HPV types (16/18, 31/33). The control group consisted of healthy volunteers. Depending on the oncogenic HPV types, the presence of the polymorphism of p53 gene Arg72 was different. However, the p53 mutant gene accumulation level did not show any statistically significant differences in the paired comparison of the groups. In the group with HPV 16/18 type, the tendency to increase the expression of p53 was more pronounced than in the group with HPV 31/33 type, the group with acute warts without HPV 16/18 and 31/33 types, as well as in the group of healthy individuals in the same group, the largest number of relapses and more intense growth of condylomas. Therefore, patients with genital warts having identified HPV 16/18 type require earlier and adequate diagnostics and treatment.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.