Оптимальные подходы к ведению пациентов с хроническими воспалительными заболеваниями дыхательных путей. XXVI Национальный конгресс по болезням органов дыхания. Сателлитный симпозиум компании «Натива»
- Аннотация
- Статья
- Ссылки



Способы ингаляционной доставки в педиатрической практике
Как отметил главный внештатный детский пульмонолог Департамента здравоохранения Москвы, профессор кафедры детских болезней Первого Московского государственного медицинского университета им. И.М. Сеченова, д.м.н. Александр Борисович МАЛАХОВ, устройство для ингаляционной терапии влияет на результат лечения не меньше, чем сам лекарственный препарат.
К основным факторам, влияющим на эффективность ингаляционной терапии, относятся система доставки, техника ингаляции, возрастные и психологические характеристики пациента и, конечно, объемная скорость вдоха, которая в детском возрасте имеет принципиальное значение. Как показывает практика, даже самый доступный по стоимости ингалятор может стать самым дорогим при неадекватном использовании.
Для ингаляционной терапии бронхообструктивного синдрома используются дозированные аэрозольные ингаляторы (ДАИ), ДАИ, активируемые вдохом (ДАИАВ), дозированные порошковые ингаляторы (ДПИ) и небулайзеры1. Выбор устройства зависит от возраста ребенка.
Например, ДАИ, характеризующиеся компактностью и доступностью, рекомендуются для использования у детей в возрасте старше пяти лет. Однако техника ингаляции с помощью таких ДАИ достаточно сложная. Для успешной ингаляции через ДАИ необходим очень глубокий вдох с одновременной активацией ингалятора. Сложности возникают и при проведении высокодозной бронхорасширяющей терапии, особенно в случае тяжелой бронхиальной астмы (БА). Кроме того, имеет место выраженное фарингеальное осаждение ингаляционного препарата.
В определенной степени решить данную проблему можно за счет одновременного применения ДАИ и спейсера или аэрочамбера. Но спейсер и аэрочамбер – дополнительные устройства и не всегда пригодны для самостоятельного использования маленьким ребенком. Применение спейсера у детей младше четырех лет требует наличия лицевой маски. В отличие от небулайзера при использовании спейсера неплотное прилегание лицевой маски существенно снижает эффективность терапии.
Альтернативой ДАИ являются ДАИАВ под названием «Легкое дыхание». Они не требуют синхронизации вдоха с нажатием на баллончик ингалятора, а для выброса дозы препарата достаточно скорости вдоха 10–25 л/мин. Однако у детей младшего возраста обычно применяются устройства со скоростью вдоха до 10 л/мин. Но следует отметить, что из-за стоимости данное устройство применяется все реже. Поэтому обычные ДАИ стандартно и успешно применяются для ингаляционных глюкокортикостероидов (ИГКС), бронхолитиков и комбинированных лекарственных препаратов.
Не предназначен для детей дошкольного возраста и Респимат Софт Мист – устройство, позволяющее получить ультратонкодисперсный мягкий аэрозоль.
Возрастные ограничения свойственны и для ДПИ. В целом ДПИ менее требовательны к технике ингаляции, но для генерации ингаляционного препарата необходим значительный респираторный поток (> 30 л/мин). Имеются сложности при проведении бронхорасширяющей терапии высокими дозами. К недостаткам можно отнести высокую стоимость ДПИ.
Минимальные значения скорости вдоха у ингаляторов различны.
Наиболее оптимальной техникой доставки препаратов в практике у детей до шести лет характеризуются небулайзеры, с помощью которых осуществляется непрерывная продукция аэрозоля с высокой пропорцией (> 50%) респирабельных частиц (менее 5 мкм) в течение 10–15 минут2. Важно, что небулайзерная терапия может использоваться у детей младшего возраста.
Существует четкая зависимость между легочной депозицией и клиническим эффектом препарата, которая для бронхорасширяющих дыхательных средств является линейной3. Небулайзеры отличаются более высокой легочной депозицией (свыше 20%) по сравнению с ДПИ (20%) и ДАИ (10%). Высокая клиническая эффективность небулайзерной терапии объясняется отсутствием необходимости координации вдоха и выдоха, возможностью проведения высокодозной бронхорасширяющей терапии при тяжелом приступе БА, возможностью включения в контур подачи кислорода или искусственной вентиляции легких, простой и легкой техникой ингаляций. К недостаткам относится довольно высокая стоимость.
Эффективность небулайзерной терапии зависит от лекарственного средства (активность, доза/объем, свойства), типа компрессора и самого небулайзера, состава аэрозоля (размер частиц), обучаемости и приверженности пациента лечению.
Различают струйные (компрессорные), ультразвуковые небулайзеры и небулайзеры мембранного типа. В струйных небулайзерах, которые признаны золотым стандартом терапии, распыление осуществляется по принципу Вентури сжатым воздухом. Струйные небулайзеры универсальны, недороги, доступны и способны распылять практически любые растворы для ингаляций. К недостаткам можно отнести высокий уровень шума и вес.
Ультразвуковые небулайзеры компактны и бесшумны, не требуют замены небулизационных камер, а процент попадающего на слизистую оболочку дыхательных путей аэрозоля достигает 90%. Но самый большой недостаток данного типа небулайзеров, ограничивающий их применение в педиатрической практике, заключается в том, что под воздействием ультразвука суспензии ИГКС, антибиотики, гормональные препараты, муколитики, как правило, разрушаются4.
Электронно-сетчатые (mesh) небулайзеры обладают преимуществами струйных и ультразвуковых ингаляторов. Они компактны, бесшумны и в отличие от ультразвуковых характеризуются пониженной частотой ультразвука, что позволяет использовать в mesh-небулайзерах препараты, которые противопоказаны в ультразвуковых. В отличие от ультразвуковых распыление лекарства в mesh-небулайзерах происходит в результате просеивания жидкости через очень маленькие отверстия. Недостаток состоит в том, что сетка мембраны требует аккуратного обращения.
На эффективность небулайзерной терапии могут влиять факторы, связанные с лекарственным препаратом. Его вязкость и поверхностное натяжение оказывают воздействие на выход и характеристики аэрозоля. Например, растворы антибиотиков имеют очень высокую вязкость, что требует использования мощных компрессоров и небулайзеров, активируемых вдохом. Осмолярность аэрозоля влияет на его депозицию. При прохождении через увлаженные дыхательные пути может увеличиваться размер частиц гипертонического аэрозоля и уменьшаться размер частиц гипотонического аэрозоля.
В 2015 г. Правительством РФ было издано постановление об ограничении и условиях допуска импортных лекарственных средств, включенных в перечень жизненно необходимых и важнейших лекарственных препаратов, к поставкам и закупкам государственных лечебных учреждений для льготного обеспечения и стационарного применения при наличии российских аналогичных лекарственных препаратов, послужившее мотивацией для производства отечественных лекарственных средств и сигналом врачебному профессиональному сообществу для более широкого применения в клинической практике отечественных лекарственных средств.
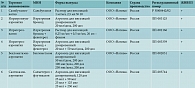
По мнению профессора А.Б. Малахова, достойное место среди производителей препаратов не только с доступной стоимостью, но и доказанной эффективностью и безопасностью занимает российская компания «Натива». Она выпускает целый перечень генерических ингаляционных препаратов для лечения БА и бронхообструктивного синдрома у детей (таблица).
В настоящее время все большее клиническое применение получает отечественная комбинация «ипратропия бромид/фенотерол» – препарат Ипратерол-натив, раствор для ингаляций, и Ипратерол-аэронатив, аэрозоль для ингаляций, разрешенный к применению у детей до шести лет. Ипратерол-натив успешно зарекомендовал себя в клинической практике в Клинике детских болезней Первого МГМУ им. И.М. Сеченова. Самым маленьким пациентам (от полутора лет) показан Сальбутамол-натив в форме раствора для ингаляций с действующим веществом сальбутамол. В настоящее время сальбутамол является единственным разрешенным в клинической практике бронхолитиком для применения у детей столь раннего возраста.
Препараты компании «Натива» характеризуются хорошей доказательной базой. В частности, исследователи сравнивали свойства воспроизведенного препарата Ипратерол-натив и оригинального препарата Беродуал в виде раствора для небулайзеров5. Полученные данные показали их полную идентичность по величине респирабельной фракции и профилям распределения частиц по размерам. Успешная клиническая практика применения Ипратерола-натив и Сальбутамола-натив у детей уже насчитывает свыше четырех лет.
Следует также отметить, что при терапии БА у детей по-прежнему актуально применение золотого стандарта ИГКС – беклометазона в форме аэрозоля для ингаляций. Беклометазон-аэронатив, производимый компанией «Натива» и разрешенный к применению у детей с четырех лет, успешно и давно применяется в клинической практике в Москве, в том числе в рамках льготного лекарственного обеспечения.
Доказательства сопоставимости качественных и количественных характеристик в совокупности с результатами эквивалентности in vitro являются обоснованными аргументами в пользу того, что российские ингаляционные генерики компании «Натива» способны обеспечить клиническую эффективность и профиль безопасности в такой же степени, как и оригинальные препараты, у пациентов с бронхообструктивным синдромом6.
Важный момент: в одной ингаляции можно использовать несколько лекарственных средств. В мультицентровых исследованиях не зафиксировано нежелательных явлений и ухудшения терапевтического эффекта при совместном введении препаратов (ипратропия бромид + амброксол, ипратропия бромид + фенотерол + амброксол)7. Вместе с тем при первичном использовании ингаляционной терапии у ребенка следует назначать препараты поочередно.
Завершая выступление, профессор А.Б. Малахов акцентировал внимание аудитории на основных преимуществах небулайзерной терапии в педиатрической практике:
- эффективность и качество (управляемый процесс ингаляции, отсутствие осложнений и побочных эффектов);
- универсальность использования (широкий спектр лекарственных средств по сравнению с ДАИ и ДПИ);
- рациональность (оптимальный воздушный поток для детей);
- экономичность (минимальные потери лекарственного средства во время ингаляций, малый остаточный объем после них).
Традиционная терапия хронической обструктивной болезни легких и БА при легочном туберкулезе
Доклад заведующей кафедрой фтизиатрии и фтизиохирургии Омского государственного медицинского университета, д.м.н., профессора Анны Владимировны МОРДЫК был посвящен лечению хронической обструктивной болезни легких (ХОБЛ) и БА у больных легочным туберкулезом. Чтобы продемонстрировать обоснованность выбора лечебной тактики при ведении пациентов с туберкулезом и ХОБЛ, профессор А.В. Мордык представила участникам симпозиума ряд клинических случаев.
Клинический случай 1. Пациент П., 39 лет. Курит на протяжении 24 лет, злоупотребляет алкоголем. Флюорографию не проходил шесть лет. Постоянный кашель с выделением мокроты. Одышка при незначительной нагрузке. Пациент обратился к участковому терапевту по поводу лихорадки (38 ºС). Больному выполнили флюорографию, результаты которой потребовали дообследования. В мокроте выявлено большое количество микробактерий туберкулеза: КУМ+(3).
Диагноз: инфильтративный туберкулез легких в фазе распада и обсеменения обоих легких, МБТ+, МГМ+. Одновременно диагностирована ХОБЛ 2-й степени (объем форсированного выдоха за первую секунду (ОФВ1) – 60%, оценка ХОБЛ по опроснику CAT (COPD Assessment Test) – 10 баллов), категория В.
Пациенту назначена химиотерапия по первому режиму и терапия ХОБЛ комбинированным препаратом Салтиказон-натив (салметерол 50 мкг + флутиказон 500 мкг, ДПИ) по одной ингаляции два раза в день.
На фоне комплексной терапии через два месяца отмечалась негативация мазка мокроты, через четыре месяца химиотерапии – абациллирование и закрытие полости распада. На фоне положительного эффекта к четвертому месяцу лечения было принято решение о постепенной замене комбинированной терапии препаратом Салтиказон-натив (сначала меньшая доза Салтиказон-натив (50/250 мкг), затем – монотерапия препаратом Формотерол-натив в дозе 12 мкг два раза в день). При выписке из стационара пациенту рекомендовано продолжать бронхолитическую терапию препаратом тиотропия бромид в дозе 18 мкг по одной ингаляции в день.
Клинический случай 2. Пациент В., 52 года. БОМЖ. Зимой поступил в Больницу скорой медицинской помощи (БСМП) № 1 в состоянии средней тяжести с лихорадкой (38,2 ºС). Помимо этого у пациента наблюдались одышка в покое и кашель с мокротой. Курит в течение 37 лет (от пяти сигарет до двух пачек в день). Переведен в противотуберкулезный диспансер.
При обследовании диагностирована ХОБЛ, категория А: ограничение воздушного потока средней степени тяжести, спирометрический класс GOLD 2 (ОФВ1 – 62%), 4 балла по шкале САТ, обострений нет. Данные МСКТ (мультиспиральная компьютерная томография) органов грудной клетки (ОГК): признаки хронического бронхита, эмфизема плюс периферическое образование S1–2 правого легкого – туберкулема. Форма туберкулемы ограниченная, но в фазе инфильтрации.
Пациенту назначили 60 доз химиотерапии по третьему режиму и терапию ХОБЛ препаратом Ипратропиум-аэронатив (ипратропия бромид 0,02 мг, ДАИ) по две ингаляции три раза в день. Через два месяца благоприятного терапевтического лечения пациенту успешно провели оперативное лечение в объеме резекции S1–2 правого легкого.
Анализируя первый клинический случай, профессор А.В. Мордык констатировала, что, согласно общепринятым стандартам, пациенту П. с ХОБЛ 2-й степени категории В следовало назначить монотерапию бета-2-агонистом длительного действия (ДДБА) или антихолинергетиком длительного действия (ДДАХ). В данном случае применение ингаляционного ГКС с ДДБА определялось фенотипом ХОБЛ, что согласуется с новым подходом к терапии ХОБЛ в соответствии с клиническими фенотипами8. У пациента П. смешанный фенотип «ХОБЛ/астма», который, согласно европейским рекомендациям (GesEPOC), предусматривает применение комбинации ДДБА + ИГКС в качестве стартовой терапии.
Клинический случай 3. Пациентка М., 46 лет. Курит в течение 28 лет (по 0,5–1 пачке в день). ХОБЛ: ограничение воздушного потока средней степени тяжести, спирометрический класс GOLD 2 (ОФВ1 – 65%), 12 баллов по шкале САТ, категория В. В течение года больна инфильтративным туберкулезом легких.
Пртивотуберкулезная терапия в течение 11,5 месяца и отсутствие терапии ХОБЛ (отсутствие препаратов в стационаре) не привели к положительному результату. У пациентки М. сформировались множественные туберкулемы на верхушках обоих легких. В настоящее время планируется проведение оперативного вмешательства в виде резекции верхних отделов двух легких.
Какой должна быть последующая терапевтическая тактика? По мнению профессора А.В. Мордык, не следует назначать фиксированную комбинацию ДДБА/ИГКС, способную вызвать обострение процесса, но можно использовать бронхолитическую терапию в режиме «по требованию», например Ипратерол-аэронатив, ДАИ.
Клинический случай 4. Пациентка К., 48 лет. Курит 32 года. Диагностирована ХОБЛ 2-й степени, категория В: ограничение воздушного потока средней степени тяжести, спирометрический класс GOLD 2 (ОФВ1 – 70%), 10 баллов по шкале САТ, одно обострение за последний год. Пациентка прооперирована по поводу туберкулеза. МСКТ ОГК: состояние после резекции левого легкого по поводу туберкулеза, признаки хронического бронхита, эмфиземы, выраженный локальный фиброз и плевральные наложения на верхушках обоих легких. Пациентке рекомендован ипратропия бромид 0,02 мг ДАИ (Ипртатропиум-аэронатив) по две ингаляции три раза в день.
Клинический случай 5. Пациент Д., 52 года. Стаж курения – 35 лет. Поступил с диагнозом ХОБЛ: ограничение воздушного потока средней тяжести, спирометрический класс GOLD 2 (ОФВ1 – 62%, ОФВ1/ФЖЕЛ (форсированная жизненная емкость легких) – 0,64), 18 баллов по шкале САТ, три обострения за последние 12 месяцев. По количеству обострений присвоена категория D. Пациент госпитализирован с обострением (усиление кашля, увеличение количества гнойной мокроты, субфебрильная температура).
Рентгенограмма ОКГ без патологических изменений, МСКТ ОГК – очагово-инфильтративные изменения в S2–6 правого легкого на фоне бронхоэктазов. В промывных водах бронхов обнаружена ДНК микобактерии туберкулеза, чувствительность к R сохранена. Посев на жидкие питательные среды – рост МБТ, 20 КОЕ (++), ЛУ (S). Переведен в противотуберкулезный диспансер.
Клинический диагноз: правосторонний инфильтративный туберкулез легких, МБТ-, МГМ+.
Пациенту назначили химиотерапию по первому режиму (120 доз). Начата терапия ХОБЛ препаратом Салтиказон-натив, ДПИ, в дозе 50/500 мкг по одной ингаляции два раза в день и раствором для ингаляций Ипратерол-натив по 20 капель + 2 мл физраствора на ингаляцию через небулайзер три раза в день до купирования обострения.
Пациент получал терапию препаратом Салтиказон-натив в дозе 50/500 мкг в течение трех месяцев, после чего был переведен на Салтиказон-натив в дозе 50/250 мкг по одной ингаляции два раза в день с последующей отменой и переводом на ДДАХ. Пациенту после отмены комбинированной терапии рекомендовано применение тиотропия бромида в дозе 18 мкг (Тиотропиум-натив 18 мкг, ДПИ) по одной ингаляции один раз в день.
На фоне комплексной терапии через два месяца отмечалось абациллирование, через четыре месяца химиотерапии – рассасывание большей части инфильтративных изменений.
Как показывает практика, длительное применение комбинированной терапии препаратом Салтиказон-натив в интенсивном режиме в комплексном лечении больных туберкулезом и ХОБЛ либо БА способствует более эффективному купированию процесса. Сказанное докладчик проиллюстрировала на примере пациентки с легочным туберкулезом и БА.
Клинический случай 6. Пациентка Б., 51 год, экономист. Из анамнеза: пациентка с контролируемой БА приобрела квартиру, в которой умер больной туберкулезом. Заболела зимой, остро. Появились симптомы ОРВИ, отмечались повышенная температура и приступообразный кашель с мокротой. Лечение антибактериальными препаратами оказалось неэффективным. В мокроте обнаружены КУМ, впоследствии – ДНК МБТ, МЛУ.
Клинический диагноз: диссеминированный двусторонний туберкулез легких в фазе инфильтрации, МБТ+, МЛУ; бронхиальная астма средней степени тяжести, частично контролируемая.
Назначен четвертый режим химиотерапии. В качестве терапии БА использовали препарат Салтиказон-натив в дозе 50/500 мкг по одной ингаляции два раза в день. Поскольку контроля над БА через неделю достичь не удалось, принято решение увеличить дозу препарата Салтиказон-натив до двух ингаляций два раза в день и добавить небулайзерную терапию препаратом Ипратерол-натив и сальбутамолом ДАИ «по требованию».
Через полтора месяца комплексной терапии контроль над астмой был достигнут, исчезла необходимость в небулайзерной терапии и приеме сальбутамола «по требованию». Через три месяца было рекомендовано снизить дозу препарата Салтиказон-натив, после чего пациентка в течение шести месяцев получала препарат Салтиказон-натив в дозе 50/250 мкг по одной ингаляции два раза в день.
Через два месяца комплексной терапии у больной отмечалась негативация мазка, через четыре месяца – абациллирование, рассасывание уплотнений очаговых изменений в обоих легких. Пациентка Б. продолжила терапию БА амбулаторно.
Таким образом, фиксированная комбинация «салметерол/флутиказон» (препарат Салтиказон-натив) в комплексном лечении лекарственно-чувствительного и лекарственно-устойчивого туберкулеза в интенсивной фазе у больных ХОБЛ или БА в условиях реальной клинической практики продемонстрировала эффективность. «Использование ингаляционных ГКС в комбинации с ДДБА у больных ХОБЛ и БА в интенсивной фазе будет способствовать более быстрой динамике купирования туберкулезного процесса и бронхообструктивного синдрома. Препаратом выбора для наших больных является Салтиказон-натив в дозе 50/500 мкг и в более низкой дозе 50/250 мкг на этапе постепенной отмены терапии», – констатировала профессор А.В. Мордык.
Экспертиза нетрудоспособности в пульмонологии
По данным директора НИИ пульмонологии Первого Санкт-Петербургского государственного медицинского университета им. И.М. Павлова – главного пульмонолога Комитета по здравоохранению Правительства Санкт-Петербурга, д.м.н., профессора Ольги Николаевны ТИТОВОЙ, болезни органов дыхания занимают первое место (33,4%) среди причин нетрудоспособности.
В структуре основных причин, вызывающих инвалидизацию населения, на протяжении последних десяти лет 8-е место занимает ХОБЛ, 13–15-е – БА.
Систематический анализ показывает, что за последнее десятилетие количество лет, прожитых с инвалидностью по причине ХОБЛ, увеличилось на 72%, а по причине БА – на 31%. В нашей стране динамика уровня первичной и вторичной инвалидности вследствие хронических болезней органов дыхания имеет тенденцию к снижению.
Временная нетрудоспособность – это вызванное болезнью или травмой функциональное состояние организма, при котором нарушение функций, препятствующее продолжению профессионального труда, носит временный обратимый характер.
Основной целью экспертизы временной нетрудоспособности является оценка состояния здоровья пациента с точки зрения возможности осуществления им профессиональной деятельности, а также определение степени и сроков временной нетрудоспособности.
Следует уточнить, что все положения в медицинской экспертизе разрабатываются и утверждаются на основании Конституции РФ (гл. 2, ст. 37, 39 и 41). Главными нормативными документами экспертизы временной нетрудоспособности остаются федеральные законы от 29.12.2006 № 255-ФЗ «Об обязательном социальном страховании на случай временной нетрудоспособности и в связи с материнством» и 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан Российской Федерации», приказы Минздравсоцразвития России от 29.06.2011 № 624н «Об утверждении порядка выдачи листков нетрудоспособности» и 26.04.2011 № 347н «Об утверждении формы бланка листка нетрудоспособности», письмо ФСС России от 01.09.2000 № 02-18/10-5766 «Об ориентировочных сроках временной нетрудоспособности при наиболее распространенных заболеваниях и травмах».
Продолжительность периода нетрудоспособности во многом зависит от клинического и трудового прогноза. Что подразумевается под этими понятиями? Клинический прогноз – научно обоснованное предположение о дальнейшем исходе болезни на основании комплексного анализа клинико-функциональных характеристик нарушения здоровья, течения заболевания и эффективности лечения.
Следовательно, клинический прогноз зависит от нозологической формы болезни органов дыхания, ее тяжести, степени выраженности, обратимости нарушений функции органов дыхания, характера течения, наличия осложнений, сопутствующих заболеваний и т.д. На основании этого клинический прогноз расценивается как благоприятный, если вероятность развития необратимых расстройств функций организма меньше 5%, и как неблагоприятный, если вероятность стабилизации заболевания менее 5%.
Трудовой прогноз – это оценка возможности осуществления пациентом трудовой деятельности. Как правило, трудовой прогноз определяется на ближайший год со дня начала временной нетрудоспособности и в большинстве случаев обусловлен клиническим прогнозом.
Процент инвалидизации среди пациентов, страдающих БА, достаточно высок. Под обострением БА понимается не только быстрое и значительное ухудшение состояния больного, но также отсутствие контроля над заболеванием в течение недели и наличие любых трех из следующих признаков:
- появление симптомов в дневные часы, хотя бы три дня в неделю;
- все случаи, при которых заболевание ограничивает повседневную активность больного;
- все случаи пробуждения ночью из-за симптомов астмы;
- потребность в ингаляционных бета-2-агонистах короткого действия (КДБА), хотя бы три дня в неделю;
- уменьшение ПСВ (пиковая скорость выдоха)/ОФВ1 ниже 80% должного.
Для легкой степени обострения БА характерны сохранность физической активности, вероятность одышки при ходьбе и ее отсутствие в состоянии покоя, частота дыхательных движений (ЧДД) до 20 в минуту, легкие симптомы, свистящие хрипы на выдохе, отсутствие тахикардии и гипоксемии, ПСВ более 80%. Пациенту с легким обострением БА вместе с назначением соответствующего лечения врач выдает листок нетрудоспособности до 15 календарных дней включительно.
При тяжелом обострении БА резко снижается физическая активность, отмечаются возбужденное состояние больного, затрудненное дыхание в покое, ЧДД более 25 в минуту, тяжелые симптомы, вспомогательная мускулатура участвует резко выраженно, дыхание свистящее на вдохе и на выдохе, тахикардия, гипоксемия, ПСВ менее 50% должного. При тяжелом жизнеугрожающем обострении БА листок нетрудоспособности выдается сроком до двух-трех месяцев. При амбулаторном и стационарном лечении больного в возрасте до 15 лет одному из членов семьи выдается листок нетрудоспособности по уходу за ним.
Тяжелое жизнеугрожающее обострение БА характеризуется выраженной и быстро прогрессирующей дыхательной недостаточностью, обусловленной обструкцией дыхательных путей вследствие воспаления, диффузного отека слизистой оболочки бронхов и полного прекращения эвакуации мокроты при формировании резистентности больного к ранее проводимой бронхолитической терапии. Такой тяжелый затянувшийся приступ БА развивается у 3–5% пациентов и может привести к летальному исходу в 1–10% случаев.
Развитию тяжелых приступов БА способствуют неадекватное лечение, контакт с аллергенами, инфекции дыхательных путей, воздействие поллютантов, нервно-психический стресс, физическая нагрузка и гипервентиляция, прием ряда лекарственных препаратов (нестероидные противовоспалительные препараты, антибиотики и проч.). Факторами риска летальных исходов являются наличие в анамнезе подобных тяжелых обострений БА, использование искусственной вентиляции легких, длительное применение системных ГКС и их недавняя отмена, отсутствие приема на данный момент ИГКС.
Пациент с тяжелым обострением БА должен быть госпитализирован. Показания к госпитализации:
- тяжелое обострение, в том числе в анамнезе;
- снижение ПСВ и ОФВ1 менее 25% до лечения или более 40% после лечения в амбулаторных условиях;
- частое использование КДБА (более восьми ингаляций за последние 24 недели);
- пожилой возраст.
Лечение пациента с тяжелым обострением БА в отделении скорой медицинской помощи направлено на полное купирование астматического статуса, гипоксемии, уменьшение тяжести обострения, свободное отхождение мокроты, достижение ЧДД менее 25 в минуту, частоты сердечных сокращений (ЧСС) менее 110 в минуту, ПСВ более 50% должного, сатурации более 92%.
Профессор О.Н. Титова отметила, что на сегодняшний день в Северо-Западном федеральном округе одной из острейших проблем остаются высокая заболеваемость пневмонией и рост смертности от нее. В связи с этим особое значение приобретают ранняя диагностика и адекватная тактика ведения больных пневмонией. Врач должен четко оценивать клинические признаки и симптомы заболевания, которые помогут в плане постановки диагноза. Для этого используют прогностическую шкалу SRB-65, содержащую всего четыре параметра и позволяющую определить стратегию лечения в соответствии с клинической оценкой и количеством баллов. В настоящее время шкала SRB-65 включена в рекомендации и протоколы по оказанию скорой медицинской помощи больным пневмонией.
Критериями восстановления трудоспособности после перенесенной пневмонии считаются положительная динамика и/или исчезновение рентгенологических признаков внебольничной пневмонии, отсутствие физикальных симптомов, нормализация температуры, отсутствие интоксикации, гнойной мокроты, положительная динамика и/или нормализация показателей клинического анализа крови, отсутствие признаков дыхательной недостаточности.
Ориентировочные сроки лечения при легкой пневмонии – 17–20 дней, при среднетяжелой – 20–23 дня, при тяжелой – 40–48 дней (из них стационарное лечение занимает 30–35 дней). Если у пациента сохраняются клинические признаки в виде субфебрилитета, остаточных изменений на рентгенограмме, сухого кашля, хрипов при аускультации, увеличения скорости оседания эритроцитов, слабости и потливости, а также имеет место благоприятный клинический прогноз, листок нетрудоспособности по решению врачебной комиссии после выписки из стационара может быть продлен еще на десять дней.
Еще одной причиной временной нетрудоспособности является обострение ХОБЛ – усиление одышки, увеличение количества мокроты и усиление «гнойности» мокроты. На основании этих признаков выделяют легкое (один из трех признаков), среднее (два из трех) и тяжелое (три признака) обострение ХОБЛ. Дополнительные признаки – наличие инфекции верхних дыхательных путей в течение последних пяти дней, лихорадка без других видимых причин, нарастание числа свистящих хрипов, усиление кашля, повышение ЧДД или ЧСС на 20%.
Критериями восстановления трудоспособности после обострения ХОБЛ считаются стабилизация или восстановление до исходного уровня клинических проявлений заболевания, данных лабораторных и инструментальных методов обследования, показателей функции внешнего дыхания. Ориентировочные сроки временной нетрудоспособности при легком обострении ХОБЛ не превышают десяти дней, при среднетяжелом – 14–16 дней, при тяжелом – 20–25 дней. При наличии сопутствующей дыхательной недостаточности указанные сроки удлиняются еще на пять – семь дней.
Листок нетрудоспособности члену семьи по уходу за больным с обострением ХОБЛ старше 15 лет при амбулаторном лечении выдается сроком на три дня. По решению врачебной комиссии этот срок продлевается до семи дней. Листок нетрудоспособности не выдается членам семьи при стационарном лечении больного или в отсутствие обострения.
Кроме того, листок нетрудоспособности не выдается лицам, которые проходят периодический медицинский осмотр, медицинское освидетельствование, медицинское обследование или лечение по направлению военкомата, находятся под стражей или арестом, а также учащимся, студентам, курсантам (выдается справка для освобождения от учебы).
Пациенты с ограничением жизнедеятельности направляются на медико-социальную экспертизу (МСЭ): при очевидном неблагоприятном прогнозе – не позднее четырех месяцев, при благоприятном – не позднее 10–12 месяцев. На МСЭ также направляются граждане при необходимости изменения программы профессиональной реабилитации работающим инвалидам из-за ухудшения клинического и трудового прогноза, независимо от группы и срока.
Инвалидом признается лицо, которое имеет нарушение здоровья со стойкими расстройствами функций организма, обусловленное заболеванием, последствиями травмы или дефектами, приводящее к ограничению жизнедеятельности и требующее его социальной защиты. Таковы три основных критерия, определяющих право гражданина на получение статуса инвалида. Признанием лица инвалидом и определением в установленном порядке потребности освидетельствования, включая меры социальной защиты и реабилитацию, исходя из оценки ограничения жизнедеятельности, вызванной стойкими расстройствами функций организма, занимается МСЭ.
В перечень главных нормативных документов МСЭ входят постановление Правительства РФ от 20.02.2006 № 95 «О порядке и условиях признания лица инвалидом», приказы Минтруда России от 29.01.2014 № 59н «Об утверждении Административного регламента по предоставлению государственной услуги по проведению медико-социальной экспертизы» и от 17.12.2015 № 1024н «О классификациях и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными и государственными учреждениями медико-социальной экспертизы».
Известно шесть видов стойких расстройств функций организма человека:
- нарушение психических функций;
- языковых и речевых функций;
- сенсорных функций;
- нейромышечных/скелетных функций, связанных с движением;
- функций соматических органов и систем, в том числе сердечно-сосудистой, дыхательной;
- нарушения, обусловленные физическим внешним уродством.
Нарушения классифицируют по степени выраженности:
- первая степень – стойкие незначительные нарушения функций организма в диапазоне от 10 до 30%;
- вторая степень – стойкие умеренные нарушения функций в диапазоне от 40 до 60%;
- третья степень – стойкие выраженные нарушения функций в диапазоне от 70 до 80%;
- четвертая степень – стойкие значительно выраженные нарушения функций в диапазоне от 90 до 100%.
Стойкие расстройства функций организма снижают способность к самообслуживанию, самостоятельному передвижению, ориентации и общению, контролю поведения, обучению, трудовой деятельности.
Каждая из этих категорий жизнедеятельности характеризуется определенной степенью выраженности ограничений:
- первая степень – способность к самообслуживанию при более длительном затрачивании времени, дробности ее выполнения, сокращении объема при необходимости вспомогательных технических средств;
- вторая степень – способность к самообслуживанию с регулярной частичной помощью других лиц с использованием при необходимости вспомогательных технических средств;
- третья степень (самая тяжелая) – неспособность к самообслуживанию, необходимость в постоянной посторонней помощи и уходе.
Для первой группы инвалидности характерна четвертая степень выраженности стойких нарушений (90–100%), для второй группы инвалидности – третья степень выраженности стойких нарушений (70–80%), для третьей группы – вторая степень выраженности стойких нарушений (40–60%).
Как отметила профессор О.Н. Титова, количественная оценка степени выраженности стойких нарушений функций дыхательной системы организма при проведении МСЭ основывается преимущественно на степени выраженности дыхательной недостаточности, обусловленной заболеваниями. Дыхательная недостаточность – это патологический синдром, при котором парциальное напряжение кислорода в артериальной крови (РаО2) составляет менее 60 мм рт. ст. и/или парциальное напряжение углекислого газа (РаСО2) превышает 45 мм рт. ст.
Дыхательную недостаточность классифицируют в зависимости от скорости развития, степени тяжести, патогенеза и анатомического признака.
По скорости развития различают острую дыхательную недостаточность (развивается в минуты/часы или дни, характерна гипоксемия и/или респираторный ацидоз либо алкалоз, представляет непосредственную угрозу жизни) и хроническую (развивается медленно (месяцы/годы), с появлением гипоксемии и/или гиперкапнии, представляет потенциальную угрозу для жизни).
Дыхательную недостаточность классифицируют по степени тяжести:
- первая степень – парциальное давление кислорода в артериальной крови (РаО2) – 60–79 мм рт. ст., сатурация (SaO2) – 90–94%;
- вторая степень – РаО2 – 40–59 мм рт. ст., SaO2 – 75–89%;
- третья степень – РаО2 < 40 мм рт. ст., SaO2 < 75%.
Выделяют четыре стадии хронической дыхательной недостаточности – начальную, субкомпенсированную, декомпенсированную и терминальную.
Первая, или начальная, стадия, как правило, не имеет ярких клинических проявлений, протекает скрыто. Имеют место учащение дыхания, появление одышки, ощущение нехватки воздуха при небольшой физической нагрузке.
Вторая, или субкомпенсированная, стадия характеризуется одышкой в состоянии покоя, постоянным ощущением нехватки воздуха, участием в дыхании вспомогательной мускулатуры, цианозом губ, подногтевых пространств, тахикардией, склонностью к повышению артериального давления, чувством тревоги, беспокойства.
Третья, или декомпенсированная, стадия проявляется резким усилением одышки, вынужденным положением больного, выраженным участием в дыхании вспомогательной мускулатуры, ощущением удушья, психомоторным возбуждением, тахикардией, распространенным цианозом, резким падением артериального давления.
Четвертая, или терминальная, стадия сопровождается резким угнетением сознания, вплоть до комы. Часто развивается гипоксемический отек головного мозга. Именно гипоксемическая гиперкапническая кома становится финалом терминальной стадии.
Завершая выступление, профессор О.Н. Титова еще раз подчеркнула, что количественная оценка степени выраженности стойких нарушений функций дыхательной системы организма при проведении МСЭ основана именно на степени выраженности дыхательной недостаточности. Это должны учитывать пульмонологи при направлении пациентов на МСЭ. Без сомнения, следует принимать во внимание и другие факторы патологического процесса, а именно форму и тяжесть течения заболевания, активность процесса, частоту обострений, включение органов-мишеней и, конечно, наличие осложнений и сопутствующих заболеваний.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.