Около 58–84% взрослой популяции испытывали когда-либо боль в пояснице, среди них 13,8% пациентов отмечали боль длительностью не менее двух недель в течение последних 6 месяцев, 17% страдают хроническими болями, у 11% болевой синдром приводит к социальной дезадаптации. В связи с тем, что пик заболеваемости приходится на трудоспособный возраст, проблема болей в пояснице имеет и экономическую значимость. Экономический ущерб включает в себя не только прямые потери в виде непосредственных затрат на оказание медицинской помощи и социальные выплаты (в связи с временной или постоянной потерей трудоспособности), но и непрямые – в виде ущерба от непроизведенной работы и снижения работоспособности [2].
Наиболее часто среди дегенеративно-дистрофических поражений позвоночника встречаются деформирующий спондилез, спондилоартроз, фиброз диска, остеопороз позвоночника (включая гормональную спондилопатию), а также их сочетания. Каждый из этих видов поражений имеет свои особенности патогенеза изменений нервной системы. Главными патогенетическими факторами являются компрессионные механизмы и рефлекторные влияния, сопровождающиеся воспалительным процессом и/или микроциркуляторными расстройствами. Среди них можно выделить синдромы компрессионного поражения пояснично-крестцовых корешков и рефлекторные синдромы: миофасциальный, мышечно-тонический, поражение связочного и суставного аппаратов позвоночника [3]. Рефлекторные болевые синдромы наиболее распространены в клинической практике и составляют около 85% случаев болей в спине [4].
Для болевых синдромов поясничного отдела позвоночника характерно сочетание рефлекторных мышечно-тонических и миофасциальных синдромов с изменениями в эмоциональной сфере, способствующими хронизации состояния. В некоторых случаях, наряду с другими причинами, именно это обусловливает особенности патогенеза поясничных болей (отсутствие корреляции между выраженностью дегенеративных изменений и интенсивностью болевого синдрома; отсутствие корреляции между выраженностью болевого синдрома и размером и локализацией межпозвоночной грыжи; рецидивирующее течение при сохранности патологических изменений анатомических структур и др.).
Ткани, составляющие позвоночный столб человека, за исключением костной, содержат нервные окончания и могут быть источником боли в спине. Свободные нервные окончания, выполняющие функцию болевых рецепторов, выявлены в капсулах апофизеальных (фасеточных) суставов, задней продольной, желтой, межостистых связках, твердой мозговой оболочке, эпидуральной жировой клетчатке, надкостнице позвонков, стенках артериол и вен, сосудах паравертебральных мышц, наружной трети фиброзного кольца межпозвоночных дисков. Возможно, часть этих окончаний в нормальных условиях выполняет иные функции, становясь ноцицепторами при изменении порога чувствительности и интенсивной стимуляции. Происхождение клинических симптомов определяется природой и направлением воздействующих сил, положением позвоночного столба в момент повреждения, морфологическими вариантами соответствующих структур.
Ноцицептивная афферентация может быть обусловлена повреждением фиброзного кольца, мышц, суставов, связок и нервных корешков, в результате чего происходит выброс альгогенных соединений (ионы водорода и калия, серотонин, гистамин, простагландины, брадикинин, субстанция Р) в межклеточную жидкость, окружающую ноцицепторы. Эти вещества играют ключевую роль в формировании боли, вызванной повреждением, ишемией и воспалением. Кроме прямого возбуждающего действия на мембраны ноцицепторов имеется непрямой механизм, связанный с нарушением локальной микроциркуляции. Повышенная проницаемость капилляров способствует экстравазации таких активных веществ, как кинины плазмы и серотонин. Это, в свою очередь, нарушает физиологическую и химическую среду вокруг ноцицепторов и усиливает их возбуждение. Продолжающийся выброс медиаторов воспаления может вызывать длительную импульсацию с развитием сенситизации ноцицептивных нейронов и формированием «вторичной гипералгезии» поврежденной ткани, способствующей хронизации патологического процесса [4].
Механизмы боли, обусловленной воспалительным процессом, в настоящее время активно изучаются. Показано, что любая периферическая боль связана с повышением чувствительности ноцицепторов. Увеличение чувствительности первичного ноцицептора в пораженной периферической ткани приводит к росту активности нейронов, посылающих импульсацию в спинной мозг и центральную нервную систему. Однако необходимо подчеркнуть, что в очаге воспаления может генерироваться спонтанная электрическая активность, вызывающая стойкий болевой синдром. Таким мощным индуктором болевой чувствительности являются провоспалительные компоненты: брадикинины, гистамин, нейрокинины, оксид азота, которые обычно обнаруживаются в очаге воспаления. Простагландины сами по себе не являются модераторами боли, они лишь повышают чувствительность ноцицепторов к различным стимулам, а накопление простагландинов коррелирует с развитием интенсивности воспаления и гипералгезией.
Простагландины как бы опосредуют вовлечение «спящих» ноцицепторов в процесс формирования вторичной воспалительной гипералгезии и периферической сенситизации. Именно поэтому, исходя из общих принципов патогенеза боли, в ходе терапии в первую очередь воздействие должно оказываться на ее источник, рецепторы и периферические волокна, а затем на задние рога спинного мозга, проводящие системы боли, мотивационно-аффективную сферу и регуляцию поведения. В пределах понимания механизмов, лежащих в основе ПКБ, клинически выделяют специфическую, радикулярную и неспецифическую боль. Специфическая боль определяется в тех случаях, когда ПКБ является симптомом определенной нозологической формы, которая нередко угрожает дальнейшему здоровью или жизни пациента (онкологическое заболевание, туберкулез, травма).
Радикулярная ПКБ возникает при вовлечении в патологический процесс корешка спинного мозга. Радикулярная боль отличается большей интенсивностью, дистальным (периферическим) распространением, ограничением пределами корешка и условиями, которые ее вызывают. Механизм этой боли заключается в искривлении, растяжении, раздражении или сдавливании корешка спинномозгового нерва. Почти всегда распространение боли происходит в направлении от центральной части спины (позвоночника) к дистальному участку нижней конечности. Кашель, чиханье или напряжение относятся к характерным факторам, усиливающим боль. Таким же действием обладает любое движение, которое вызывает растяжение нерва или увеличение давления спинномозговой жидкости. Среди структурных повреждений, вызывающих радикулярную ПКБ, можно выделить: грыжи пульпозного ядра; узкий позвоночный канал (стеноз центрального канала, стеноз латерального канала); нестабильность вследствие поражения дисков (дегенерации межпозвоночного диска) или внедисковых тканей (фасеточных суставов, спондилолистеза). Перечисленные факторы приводят к инвалидизации, ухудшающей качество жизни пациентов [5].
Неспецифической считают острую боль или обострение ПКБ, при которых точный диагноз серьезного заболевания (травма, опухоль и др.) или поражения корешка спинного мозга выявить не удается. Исследования показывают, что имеется явная диссоциация между клиническими симптомами ПКБ и степенью выраженности патологических изменений пояснично-крестцового отдела позвоночника при исследованиях с применением методов нейровизуализации, позволяющая примерно 85% ПКБ такого рода смело расценивать как неспецифические [6]. Следовательно, в большинстве случаев ПКБ определенный этиологический диагноз или патологический процесс установить невозможно. При этом известно, что распространенность дегенеративно-дистрофических изменений диска увеличивается с возрастом, а возникновение и сопутствующая дезадаптация при ПКБ имеют пик распространенности в возрастном диапазоне 35–55 лет, то есть в период наиболее работоспособного возраста [7, 8]. Так, при проведении магнитно-резонансной томографии у обследованных в возрасте от 25 до 39 лет без клинических признаков и симптомов ПКБ более чем в 35% случаев, а в группе старше 60 лет – в 100% случаев выявлялись протрузии дисков, по крайней мере, на одном уровне. Авторы полагают, что бессимптомные грыжи дисков по данным компьютерной и магнитно-резонансной томографии или миелографии встречаются в 30–40% случаев [9].
Известно также подразделение на первичные и вторичные ПКБ. Первичные обусловлены дистрофическими и функциональными изменениями в тканях опорно-двигательного аппарата позвоночника (дугоотростчатые суставы, межпозвонковые диски, фасции, мышцы, сухожилия, связки) с возможным вовлечением смежных структур (корешок, нерв). Все остальные варианты ПКБ относятся к вторичным, причинами которых могут быть врожденные аномалии (люмбализация, сакрализация, сегментарная нестабильность в рамках врожденной гипермобильности или коллагенопатии), травмы (переломы позвонков), артриты (анкилозирующий спондилит, ревматоидный артрит и др.) и отраженные боли при заболеваниях органов брюшной полости и мочеполовых органов. Иногда, учитывая причину боли, ПКБ подразделяют на вертеброгенные и невертеброгенные. К первым относится болевой синдром, обусловленный патологическими и функциональными изменениями позвоночных двигательных сегментов, к невертеброгенным – миофасциальный болевой синдром, психогенные ПКБ и отраженные боли при заболеваниях органов брюшной полости и мочеполовых органов [10].
По длительности клинических проявлений ПКБ выделяют транзиторную, острую и хроническую боль. Дело, однако, заключается не столько во временных различиях, сколько в нейрофизиологических, психологических и клинических особенностях. Острая боль всегда является симптомом, а хроническая боль может быть по существу самостоятельной болезнью. Понятно, что и терапевтическая тактика при устранении острой и хронической боли будет разной. Хроническая боль в своей патофизиологической основе может иметь патологический процесс в соматической сфере и/или первичную или вторичную дисфункцию периферической или центральной нервной системы, она также может быть вызвана психологическими факторами. Важно четко представлять, что несвоевременное и неадекватное лечение острой боли может стать причиной ее хронизации.
Анальгетиками первого ряда для лечения ПКБ являются нестероидные противовоспалительные препараты (НПВП). К анальгетикам второго ряда относят антидепрессанты, антиконвульсанты, миорелаксанты, блокаторы Са2+-каналов и др. Комбинирование различных форм препаратов и дозировки подбирают индивидуально. В неврологии применение НПВП ориентировано на неспецифическую вертеброгенную боль, обусловленную вовлечением в патологический процесс суставов позвоночного столба и рефлекторным вовлечением мышечной составляющей физиологического корсета, длительное сокращение мышц которого уже на ранних этапах может становиться самостоятельным (вторичным) источником боли в силу развития в мышцах (при длительном сокращении) асептического воспалительного процесса.
Механизм действия НПВП состоит в ингибировании циклооксигеназы (ЦОГ) – ключевого фермента в каскаде метаболизма арахидоновой кислоты, который является предшественником простагландинов, простациклинов и тромбоксанов [11]. В настоящее время выделены два изофермента ЦОГ. ЦОГ-1 является структурным ферментом, постоянно присутствующим в большинстве тканей, участвующим в регуляции множества физиологических процессов [12, 13]. ЦОГ-2 в норме в большинстве тканей не присутствует, ее экспрессия увеличивается на фоне воспаления, приводя к повышению уровня провоспалительных субстанций (простагландины групп F и I) [14]. Именно ингибирование ЦОГ-2 рассматривается как один из важнейших механизмов противовоспалительной, анальгетической активности препаратов, а ингибирование ЦОГ-1 – как механизм развития большинства побочных эффектов [13].
С тех пор как было установлено значение индуцибельной ЦОГ-2 в каскаде превращения арахидоновой кислоты в провоспалительные простагландины, интерес к роли ЦОГ-2 в развитии болевого стимула и уменьшении боли при подавлении ЦОГ-2 существенно возрос. Специальные исследования показали, что активность ЦОГ-2 в развитии гипералгезий действительно играет большую роль. При воспалительной реакции на периферии в спинномозговой жидкости повышается уровень простагландинов, которые проявляют чрезвычайную чувствительность к ингибированию ЦОГ-2. Исследования последних лет продемонстрировали, что ЦОГ-2 является естественным (конститутивным) ферментом, экспрессируемым в центральной нервной системе, поэтому участие ЦОГ-2 в развитии боли приобретает большое практическое значение [15].
НПВП относятся к числу наиболее часто применяемых в практической медицине лекарственных препаратов. Препараты этой группы регулярно используют в своей работе более 80% врачей различных специальностей [16]. НПВП представляют собой гетерогенную группу, в которую входит не менее ста веществ, относящихся к нескольким основным химическим группам (производные салициловой, индоловой, пропионовой, гетероарилуксусной, энолиоковой кислот). К сожалению, «химическая» классификация не позволяет прогнозировать как клиническую эффективность, так и выраженность различных побочных эффектов препаратов. Непрекращающиеся исследования в области синтеза новых НПВП связаны именно с неудовлетворенностью врачей и пациентов соотношением «риск/польза» при использовании НПВП. В целом количество пациентов, у которых отмечаются побочные эффекты, обусловленные механизмом действия НПВП, достигает 25% [13].
Гастроэнтерологические побочные эффекты НПВП условно подразделяются на несколько основных категорий: симптоматические (такие как тошнота, рвота, диарея или запоры, боли в животе, изжога); НПВП-гастропатии (эрозии и язвы желудка или двенадцатиперстной кишки, в том числе перфоративные и сопровождающиеся кровотечениями); поражения кишечника. В то время как побочные эффекты наблюдаются в среднем у 30–40% больных и зачастую служат причиной отказа от дальнейшего лечения, их частота слабо коррелирует с более тяжелыми осложнениями [15]. По частоте развития этих побочных эффектов все неселективные НПВП стоят приблизительно на одном уровне, за исключением таких препаратов, как индометацин, пироксикам и особенно кеторол (кеторолака трометамин), которые обусловливают значительно большее число тяжелых осложнений такого рода [17].
Факторами риска развития нарушений со стороны желудочно-кишечного тракта на фоне приема НПВП являются: возраст старше 65 лет; заболевания желудочно-кишечного тракта в анамнезе; сопутствующие заболевания в виде застойной сердечной недостаточности, артериальной гипертонии, печеночной недостаточности; прием диуретиков, ингибиторов ангиотензинпревращающего фермента и антикоагулянтов; высокие дозы или одновременный прием нескольких НПВП (кроме низких доз аспирина), глюкокортикоидов, НПВП с длительным периодом полувыведения и неселективных в отношении изоформ ЦОГ. В неврологической практике терапии ПКБ достаточно широкое применение получили препараты кетопрофена: Кетонал, Фламакс, Дексалгин (декскетопрофен). Однако перечень соединений кетопрофена, применяемых в неврологической практике, на сегодняшний день был бы недостаточным без упоминания еще одного его производного – Артрозилена (синтезирован компанией Dompé laboratory и представлен на рынке с 1973 г.).
Артрозилен – лизиновая соль 2-(3-бензоилфенил)пропионовой кислоты (кетопрофена); основной механизм – анальгетический и противовоспалительный, включающий ингибирование изоферментов циклооксигеназы (ЦОГ-1, ЦОГ-2), которые катализируют превращение арахидоновой кислоты в простагландины (F, D и E), простациклины и тромбоксан. Кетопрофена лизиновая соль, в отличие от кетопрофена, является быстрорастворимым соединением с нейтральной рН, вследствие чего практически не раздражает желудочно-кишечный тракт. Артрозилен (кетопрофена лизиновая соль) не оказывает катаболического влияния на суставной хрящ. Благодаря более быстрому растворению через 15 мин после инъекции препарат быстрее проходит через гематоэнцефалический барьер и остается в постоянной концентрации в сыворотке крови от 2 до 18 ч. Превращение кетопрофена в его лизиновую соль повышает растворимость молекулы по сравнению с обычным кетопрофеном. Это свойство гарантирует более быстрое и полное всасывание, а также более раннее достижение пиковой концентрации в плазме и быстрый эффект.
Механизм противовоспалительного действия Артрозилена связан с нарушением синтеза простаноидов (основных медиаторов воспаления) из арахидоновой кислоты путем блокады ЦОГ 1-го и 2-го типов. Кроме того, препарат подавляет выработку лейкотриенов, обладающих хемотаксическим действием. Препарат обладает и антибрадикининовой активностью. Артрозилен стабилизирует лизосомальные мембраны и задерживает высвобождение из них ферментов, способствующих разрушению ткани при хроническом воспалении, снижает активность цитокинов, тормозит активность нейтрофилов (цитокины, особенно интерлейкин-1 и фактор некроза опухоли, высвобождающиеся при активации нейтрофилов, играют решающую роль в воспалительном повреждении тканей). Блокада под действием препарата активации нейтрофилов, возможно, влияет на иммунные процессы, протекающие при ревматических заболеваниях.
Обезболивающий эффект Артрозилена определяется его прямым и непрямым влиянием на болевые рецепторы на уровне синапсов и в центральной нервной системе. Непрямое периферическое антиноцицептивное действие связано, во-первых, с торможением синтеза простагландинов, повышающих чувствительность свободных нервных окончаний к раздражителям (простагландины также усиливают действие и других медиаторов воспаления). Во-вторых, важным компонентом выраженного периферического анальгетического эффекта Артрозилена является его антибрадикининовая активность (брадикинин является одной из наиболее мощных эндогенных субстанций, способствующих развитию боли). Артрозилен оказывает и прямое влияние на болевые рецепторы, способствуя деполяризации ионных каналов, за счет чего осуществляется быстрое угнетение болевой реакции. Центральное действие Артрозилена определяется изменением конфигурации G-белка, расположенного на постсинаптической мембране нейронов, что снижает болевую афферентацию.
Под нашим наблюдением находилось 36 пациентов (20 женщин и 16 мужчин) с обострением неспецифической боли в пояснично-крестцовом отделе позвоночника в возрасте 47,5 ± 9,8 лет. Условия включения в исследование определялись рядом факторов: возраст пациента от 25 до 65 лет, интенсивность боли свыше 4 баллов по визуально-ранговой шкале, боль в пояснично-крестцовой области, обусловленная скелетно-мышечными расстройствами, что подтверждалось клиническими и нейровизуализационными методами обследования. Критериями исключения из исследования были: клинические симптомы радикулопатии, аллергическая реакция на НПВП в анамнезе, фибромиалгия, активный неопластический процесс, диагноз злокачественного новообразования в течение последних 3 лет, прием антиконвульсантов, антидепрессантов, барбитуратов, анксиолитиков, миорелаксантов менее чем за 24 ч до исследования, алкогольная и наркотическая зависимость, наличие каких-либо заболеваний, которые, по мнению исследователя, могут повлиять на результаты исследования или безопасность пациента.
Структура исследования предусматривала применение Артрозилена в форме внутримышечных инъекций (160 мг) 1 р/сут в течение 3 дней, далее в течение последующих 2 недель применение препарата внутрь (320 мг) 1 р/сут. На фоне перорального применения препарата допускалось использование топической терапии в виде 5%-ного крема Артрозилен по усмотрению пациента. Лечение могло быть дополнено физиотерапевтическими процедурами, лечебной физической культурой, массажем. Эффективность проводимой терапии анализировалась с учетом:
- интенсивности боли по визуальной ранговой шкале в исходном состоянии и в динамике через 30 мин и через 1 ч после первой инъекции, в эти же интервалы – после третьей инъекции (то есть после окончания курса инъекций) и по окончании терапии;
- степени инвалидизации, обусловленной болевым синдромом в спине, с помощью опросника Освестри в 1-й день наблюдения и по окончании терапии;
- суммарной степени выраженности миогенного компонента в эти же периоды в категориях: спонтанная боль, тонус мышц, их болезненность, продолжительность болезненности после пальпации (каждая характеристика оценивалась по трехбалльной шкале).
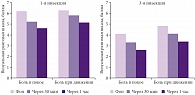
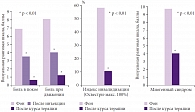
Все пациенты обследовались соматически и неврологически до и после курса терапии. Кроме того, пациенты вели дневник для ежедневной регистрации динамики болевого синдрома и появления нежелательных реакций. Результаты исследования (рис. 1) показывают, что болевой синдром, оцениваемый по визуальной ранговой шкале, достаточно быстро уменьшается, хотя такое снижение и не является достоверным; тенденция к неуклонному снижению интенсивности боли сохраняется от первой процедуры к третьей. Общий курс инъекционной терапии Артрозиленом обеспечивает уменьшение выраженности болевого синдрома более чем на 3 балла в покое и на 4 балла при движении. Одновременно с уменьшением болевого синдрома улучшаются показатели, характеризующие степень вовлечения миогенного компонента: оценка его значения снижается почти на 6 баллов (рис. 2). Суммарно уже эти две характеристики снижают индекс инвалидизации (Освестри) почти на 50%. Однако анализируемые показатели не достигают максимально низкого значения. Особенно подчеркнем отсутствие каких-либо побочных нежелательных явлений у пациентов, принимавших участие в исследовании. Следует учесть, что помимо приема НПВП (Артрозилена) следует включать в терапию неспецифических болей в спине препараты, воздействующие на невропатический и психогенный компоненты болевого синдрома (например, антиконвульсанты и антидепрессанты).