Алкогольная миопатия: вопросы патогенеза и подходы к лечению
- Аннотация
- Статья
- Ссылки

По данным Всемирной организации здравоохранения, злоупотребление алкоголем является третьей по частоте (после сердечно-сосудистых и онкологических заболеваний) причиной смертности в современном мире. Лица, злоупотребляющие спиртными напитками, живут в среднем на 15–20 лет меньше, чем люди непьющие. Серьезное положение в связи с чрезмерным потреблением алкоголя сложилось и в Российской Федерации, где за последние полвека уровень потребления спиртных напитков вырос в несколько раз.
Принято считать, что хроническая алкогольная интоксикация является причиной развития алкогольной болезни, рассматриваемой как совокупность психических, неврологических и висцеральных расстройств, развивающихся вследствие злоупотребления алкоголем. Алкогольная болезнь – заболевание, при котором длительная интоксикация этанолом приводит к возникновению характерных структурных изменений в органах и системах организма, проявляющихся соответствующей клинической симптоматикой [1]. Для нее характерен полиморфизм поражения как центральной, так и периферической нервной системы, причем поражение скелетных мышц является, с одной стороны, одной из наиболее частых, а с другой – наименее изученной проблемой. По данным V.R. Preedy и соавт., поражение скелетных мышц отмечается у 40–60% пациентов, злоупотребляющих алкоголем [2].
Первое описание мышечной слабости, развившейся на фоне длительного приема алкоголя, принадлежит J. Jackson и относится к 1822 г. [3]. В 1887 г. С.С. Корсаков защитил докторскую диссертацию «Об алкогольном параличе» [4]. Более активно данную проблему стали изучать во второй половине XX в. Долгое время считалось, что развитие мышечной слабости связано с денервационными изменениями мышц вследствие алкогольной полиневропатии. Однако проведенное в 1986 г. морфологическое исследование биоптатов мышечной ткани у больных с клиническими проявлениями алкогольной миопатии показало отсутствие в них изменений, характерных для денервации, в виде «феномена группировки» мышечных волокон [5].
В настоящее время алкогольную миопатию рассматривают как самостоятельную нозологическую форму, которая может сочетаться с алкогольной полиневропатией. В целом алкогольная миопатия развивается независимо от других проявлений алкогольной болезни, таких как поражение печени, сердечной мышцы, синдром мальабсорбции [6]. В МКБ-10 ей выделена отдельная рубрика, однако единых диагностических критериев не разработано.
В рамках алкогольной болезни выделяют несколько основных форм поражения мышечной ткани: острую, хроническую алкогольную миопатию, алкогольную кардиомиопатию. Ряд авторов в качестве отдельной клинической формы выделяют также асимптомную алкогольную миопатию [7].
Острая алкогольная миопатия встречается в 1–5% случаев, развивается, как правило, после тяжелого запоя и проявляется слабостью преимущественно проксимальных групп мышц, сопровождающейся резкой болезненностью и отеком пораженных мышц, значительным повышением уровня креатинкиназы в плазме крови, миоглобинурией. Данные игольчатой миографии указывают на наличие денервационной спонтанной активности в виде потенциалов фибрилляций и уменьшение амплитуды и длительности потенциалов действия двигательных единиц (ПДДЕ). При морфологическом исследовании выявляется некроз различных типов мышечных волокон (рабдомиолиз), что послужило основанием для определения этой клинической формы алкогольной миопатии как острой некротизирующей миопатии с высоким риском развития острой почечной недостаточности [8]. Лечение этой формы должно проводиться в отделении интенсивной терапии и включать назначение витаминов группы В, поддержание электролитного баланса, контроль диуреза. В случае развития острой почечной недостаточности показано проведение гемодиализа. При благоприятных условиях процесс восстановления занимает несколько недель или месяцев, однако более половины случаев заканчиваются летально вследствие присоединившейся острой почечной недостаточности.
К острым алкогольным миопатиям относят также острую гипокалиемическую миопатию, характеризующуюся генерализованной мышечной слабостью и отсутствием болезненности и отечности пораженных мышц [9]. Уровень креатинкиназы в этих случаях также значительно повышен. Содержание калия в плазме крови снижено и находится в пределах 1,4–2,1 ммоль/л (норма – 3,6–6,3 ммоль/л). При морфологическом исследовании может определяться некроз отдельных мышечных волокон и изменения структуры вакуолей. Лечение этой формы включает внутривенное введение хлорида калия в течение нескольких дней с последующим переходом на пероральный прием препарата под контролем уровня калия в крови и моче. Регресс симптоматики, как правило, отмечается в течение 1–2 недель.
Для асимптомной алкогольной миопатии характерно повышение уровня креатинкиназы в крови пациентов, злоупотребляющих алкоголем, при отсутствии жалоб и клинических проявлений мышечной слабости. Биопсия мышц с последующим морфометрическим и иммуногистохимическим исследованием больным этой группы не проводилась. Других заболеваний, сопровождающихся повышением креатинкиназы в крови, у пациентов не выявлено. Тем не менее нельзя исключить, что асимптомное повышение креатинкиназы является субклинической формой острой некротизирующей или гипокалиемической алкогольной миопатии [10].
Отдельную группу в рамках алкогольной миопатии составляют пациенты с алкогольной кардиомиопатией, проявляющейся снижением сократительной функции миокарда, снижением сердечного выброса, нарушениями ритма сердечных сокращений [11]. Частота алкогольной кардиомиопатии составляет 15–35%. В настоящее время алкоголизм считают наиболее частой причиной поражения сердечной мышцы неишемического генеза [12].
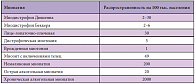
Самой распространенной и наименее изученной является хроническая алкогольная миопатия. По данным F. Martin и M.E. Reily (табл. 1), ее распространенность составляет 2000 случаев на 100 тыс. населения, что значительно превышает распространенность наследственных и некоторых метаболических миопатий [13, 14].
Данная форма считается наиболее вероятной причиной развития проксимальных парезов у пациентов, злоупотребляющих алкоголем. Клинические проявления хронической алкогольной миопатии в виде проксимальной мышечной слабости и связанных с ней нарушений походки не сопровождаются повышением уровня креатинфосфокиназы в плазме крови и характерными для первично-мышечного уровня поражения изменениями электромиограммы (ЭМГ), что отличает ее от острой алкогольной миопатии и других форм метаболических и прогрессирующих миодистрофий. В настоящее время установлено, что уровень креатинфосфокиназы и миопатический ЭМГ-паттерн не являются специфичными для какого-либо первично-мышечного заболевания, а лишь отражают выраженность деструктивных процессов в мышечной ткани.
«Золотым стандартом» в диагностике хронической алкогольной миопатии считают проведение биопсии проксимальных мышц с последующим иммуногистохимическим и морфометрическим исследованием с целью типирования различных изоформ тяжелых цепей миозина в мышечных волокнах и оценки площади их поперечного сечения [2].
Мышечные волокна разделяют на два типа в зависимости от того, какие изоформы тяжелых цепей сократительного белка миозина в них синтезируются. Преобладание того или иного типа изоформ тяжелых цепей миозина определяет скорость, силу мышечного сокращения и метаболический тип его энергетического обеспечения. Наличие атрофического процесса подтверждается с помощью измерения площади мышечных волокон различных типов и сравнения полученных результатов с результатами аналогичных измерений в группе контроля (здоровые добровольцы). Большинство исследований показало, что у лиц с хронической алкогольной миопатией определяется преимущественное уменьшение размеров мышечных волокон II типа (быстрые гликолитические и окислительно-гликолитические волокна), в то время как волокна I типа остаются относительно интактными (рис. 1) [15, 16]. Для хронической алкогольной миопатии также характерно то, что атрофические изменения мышечных волокон не сопровождаются некрозом и явлениями воспалительной инфильтрации.
Патогенетические механизмы развития хронической алкогольной миопатии остаются до конца не изученными. Предполагается, что в основе атрофического процесса в скелетной мышце лежит дисбаланс синтеза и распада структурных белков. Результаты исследований показали, что при хронической алкогольной миопатии определяющим является снижение синтеза белка, в то время как протеолитическая активность остается практически неизменной, в отличие от других метаболических миопатий, при которых преобладают процессы протеолиза [17]. Высказываются предположения, что этанол, не усиливая в целом протеолиз, может оказывать избирательное повреждающее воздействие на сократительные белки скелетных мышц, например на миозин [18].
К основным регуляторам синтеза белка в мышце относят соматотропный гормон, инсулиноподобный фактор роста – I (IGF-I) и его основной связывающий белок. IGF-I – важный системный регулятор анаболических процессов в мышце. Более 95% IGF-I синтезируется гепатоцитами. Основным фактором, регулирующим его продукцию, является гормон роста. В экспериментальных работах показано, что хроническое потребление алкоголя снижает уровень циркулирующего в крови IGF-I, в основном из-за снижения скорости синтеза и секреции его печенью [19, 20].
Cнижение содержания IGF-I в системном кровотоке может вызывать атрофический процесс, который наблюдается при хронической алкогольной миопатии. В пользу этой гипотезы свидетельствует и то, что введение алкоголизированным грызунам IGF-I в комплексе с его основным связывающим белком приводило к нормализации концентрации IGF-I в плазме крови [21, 22]. Получены результаты, свидетельствующие об уменьшении числа ядер мышечных волокон и их предшественников у лиц с хронической алкогольной интоксикацией, что также может быть одним из проявлений атрофического процесса [23]. Обсуждается роль апоптоза в повреждении скелетных мышц на фоне хронического алкоголизма [24].
В случае длительной алкоголизации заболевание носит прогредиентный характер с постепенным вовлечением в патологический процесс различных групп скелетных мышц, сопровождающийся прогрессирующим снижением мышечной массы (до 30%). Ранее считалось, что даже при длительном ежедневном употреблении алкоголя (5–10 лет) его отмена приводит к регрессу клинических проявлений алкогольной миопатии. Однако детальное морфологическое исследование пораженных мышц показало, что в случаях тяжелой хронической алкогольной миопатии даже через 5 лет после отмены алкоголя не происходит регресса клинических и морфологических признаков заболевания [25].
Тактика лечения хронической алкогольной миопатии в настоящее время не разработана. Это связано с отсутствием единой теории патогенеза данного заболевания. Основу лечения составляют полный отказ от приема алкоголя и восстановление полноценного сбалансированного питания.
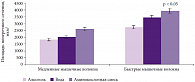
Учитывая, что основным механизмом возникновения хронической алкогольной миопатии считают процессы нарушения белкового синтеза, проводятся экспериментальные работы, направленные на изучение возможных путей коррекции данного состояния. В частности, в эксперименте с лабораторными животными показана роль лейцинсодержащей аминокислотной смеси в качестве возможного корректора нарушения синтеза белка. Применение ее в период восстановления у предварительно алкоголизированных крыс позволило ускорить процессы увеличения размеров быстрых мышечных волокон, которые в первую очередь страдают при хронической интоксикации. Так, в группе животных, получавших лейцинсодержащую аминокислотную смесь, увеличение площади поперечного сечения быстрых мышечных волокон было в 1,7 раза больше, чем в группе грызунов, получавших только корм и воду (рис. 2) [23].
В дальнейшем возможно изучение эффекта лейцина в отношении восстановления атрофированных мышечных волокон у пациентов с хронической алкогольной миопатией. При положительном результате это позволит включать лейцинсодержащие аминокислотные смеси в схему лечения хронической алкогольной миопатии.
СПРАВКА
Ряд исследований посвящены изучению роли антиоксидантов в качестве возможных корректоров атрофического процесса. Так, проведенное в Великобритании клиническое исследование показало снижение содержания альфа-токоферола в крови при хроническом алкоголизме, что свидетельствовало о несостоятельности эндогенной антиоксидантной системы [29]. С учетом полученных данных возможно применение антиоксидантов в лечении хронической алкогольной миопатии, в частности препаратов альфа-липоевой кислоты (альфа-ЛК).
Согласно современным представлениям, альфа-ЛК (тиоктовая кислота, витамин N) рассматривается как витаминоподобное вещество, биологическая роль которого определяется его участием в окислительном декарбоксилировании пировиноградной и других альфа-кетокислот. Наличие тиоловых (сульфгидрильных) групп в молекуле альфа-ЛК придает ей свойства антиоксиданта.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.