Опыт применения безинтерферонового режима терапии «паритапревир/ритонавир + омбитасвир + дасабувир» у пациентов с 1-м генотипом хронического гепатита C в городе Новосибирске
- Аннотация
- Статья
- Ссылки
- English
В последние годы в терапии больных хроническим гепатитом C (ХГС) произошли революционные изменения. Это обусловлено прежде всего появлением новых высокоэффективных и безопасных безинтерфероновых схем терапии, предусматривающих применение препаратов прямого противовирусного действия. Однако, учитывая высокую распространенность заболевания и отсутствие вакцинации против гепатита C, инфекция, вызванная вирусом гепатита C (Hepatitis C Virus – HCV), остается одной из актуальных проблем общественного здравоохранения [1–3].
Как известно, в мире количество инфицированных гепатитом С (около 180 млн человек) в десять раз превышает количество инфицированных ВИЧ [4]. Поскольку HCV-инфекция характеризуется длительным бессимптомным течением, можно предположить, что эти цифры не соответствуют истинным и количество инфицированных намного больше.
ХГC остается основной причиной развития цирроза печени и наиболее частой причиной трансплантации печени в терминальной стадии заболевания [5]. В 2012 г. в мире было проведено 24 000 ортотопических трансплантаций печени. В большинстве случаев декомпенсированный цирроз печени был обусловлен ХГС.
Две трети пациентов, инфицированных гепатитом C, являются жителями Восточной Европы и Центральной Азии. Об этом свидетельствуют результаты эпидемиологического исследования польских ученых, опубликованные в 2016 г. [6]. Согласно данным М. Rosinska и соавт., в 2014 г. в Польше зарегистрировано 3076 новых пациентов с HCV-инфекцией, то есть заболеваемость составила 7,99 случая на 100 000 населения. Таким образом, рост заболеваемости составил 14% по сравнению с 2008 г. и 34% по сравнению с 2012 г.
Аналогичные результаты получены молдавскими учеными в ходе эпидемиологического анализа заболеваемости гепатитом C в республике [7]. Учитывая географическую близость Польши, Молдовы и России, можно предположить наличие подобной ситуации и в Российской Федерации.
Более глубокое понимание патофизиологии ХГC в последние годы способствовало повышению эффективности терапии заболевания. Ежегодно Европейской ассоциацией по изучению печени (European Association for the Study of the Liver – EASL), Американским обществом по изучению болезней печени (American Association for the Study of Liver Diseases – AASLD), Азиатско-Тихоокеанской ассоциацией по изучению болезней печени (Asian Pacific Association for the Study of the Liver – APASL) в клинические рекомендации включаются новые схемы лечения ХГC, проверенные с позиций доказательной медицины [1, 8]. В рекомендациях EASL, принятых в сентябре 2016 г., предусмотрены только безинтерфероновые схемы с доказанной эффективностью и безопасностью. Рекомендации содержат и новые по сравнению с руководством EASL 2015 г. схемы, включающие софосбувир и велпатасвир (в одной таблетке) для всех генотипов и гразопревир и элбасвир – для 1-го и 4-го генотипов.
В настоящее время актуальной остается схема терапии пациентов с 1-м генотипом ХГС как без цирроза, так и с компенсированным циррозом печени, включающая паритапревир (ингибитор протеазы NS3–4A), бустированный ритонавиром, совместно с омбитасвиром (ингибитор NS5A) и дасабувиром (ингибитор ненуклеозидной HCV РНК-зависимой РНК-полимеразы) (фармацевтическая компания AbbVie). Эта схема, получившая название 3D-терапии, зарегистрирована под торговым названием Викейра Пак. Доказательная база 3D-терапии основана на результатах клинических исследований ΙΙΙ фазы SAPPHIRE-1, SAPPHIRE-2, PEARL-2, PEARL-3, PEARL-4, MALACHITE-1, MALACHITE-2, TURQUOISE-1 и TURQUOISE-2.
В 2016 г. были внесены изменения в рекомендации EASL по применению терапии препаратом Викейра Пак у пациентов с ХГC. Препарат Викейра Пак рекомендован для лечения больных гепатитом C 1-го генотипа без цирроза и с компенсированным циррозом печени на протяжении 12 недель. Однако при генотипе 1b и отсутствии цирроза печени так называемым «наивным» пациентам (не получавшим ранее противовирусной терапии) рекомендована восьминедельная терапия без рибавирина. При наличии стадии фиброза F3 по шкале METAVIR восьминедельная терапия применяется с осторожностью. Данные рекомендации основаны на результатах исследования GARNET, в котором стойкий вирусологический ответ (СВО12) зарегистрирован у 97% пациентов с генотипом 1b ХГC, c F0–1 по шкале METAVIR у 161 из 166 пациентов, принимавших участие в исследовании. Из 15 пациентов с F3 по шкале METAVIR двое не достигли СВО.
При генотипе 1a вирусного гепатита C нецирротической стадии рекомендована 12-недельная 3D-терапия совместно с рибавирином, дозированным исходя из веса пациента. У больных гепатитом C генотипа 1а с компенсированным циррозом печени терапия препаратом Викейра Пак должна продолжаться 24 недели совместно с рибавирином, дозируемым исходя из веса пациента [1].
В настоящее время появляются данные об использовании 3D-терапии в реальной клинической практике. Интерес представляет исследование испанских гепатологов, результаты которого были опубликованы в 2016 г. [9]. В ретроспективном многоцентровом национальном исследовании оценивали безопасность и эффективность терапии «омбитасвир/паритапревир/ритонавир + дасабувир» (OBV/PTV/r + DSV) у 291 пациента с ХГC генотипов 1 и 4, включенного в программу раннего доступа. Продемонстрированы высокая эффективность и хороший профиль безопасности данной схемы терапии. Благодаря многофакторному анализу удалось установить факторы, ассоциированные с уменьшенной вероятностью достижения устойчивого вирусологического ответа (УВО). К этим факторам относятся базовое повышение уровня билирубина, снижение уровня альбумина сыворотки крови и декомпенсированный цирроз печени.
Кроме того, опубликованы результаты применения комбинации OBV/PTV/r + DSV у особых групп пациентов с HCV в условиях реальной клинической практики, например у пациентов с хронической болезнью почек (ХБП) IV–V стадий [10]. В ретроспективном исследовании в девяти испанских центрах анализировали безопасность и эффективность терапии комбинацией OBV/PTV/r + DSV у 46 больных ХГС. У десяти из них имела место стадия IV ХБП, у 36 – стадия V. У 17 из этих пациентов наблюдалась цирротическая стадия заболевания. У всех пациентов во время всего 12-недельного курса терапии почечная функция оставалась стабильной. Анализ показал, что эффективность и безопасность противовирусной терапии у больных ХБП стадий IV и V аналогичны таковым у пациентов с нормальной функцией почек. У пациентов с ХБП противовирусная терапия комбинацией OBV/PTV/r + DSV не сопровождалась серьезными побочными эффектами.
В России схема 3D-терапии зарегистрирована в апреле 2015 г. для больных гепатитом C генотипа 1 без цирроза или с компенсированным циррозом печени.
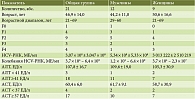
С сентября 2015 г. нами пролечен 21 пациент (12 мужчин, девять женщин) с хроническим гепатитом С 1-го генотипа и уже получен результат 24-недельного наблюдения после терапии. Средний возраст больных составил 46,9 ± 14,0 года (средний возраст мужчин 44,2 ± 11,8 года, женщин – 50,6 ± 16,6 года). У 20 пациентов верифицирован субтип 1b вируса, у одного – субтип 1а. 17 больных проходили противовирусную терапию впервые (так называемые «наивные» пациенты). У троих в анамнезе была неудачная терапия пегилированным интерфероном с рибавирином, у одного – вирусологический прорыв через 12 недель после окончания терапии пегилированным интерфероном и рибавирином. Десять пациентов имели нормальную массу тела (индекс массы тела (ИМТ) 18,5–24,99 кг/м2), семь – избыточную массу тела (ИМТ 25–30 кг/м2), двое – ожирение 1-й степени (ИМТ 30–35 кг/м2), один – ожирение 2-й степени (ИМТ 35–40 кг/м2), один – ожирение 3-й степени (ИМТ более 40 кг/м2).
Согласно данным фиброэластометрии, проведенной на аппарате SuperSonic Imagine Aixplorer, отсутствие фиброза по шкале METAVIR зафиксировано у одного пациента, F1 – у четырех, F2 – у девяти, F3 и F4 – у трех и четырех больных соответственно. У четырех пациентов с цирротической стадией заболевания (F4 по шкале METAVIR), согласно прогностическим критериям Чайлда – Пью, получено 5–6 баллов (класс А). То есть все пациенты были с компенсированным циррозом печени (табл. 1).
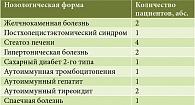
Исходно активность аланинаминотрансферазы (АЛТ) была повышена (≥ 41 ЕД/л) у 18 пациентов. У троих наблюдались нормальные значения АЛТ (< 41 ЕД/л). Активность аспартатаминотрансферазы (АСТ) была повышена (≥ 37 ЕД/л) у 17 пациентов. У четверых отмечались нормальные значения (< 37 ЕД/л). Уровни билирубина крови и ферментов холестаза (щелочной фосфатазы (ЩФ), гамма-глутамилтранспептидазы (ГГТП)) были в норме у всех пациентов. Уровень виремии определялся при помощи HCV-ПЦР (РеалБест, Новосибирск). Чувствительность определения 60 МЕ/мл. Виремия колебалась от 3,7 × 104 МЕ/мл до 6,4 × 109 МЕ/мл. У 15 (71,4%) пациентов с хроническим гепатитом выявлены сопутствующие заболевания (табл. 2). Желчнокаменная болезнь (ЖКБ) верифицирована у двоих, у одного в анамнезе холецистэктомия по поводу ЖКБ. У четырех больных с избыточной массой тела, по данным ультразвукового исследования, выявлен стеатоз печени. Один пациент по поводу сахарного диабета 2-го типа получал метформин. Аутоиммунные заболевания диагностированы у четырех больных, у одного из них – аутоиммунная тромбоцитопения, у двоих – аутоиммунный тиреоидит, у одного – аутоиммунный гепатит. Два пациента получали терапию по поводу гипертонической болезни: один принимал антагонист кальция нифедипин, другой – ингибитор ангиотензинпревращающего фермента эналаприл.
Все пациенты получали комбинацию OBV/PTV/r + DSV в течение 12 недель. Одному пациенту с генотипом 1а и четырем больным с F4 терапия препаратом Викейра Пак проводилась совместно с рибавирином, дозированным исходя из веса. Контроль виремии, уровней АЛТ, АСТ, билирубина, ЩФ, ГГТП, креатинина крови, общего анализа крови проводили через две, четыре, восемь и 12 недель от начала терапии. Кроме того, собиралась информация обо всех побочных эффектах терапии. Через две недели от начала терапии у шести (28,6%) пациентов сохранялась виремия со снижением вирусной нагрузки от двух до пяти логарифмов. У четверых по-прежнему наблюдался повышенный уровень АЛТ до двух норм. Однако уже через четыре недели от начала терапии у всех пациентов HCV-РНК не определялась и показатели АЛТ, АСТ вернулись к норме. Через восемь и 12 недель от начала терапии сохранялась авиремия при нормальных показателях АЛТ и АСТ – непосредственный вирусологический ответ. Через 12 и 24 недели от начала терапии HCV-РНК у всех участников исследования не определялась – УВО12 и УВО24. При этом ни у одного из пациентов не зафиксировано каких-либо отклонений в общем и биохимическом анализе крови.
Как показали данные клинических исследований комбинации OBV/PTV/r + DSV, наиболее распространенными побочными эффектами являлись зуд, усталость, тошнота, астения и бессонница. Серьезные нежелательные явления наблюдались менее чем в 2,5% случаев. Из-за неблагоприятных событий лечение было прекращено не более чем в 1–2% случаев. Согласно нашим данным, ни у одного пациента, получавшего терапию, серьезных побочных эффектов, которые привели бы к ее отмене, не зарегистрировано. Наиболее частыми нежелательными явлениями во время терапии были немотивированная слабость у четырех (19%) пациентов, нарушение сна у одного (4,8%) больного. Эти нежелательные явления наблюдались только в первые четыре недели терапии и не требовали коррекции. Нежелательные явления не зависели от возраста пациентов, вирусной нагрузки, степени фиброза. У пациентки 69 лет с цирротической стадией заболевания все 12 недель терапии сопровождались выраженным зудом, причину возникновения которого можно было объяснить только проводимой терапией. Пациентка отмечала волнообразное нарастание и уменьшение зуда в течение дня. Зуд кожных покровов полностью был купирован через две недели после окончания терапии препаратом Викейра Пак.
Особую группу составляют пациенты с аутоиммунными проявлениями HCV, клинически значимыми внепеченочными проявлениями ХГC (ассоциированной с HCV криоглобулинемией, неходжкинской лимфомой, иммунной нефропатией и т.д.) независимо от степени фиброза.
Больной гепатитом С, 30 лет, обратился за медицинской помощью в сентябре 2015 г. Пациента беспокоили немотивированная слабость, учащенное сердцебиение.
Из анамнеза: впервые гепатит C верифицирован 26 марта 2008 г. с неуточненным сроком и путем заражения. Известно, что в 2004 г. пациент был донором крови, anti-HCV в этот период не определялись. С 2004 по 2008 г. неоднократно посещал стоматолога. В 2008 г. был определен генотип 1b ХГС (вирусная нагрузка неизвестна), F1 (FibroScan, METAVIR 6,1 кПа). C 20 марта 2009 г. была начата противовирусная терапия препаратами ПегИнтрон и Ребетол. Лечение сопровождалось побочными эффектами – гриппоподобным синдромом, лейкопенией, нейтропенией, анемией. Эти побочные эффекты потребовали коррекции, снижения дозы ПегИнтрона и Ребетола через четыре недели от начала терапии. Быстрый вирусологический ответ (БВО4) достигнут не был, HCV-РНК через четыре недели от начала терапии 39 200 МЕ/мл, АЛТ и АСТ – в норме. Пациенту была продолжена терапия до 48 недель, однако непосредственного вирусологического ответа не получено – HCV-РНК 3 300 000 МЕ/мл. Через шесть месяцев стал чувствовать выраженную слабость. Пациент обследовался у эндокринолога, был верифицирован аутоиммунный тиреоидит с умеренным гипертиреозом – терапия не была назначена. В 2014 г. пациент проходил скрининг для участия в клиническом исследовании PIONEER (эффективность и безопасность препарата нарлапревир, применяемого в сочетании с ритонавиром, при ХГС генотипа 1). Однако скрининг не прошел из-за выявленного повышения аутоантител (ANA).
В сентябре 2015 г. состояние пациента удовлетворительное, вес 90,1 кг, рост 180 см (ИМТ 27,8 кг/м2). В легких дыхание везикулярное, хрипов нет, частота дыхательных движений 18 в минуту. Тоны ритмичные, шумов нет. Артериальное давление 120/70 мм рт. ст., пульс 86 уд/мин. Живот мягкий, безболезненный при пальпации. Печень и селезенка не увеличены, не пальпируются. Периферических отеков нет. По всем другим органам и системам патологии не выявлено.
Общий анализ крови и мочи без особенностей (лейкоциты 7,01 тыс/мкл, эритроциты 5,79 млн/мкл, гемоглобин 17,7 г/дл). Биохимический анализ крови: АЛТ 196 ЕД/л (4,8 нормы), АСТ 96 ЕД/л (2,6 нормы). Другие биохимические показатели (билирубин, ГГТП, ЩФ, альфа-амилаза, креатинин, альбумин, холестерин, триглицериды и проч.) не изменены. Гормоны щитовидной железы (Т3 и ТТГ) в норме, уровень Т4 повышен (154,1 нмоль/л). Спектр аутоантител – AMA-M2, LKM-1, LC-1, SLA/LP – результат отрицательный. Антинуклеарные антитела (ANA) – 1:640. HCV-РНК – 5 248 665 МЕ/мл,
1b генотип. HBsAg – не найден, BИЧ ½ (антиген + антитело) – отрицательный. Фиброэластометрия печени 6,8 кПа, что соответствует F1 по шкале METAVIR.
Таким образом, у больного ХГC генотипа 1b определены HCV-РНК 5 248 665 МЕ/мл, F1 (FibroScan, METAVIR 6,8 кПа), внепеченочные проявления в виде аутоиммунного тиреоидита и повышение антинуклеарных антител. При принятии решения о проведении противовирусной терапии учитывалось несколько факторов. В рекомендациях EASL 2016 г. говорится прежде всего о том, что все пациенты с гепатитом C, как «наивные», так и с неудачей предыдущей терапии, должны проходить противовирусную терапию. Незамедлительно принимается решение о проведении терапии при наличии у пациента продвинутой стадии фиброза, начиная с F2. Кроме того, в рекомендациях EASL 2016 г. подчеркивается, что терапия независимо от степени фиброза должна проводиться у пациентов с внепеченочными проявлениями, например васкулитом, ассоциированным с HCV-инфекцией, смешанной криоглобулинемией, неходжкинской В-клеточной лимфомой. Некоторые исследователи подчеркивают взаимосвязь между аутоиммунными заболеваниями щитовидной железы и ХГC [11, 12]. По мнению авторов, около 50% пациентов с HCV-инфекцией имеют симптомы по крайней мере одного из аутоиммунных заболеваний, которые могут быть первым и единственным клиническим признаком гепатита С. Эффективная противовирусная терапия является фактором, способствующим улучшению течения сопутствующего аутоиммунного заболевания, в том числе заболеваний щитовидной железы.
Таким образом, несмотря на наличие у пациента только минимального фиброза (F1, FibroScan, METAVIR 6,8 кПа), ему показана противовирусная терапия ввиду аутоиммунного тиреоидита и повышения антинуклеарных антител (ANA) в крови.
Пациенту назначена 12-недельная терапия OBV/PTV/r + DSV. Через четыре недели от начала терапии HCV-РНК уже не определялась. Уровни АЛТ, АСТ и других биохимических показателей крови в норме. Через восемь недель и по окончании терапии (УВО12) сохранялись авиремия и нормальные значения АЛТ и АСТ. У пациента определялись УВО12 и УВО24. Никаких побочных эффектов во время терапии не зарегистрировано. Через 12 недель от начала терапии и через 12 и 24 недели после окончания терапии у больного не обнаруживались аутоантитела – AMA-M2, LKM-1, LC-1, SLA/LP, ANA. Гормоны щитовидной железы ТТГ, Т3 и Т4 – в норме. Таким образом, у пациента после элиминации вируса гепатита C признаки аутоиммунного заболевания купировались (отсутствие ANA, нормализация уровня гормона щитовидной железы Т4 в крови).
Интересен случай достижения УВО24 у пациента с нарушением комплаентности при терапии препаратом Викейра Пак. Больной К. 32 лет обратился за медицинской помощью для решения вопроса о назначении терапии по поводу гепатита С генотипа 1b. Терапия препаратом Викейра Пак начата 28 сентября 2015 г. При сборе анамнеза установлено, что в раннем детстве пациент многократно оперирован по поводу аппендицита, осложненного гнойным перитонитом. Затем в зрелые годы был многократно оперирован по поводу тонкокишечной непроходимости, обусловленной спаечной болезнью. При осмотре состояние больного удовлетворительное, в легких дыхание везикулярное, тоны сердца ритмичные, живот мягкий, безболезненный, несколько послеоперационных рубцов. По другим органам и системам патологии не выявлено. Показатели гемодинамики стабильные. Вредные привычки (курение, употребление алкоголя) отрицает. Рост 179 см, вес 71 кг, ИМТ 22,2 кг/м2 (нормальная масса тела). Виремия 6,4 × 109 МЕ/мл, генотип 1b. По данным фиброэластометрии, F1 по шкале METAVIR. АЛТ 240 ЕД/л (5,8 нормы), АСТ 104 ЕД/л (2,8 нормы). Другие биохимические показатели не изменены. 28 сентября 2015 г. пациент начал терапию OBV/PTV/r + DSV. Через четыре и восемь недель от начала терапии HCV-РНК не определялась, уровни АЛТ и АСТ нормализовались, никаких побочных эффектов во время терапии не отмечалось. Однако спустя девять недель от начала терапии пациент был госпитализирован в хирургическое отделение с явлениями тонкокишечной непроходимости, которая, безусловно, не была связана с приемом препарата Викейра Пак. В течение пяти дней, пока решался вопрос о проведении хирургического лечения, пациент не принимал препарат. Только после разрешения кишечной непроходимости больной вновь продолжил терапию до 12 недель. Несмотря на пропуски приема препарата, был достигнут непосредственный вирусологический ответ. Через 12 и 24 недели после окончания терапии HCV-РНК не определялась (УВО12 и УВО24). Таким образом, несмотря на перерыв в терапии, были достигнуты УВО12 и УВО24 у больного гепатитом C генотипа 1b, с F1 (FibroScan, METAVIR).
Следует отметить, что в рекомендациях EASL 2016 г. пациентам с генотипом 1b гепатита C без цирроза печени при отсутствии в анамнезе противовирусной терапии рекомендована восьминедельная 3D-терапия без рибавирина. Приведенный пример косвенно подтверждает эффективность сокращенного курса. Между тем в рекомендациях EASL 2015 г. для данной группы больных предусматривалась 12-недельная терапия. Поэтому в аннотациях к препарату Викейра Пак для России фигурирует та же продолжительность лечения.
Таким образом, наш опыт терапии пациентов с ХГС генотипа 1 без цирроза или с компенсированным циррозом печени продемонстрировал высокую эффективность и безопасность комбинации OBV/PTV/r + DSV. Эффективность терапии не зависела от уровня фиброза и виремии, а также от наличия у пациентов сопутствующих заболеваний.
N.B. Voloshina
Novosibirsk State Medical University
Contact person: Natalya Borisovna Voloshina, navo@ngs.ru
Results of 3D-regimen of 12-week therapy consisting of ombitasvirum, paritaprevirum/ritonavirum and dasabuvirum in 21 patients with genotype 1 chronic hepatitis C were analyzed in the paper. High efficacy and safety of a combination drug were demonstrated regardless of degree of liver fibrosis and viremia as well as comorbidities.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.