Опыт применения обонятельных тренировок у пациентов с хроническим риносинуситом и нарушением обоняния
- Аннотация
- Статья
- Ссылки
- English
Цель. Оценить эффективность применения обонятельных тренировок (ОТ) у пациентов с ХПРС и нарушением обоняния после проведения функциональной эндоскопической операции на околоносовых пазухах путем оценки идентификационной функции обонятельного анализатора.
Материал и методы. Обследовано 66 пациентов с ХПРС, поступивших на хирургическое лечение в клиники Самарского ГМУ. У 84,8% пациентов выявлено нарушение обонятельной функции. В I группу вошли пациенты с ХПРС (n = 33), которым в послеоперационном периоде было назначено медикаментозное лечение, пациентам II группы (n = 23) в дополнение к стандартному лечению был рекомендован курс ОТ.
Результаты. У пациентов II группы наблюдалось улучшение обонятельной функции. В случае исходной аносмии в 35,7% удалось достигнуть нормосмии – оценка с использованием скринингового идентификационного теста Sniffin Sticks test-12 (SST-12) составила 10,8 ± 0,4 балла к завершению лечения (р < 0,001), в 57,1% показатель улучшился до уровня гипосмии, составив 7,8 ± 0,9 балла (р < 0,001). При исходной гипосмии в 100% случаев удалось достигнуть нормосмического состояния, оценка SST-12 составила 11,2 ± 0,4 балла (р < 0,001). Улучшение суммарного балла опросника Sino-Nasal Outcome Test к третьему месяцу оказалось более выраженным у пациентов II группы (р < 0,001).
Заключение. Для улучшения результатов лечения пациентов с ХПРС целесообразно назначение ОТ после проведения хирургического вмешательства.
Цель. Оценить эффективность применения обонятельных тренировок (ОТ) у пациентов с ХПРС и нарушением обоняния после проведения функциональной эндоскопической операции на околоносовых пазухах путем оценки идентификационной функции обонятельного анализатора.
Материал и методы. Обследовано 66 пациентов с ХПРС, поступивших на хирургическое лечение в клиники Самарского ГМУ. У 84,8% пациентов выявлено нарушение обонятельной функции. В I группу вошли пациенты с ХПРС (n = 33), которым в послеоперационном периоде было назначено медикаментозное лечение, пациентам II группы (n = 23) в дополнение к стандартному лечению был рекомендован курс ОТ.
Результаты. У пациентов II группы наблюдалось улучшение обонятельной функции. В случае исходной аносмии в 35,7% удалось достигнуть нормосмии – оценка с использованием скринингового идентификационного теста Sniffin Sticks test-12 (SST-12) составила 10,8 ± 0,4 балла к завершению лечения (р < 0,001), в 57,1% показатель улучшился до уровня гипосмии, составив 7,8 ± 0,9 балла (р < 0,001). При исходной гипосмии в 100% случаев удалось достигнуть нормосмического состояния, оценка SST-12 составила 11,2 ± 0,4 балла (р < 0,001). Улучшение суммарного балла опросника Sino-Nasal Outcome Test к третьему месяцу оказалось более выраженным у пациентов II группы (р < 0,001).
Заключение. Для улучшения результатов лечения пациентов с ХПРС целесообразно назначение ОТ после проведения хирургического вмешательства.

Введение
Одним из актуальных вопросов современной клинической практики является повышение качества жизни пациентов с хроническим полипозным риносинуситом (ХПРС). В большинстве публикаций, клинических рекомендациях и европейском согласительном документе по риносинуситу и назальным полипам (The European Position Paper on Rhinosinusitis and Nasal Polyps 2020, EPOS 2020) для оценки качества жизни и эффективности используемых методов лечения предлагается использование опросника Sino-Nasal Outcome Test (SNOT-22) [1–5]. Оценка ответов пациента ориентирована на учет динамики основных назальных и неназальных симптомов заболевания с дополнительным акцентом на состояние обонятельной функции [6, 7].
Потеря обоняния является одним из самых неприятных и трудно поддающихся лечению симптомов у пациентов с тяжелым течением ХПРС. Механизм развития обонятельной дисфункции (ОД) при ХПРС продолжают изучать, в качестве основных моментов выделяют назальную обструкцию обонятельной щели отечной слизистой оболочкой и/или полипы, а также нейросенсорное повреждение, возникающее в результате хронического воспалительного повреждения обонятельного нейроэпителия [8, 9]. При этом выраженность ОД часто коррелирует с тяжестью заболевания, наличием у пациентов в анамнезе коморбидной патологии и указаний на перенесенный острый риносинусит, инициированный вирусом SARS-CoV-2. По данным комплексной оценки обоняния с использованием расширенного теста (Sniffin Sticks test, SST) в проведенных исследованиях показано, что пороги обоняния при ХПРС нередко остаются неизмененными, а наиболее значительные расстройства обоняния при ХПРС связаны с нарушением идентификации и дискриминации запахов [9].
Традиционные схемы лечения ХПРС ориентированы на применение интраназальных глюкокортикостероидов и/или пероральных кортикостероидов, промывания носа, прием антибиотиков, при тяжелом течении ХПРС рекомендуется хирургическое вмешательство [10]. После функциональной эндоскопической ринохирургии (Functional Endoscopic Sinus Surgery, FESS) отмечается повышение качества жизни и улучшение основных симптомов ХПРС более чем в 50% случаев, в то время как улучшение обонятельной функции, по данным опроса, происходит всего в 37% случаев [11–16].
Таким образом, вопрос поиска дополнительных методов коррекции обонятельных нарушений у пациентов с ХПРС, в том числе после хирургического вмешательства, остается актуальным [17].
В качестве дополнительных нефармакологических методов коррекции ОД у пациентов с патологией носа и околоносовых пазух используют обонятельные тренировки (ОТ). По данным международных исследований, отмечена эффективность применения ОТ у пациентов с постинфекционной и посттравматической ОД. Также ОТ рассматривают как эффективный метод коррекции поствирусной ОД, индуцированной вирусом SARS-CoV-2 [18–20]. Однако в современной литературе недостаточно данных относительно оценки эффективности ОТ у пациентов с ХПРС после хирургического вмешательства. Лишь в немногочисленных исследованиях ОТ рассматривают в контексте послеоперационного ведения пациентов [1, 21, 22]. Так, J.Y. Park и соавт. использовали ОТ у пациентов с ХПРС после хирургического вмешательства в дополнение к стандартному лечению. Курс включал применение пяти различных одорантов (роза, лимон, корица, апельсин и персик) в течение 10 секунд дважды в день на протяжении 12 недель [23]. Авторы описали улучшение обоняния через три месяца после операции у тех пациентов, с которыми проводили ОТ. Стратегия использования комбинации хирургических методов лечения и ОТ требует дополнительных исследований по оценке коррекции ОД, связанной с ХПРС [5, 23–25].
Цель нашего исследования состояла в анализе эффективности применения ОТ у пациентов с ХПРС и нарушением обоняния после FESS путем оценки идентификационной функции обонятельного анализатора.
Материал и методы
Обследованы 66 пациентов (средний возраст 46,8 ± 14,4 года) с ХПРС, из них 29 женщин (средний возраст 46,4 ± 13,2 года) и 37 мужчин (средний возраст 47,1 ± 10,3 года), поступивших на плановое хирургическое лечение (FESS) в клиники Самарского ГМУ. Дизайн исследования на первом этапе предусматривал оценку обоняния с использованием скринингового идентификационного теста SST-12, в котором нормосмии соответствовало суммарное значение от 10 до 12 баллов, гипосмии – от 7 до 9 баллов и аносмии – от 0 до 6 баллов.
Критерии включения на первом этапе: возраст пациентов старше 18 лет, подтвержденный диагноз ХПРС, подписанное добровольное информированное согласие, свободное владение русским языком, стабильное соматическое и психологическое состояние.
Критерий невключения на первом этапе: когнитивное или физическое состояние, ограничивающее возможность обследования. Среди всех 66 (100%) пациентов с ХПРС, поступивших на плановое хирургическое лечение, у 56 (84,8%) пациентов выявлено нарушение обонятельной функции (суммарный балл ≤ 9) по данным SST-12.
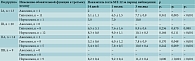
На втором этапе исследования 56 пациентов с ХПРС и нарушением обоняния были разделены на две группы: в I группу вошли пациенты с ХПРС (n = 33, средний возраст 43,7 ± 14,5 года, из них 17 женщин и 16 мужчин), которым в послеоперационном периоде было назначено медикаментозное лечение согласно клиническим рекомендациям. Во II группу исследования были включены пациенты с ХПРС (n = 23, средний возраст 49,0 ± 15,4 года, из них 9 женщин и 14 мужчин), которым в дополнение к стандартному лечению был рекомендован курс ОТ. Для оценки эффективности ОТ в зависимости от степени нарушения обоняния по данным SST-12 (суммарный балл от 7 до 9 баллов – гипосмия, от 0 до 6 баллов – аносмия) пациенты каждой группы были разделены на подгруппы: подгруппу IA составили 13 (23,2%) человек с аносмией, подгруппу IВ – 20 (35,7%) человек с гипосмией, подгруппу IIA – 14 (25,0%) человек с аносмией и подгруппу IIВ – 9 (16,1%) человек с гипосмией. Состав и характеристика подгрупп исследования представлена в табл. 1.
Во второй этап исследования вошли пациенты старше 18 лет с ХПРС, которым из-за отсутствия эффекта от медикаментозного лечения требовалась плановая операция на полости носа и околоносовых пазухах и у которых, по данным компьютерной томографии носа и околоносовых пазух, разница по шкале Лунда – Маккея составляла не менее 2 баллов между правой и левой сторонами и, по данным эндоскопического осмотра, выявлены средние или выраженные проявления ОД. Критерии невключения на втором этапе: наличие аллергической сенсибилизации, острой и хронической патологии нижних дыхательных путей и отсутствие нарушения обоняния по данным SST-12. Пациенты были исключены из исследования на втором этапе, если они не могли или не желали соблюдать требуемые послеоперационные рекомендации.
Для ОТ использовали аппаратно-программный комплекс ReviSmell с технологией виртуальной реальности и функцией биологической обратной связи. В аппаратной части тренажера располагались четыре емкости с эфирным маслом. Подачу эфирного масла проводили через специальную маску-респиратор. Одоранты – фенилэтиловый спирт (запах розы), эвкалиптол (запах эвкалипта), цитронелла (запах лимона) и эвгенол (запах гвоздики) – были выбраны с учетом международных рекомендаций согласно призме запахов Хеннинга. Пациент при помощи технологии виртуальной реальности мог «видеть» визуальный объект. Начиная со второго дня после проведения хирургического вмешательства пациентам проводили ОТ утром перед приемом пищи два раза в неделю, длительность сеанса составляла 30 минут, курса – три месяца. Контрольную оценку состояния обонятельной функции осуществляли с помощью опросника SNOT-22 и теста SST-12 на 14-й день, через один и через три месяца после хирургического вмешательства.
Исследование было проведено в соответствии с этическими нормами Хельсинкской декларации Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. Для статистического расчета использовали программу SPSS 25.0 (IBM Corporation, Армонк, Нью-Йорк, США, лицензия № 5725-А54). Характер распределения значений количественных показателей проверяли с помощью критерия Шапиро – Уилка. Ввиду нормального распределения данных методы описательной статистики включали среднее значение (M) и стандартное отклонение (SD), для качественных параметров – частоту (абс.) и долю (%). Для сравнения количественных показателей использовали t-критерий Стьюдента, критический уровень статистической значимости (p) принимали равным 0,05.
Результаты
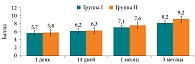
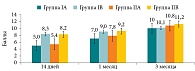
Показатели идентификационного теста SST-12 в послеоперационном периоде в I группе (только медикаментозное лечение) и во II группе (медикаментозное лечение + ОТ) на разных этапах исследования представлены на рис. 1.
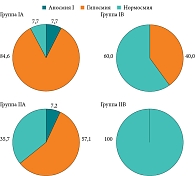
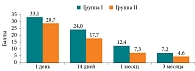
Среди пациентов с ХПРС и аносмией, не прошедших курс ОТ после хирургического вмешательства (подгруппа IA), к третьему месяцу исследования один (7,7%) человек восстановил обонятельную функцию до показателей нормосмии по данным SST-12, у 11 (84,6%) человек диагностировали гипосмию, показатели одного (7,7%) человека на третий месяц исследования остались на уровне аносмии (рис. 2). В подгруппе IВ (пациенты с ХПРС и гипосмией, не прошедшие курс ОТ) к третьему месяцу у 12 (60%) пациентов показатели соответствовали нормосмии, у 8 (40%) показатели не изменились и соответствовали гипосмии. В подгруппе IIA (пациенты с ХПРС и аносмией, прошедшие курс ОТ) к третьему месяцу гипосмия наблюдалась у 8 (57,1%) человек, нормосмия – у 5 (35,7%) человек, у одного (7,2%) пациента показатели обонятельной функции не изменились. В подгруппе IIВ (пациенты с ХПРС и гипосмией, прошедшие курс ОТ) в 9 (100%) случаях удалось достичь показателей нормосмии.
Показатели идентификационного теста SST-12 в подгруппах в зависимости от степени нарушения обоняния в динамике представлены на рис. 3.
Показатели идентификационного теста SST-12 в подгруппах с учетом изменения обонятельной функции к третьему месяцу отражены в табл. 2. В подгруппах IA и IВ восстановление обонятельной функции к 14-му дню исследования проходило практически одинаково, разница показателей стала заметной к концу первого месяца наблюдения и составила 1,4 и 1,1 балла соответственно.
По данным, полученным в ходе исследования, показано более значимое улучшение обонятельной функции у пациентов с ХПРС, проходивших ОТ, по сравнению с группой сравнения. Среди пациентов с исходной аносмией (подгруппа IA), которым в послеоперационном периоде назначали стандартное медикаментозное лечение, к завершению курса (третьему месяцу) в одном (7,7%) случае достигнуто нормосмическое состояние, при этом рост показателей SST-12 наблюдался во всех контрольных точках (14-й день, один и три месяца), составив 5,0; 7,0 и 10,0 балла соответственно. В 11 (84,6%) случаях достигнут уровень гипосмии, при этом статистически значимые изменения выявлены по истечении одного и трех месяцев с момента начала лечения: средние значения по данным SST-12 составили 6,5 ± 1,5 (р = 0,005) и 7,7 ± 0,8 балла (р < 0,001) соответственно. У пациентов с исходной гипосмией (подгруппа IB), которым в послеоперационном периоде проводили стандартное медикаментозное лечение, к третьему месяцу в 12 (60%) случаях показатели соответствовали нормосмии, при этом статистически значимый прирост наблюдался только к третьему месяцу (среднее значение по данным SST-12 – 10,1 ± 0,3 балла при р < 0,001). В 8 (40%) случаях исходные показатели идентификационной функции обоняния не изменились и соответствовали гипосмии. У пациентов с исходной аносмией, получавших в дополнение к стандартному медикаментозному лечению курс ОТ (подгруппа IIA), в 5 (35,7%) случаях удалось достичь нормосмии (среднее значение по данным SST-12 – 10,8 ± 0,4 балла при р < 0,001). В 8 (57,1%) случаях состояние улучшилось до уровня гипосмии, статистически значимые изменения выявлены по истечении одного и трех месяцев с момента начала лечения: средние значения по данным SST-12 составили 6,0 ± 1,2 балла (р = 0,048) и 7,8 ± 0,9 балла (р < 0,001) соответственно. При исходной гипосмии (подгруппа IIB) во всех 9 (100%) случаях удалось достичь нормосмического состояния при дополнении протокола лечения ОТ: значимая динамика наблюдалась к первому и третьему месяцам наблюдения (9,2 ± 0,4 и 11,2 ± 0,4 балла по данным SST-12 (р < 0,001)).
Таким образом, по данным SST-12 выявлено повышение показателей функции обоняния как через один месяц, так и через три месяца после хирургического вмешательства в подгруппах, получавших дополнительно курс ОТ.
У пациентов, которых в процессе лечения удалось перевести из аносмического в гипосмическое состояние, показатели SST-12 различались незначительно в разных контрольных точках. Сравнение показателей идентификационного теста SST-12 в данных группах представлено на рис. 4.
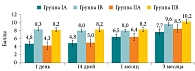
Выявлено, что суммарный балл опросника SNOT-22 уменьшился в обеих группах исследования, однако динамика оказалась более выраженной в группе II, где использовали ОТ (рис. 5).
Cуммарный балл SNOT-22 снизился статистически значимо (р < 0,001) во всех подгруппах уже к 14-му дню лечения (табл. 3). При контрольной оценке суммарного балла SNOT-22 через один и три месяца лечения выявлены различия: в подгруппах IIА и IIB показатели были ниже по сравнению с подгруппами IA и IB.
Суммарный балл по данным опросника SNOT-22 к третьему месяцу лечения также оказался меньше у пациентов, которым в дополнение к стандартному медикаментозному лечению назначили курс ОТ: в подгруппах с исходной аносмией и гипосмией он составил 4,9 ± 3,0 и 4,1 ± 2,7 балла соответственно.
Заключение
У пациентов с исходной аносмией при проведении ОТ в 35,7% случаев показатели идентификационной функции обоняния улучшались до уровня нормосмии, в 57,1% – до уровня гипосмии, статистически значимые изменения происходили после одного месяца ОТ. При исходной гипосмии в 100% случаев удалось достичь нормосмического состояния при дополнении протокола лечения пациентов с ХПРС использованием ОТ, динамические изменения происходили после одного месяца ОТ, наилучший результат наблюдался через три месяца лечения. Для улучшения результатов лечения пациентов с ХПРС целесообразно назначение ОТ после проведения хирургического вмешательства.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
T.Yu. Vladimirova, PhD, Ass. Prof., A.V. Kurenkov, M.K. Blashentsev
Samara State Medical University
Contact person: Tatyana Yu. Vladimirova, t.yu.vladimirovalor@samsmu.ru
After functional endoscopic rhinosurgery, only 37% of patients with chronic polypous rhinosinusitis experience an improvement in olfactory function, necessitating the search for additional methods to correct olfactory impairment.
Aim. To evaluate the effectiveness of olfactory training (OT) in patients with chronic polypous rhinosinusitis and olfactory impairment after Functional Endoscopic Sinus Surgery by assessing the identification function of the olfactory analyzer.
Material and methods. A total of 66 patients with chronic polypous rhinosinusitis admitted for surgical treatment at the Clinics of the Samara State Medical University were examined. Olfactory impairment was detected in 84.8% of patients. Group I included patients with chronic polypous rhinosinusitis (n = 33) who were prescribed medication in the postoperative period. Group II patients (n = 23) were recommended a course of OT in addition to standard treatment.
Results. Improved olfactory function was observed in patients in Group II. In 35.7% of cases of initial anosmia, normosmia was achieved; the Sniffin Sticks test-12 (SST-12) was 10.8 ± 0.4 points at the end of treatment (p < 0.001). In 57.1% of cases, the score improved to the level of hyposmia, reaching 7.8 ± 0.9 points (p < 0.001). In 100% of cases of initial hyposmia, normosmia was achieved; the SST-12 score was 11.2 ± 0.4 points (p < 0.001). The improvement in the total Sino-Nasal Outcome Test by month 3 was more pronounced in patients in Group II (p < 0.001).
Conclusion. To improve treatment outcomes in patients with chronic olfactory dysfunction, it is advisable to prescribe olfactory training after surgery.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.