Особенности профилактики инсульта у пациентов с хронической ишемией мозга
- Аннотация
- Статья
- Ссылки
- English

Около 10% глобального бремени болезней в мире приходится на неврологические заболевания, прежде всего инсульт и деменцию различного происхождения [1, 2]. Согласно официальной статистике Минздрава России [3], в 2017 г. в нашей стране зарегистрировано 427 895 острых нарушений мозгового кровообращения (ОНМК) по ишемическому и геморрагическому типу, что составляет около 365 случаев на 100 000 взрослого населения, и 58 759 транзиторных ишемических атак (50,1 на 100 000 взрослого населения). На долю ишемических инсультов (ИИ) пришлось 76%, геморрагических – 16%, неуточненных – 8%. Инсульт часто вызывает тяжелые последствия: лишь у 20% пациентов, выживших после ИИ, полностью восстанавливается трудоспособность [4, 5].
Не менее важной медико-социальной проблемой являются хронические цереброваскулярные заболевания. В России в 2017 г. выявлено 141 507 новых случаев, кодируемых под формулировкой «Другие цереброваскулярные болезни» (503 на 100 000 взрослого населения). При этом всего к 2018 г. такой диагноз имели 6 525 036 человек (5566 на 100 000 взрослого населения) [3]. Под другими цереброваскулярными заболеваниями в подавляющем большинстве случаев кодируется хроническая ишемия головного мозга (ХИГМ). К факторам риска ОНМК и ХИГМ относятся одни и те же состояния [6, 7]. При этом инсульт примерно вдвое увеличивает риск развития деменции, в том числе сосудистой природы, как исхода ХИГМ [1, 8, 9]. Поэтому при ведении пациентов с ХИГМ следует особое внимание уделять точному выполнению общепринятых рекомендаций по первичной или вторичной профилактике инсульта [1, 10].
Диагностика ХИГМ
В настоящее время диагноз ХИГМ является самым выставляемым в отечественной неврологической практике. У большинства пациентов пожилого возраста независимо от причины обращения при проведении магнитно-резонансной томографии (МРТ) головного мозга выявляются изменения, которые рассматриваются как дисциркуляторные или сосудистые. В такой ситуации чаще врач устанавливает диагноз ХИГМ, что, однако, не всегда оправданно в отсутствие соответствующих клинических признаков или факторов сосудистого риска [11–16].
В 2017 г. эксперты Американского общества инсульта и заболеваний сердца (American Heart Association – American Stroke Association, AHA–ASA) опубликовали согласованные рекомендации по ведению пациентов с хроническим безынсультным течением цереброваскулярного заболевания [17]. Основные варианты хронических цереброваскулярных заболеваний и их МР-характеристики представлены в табл. 1.
Для диагностики того или иного варианта ХИГМ наиболее чувствительным методом признана МРТ с напряженностью магнитного поля 1,5–3 Тл. Большинство немых инфарктов головного мозга (80–90%) имеют подкорковую локализацию [18]. Около 80–90% выявляемых сосудистых очагов – следствие патологии сосудов небольшого калибра [19], остальные – следствие поражения крупных артерий, кардиоэмболии и др. [20]. Показано, что выявление небольших немых инфарктов мозга, в том числе лакунарных, а также гиперинтенсивности белого вещества (ГБВ) ассоциируется с повышением риска развития симптоматического ИИ в два-три раза независимо от эффективности контроля факторов сосудистого риска, в том числе артериальной гипертензии (АГ) [17]. Наличие у пациента микрокровоизлияний ассоциируется с повышением риска как геморрагического, так и ишемического инсульта [17]. Между тем эксперты AHA–ASA не рекомендуют рутинно проводить МРТ для выявления бессимптомного цереброваскулярного заболевания, считая это неоправданным ни с экономической, ни с клинической точки зрения. Однако при обнаружении очаговых неврологических симптомов или снижения когнитивных функций проведение нейровизуализации целесообразно [17]. Если по какой-либо причине МРТ головного мозга проведена и выявлены описанные выше сосудистые изменения, необходимо обследование пациента с целью уточнения природы базисного сосудистого заболевания. В частности, может понадобиться суточное мониторирование артериального давления, ультразвуковое исследование (УЗИ) сердца, холтеровское мониторирование для исключения кардиоэмболического происхождения церебральных инфарктов, лабораторные анализы, УЗИ магистральных артерий головы, иногда – генетическое обследование на предмет редкой генетической патологии у пациентов молодого возраста. При обнаружении лобарных теменно-затылочных или корковых микрокровоизлияний должна возникнуть особая настороженность в отношении амилоидной ангиопатии, значительно повышающей риск геморрагического инсульта [21].
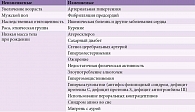
Факторы риска ХИГМ и ОНМК
По данным литературы, около 90% инсультов связаны с изменяемыми факторами риска [1, 10, 22]. Это косвенно подтверждается тенденцией роста заболеваемости инсультом и деменцией в странах с низким и средним уровнем доходов и уменьшения таковой в странах с высоким уровнем доходов. Следовательно, приводящие к инсульту факторы потенциально можно модифицировать [1]. С учетом того что инсульт является значимым самостоятельным фактором риска развития деменции, профилактика инсульта будет также профилактикой прогрессирования когнитивных нарушений [1, 10].
К факторам риска ОНМК и ХИГМ относятся одни и те же состояния [6, 7]. При сочетании нескольких факторов (прежде всего АГ и других факторов) общий сердечно-сосудистый риск значительно возрастает (табл. 2) [23, 24].
Клиническая картина
Диагноз ХИГМ в нашей стране не имеет общепринятых диагностических критериев, что делает группу пациентов с этим диагнозом крайне неоднородной. Бесспорным фактом является высокая распространенность случаев гипердиагностики ХИГМ, когда разнообразные неврологические жалобы у пациента пожилого, а иногда и молодого возраста позиционируются как проявления сосудистой патологии.
В публикациях ряда отечественных авторов представлены данные о том, что жалобы на головную боль, системное головокружение, шум в ушах, нередко списываемые на проявления ХИГМ, на самом деле чаще обусловлены иными заболеваниями. Например, основными причинами головной боли оказываются головные боли напряжения и мигрень, то есть первичные головные боли [25, 26]. Истинное вестибулярное головокружение и шум в ушах тоже практически никогда не бывают связаны с сосудистой патологией. Это проявления сопутствующего заболевания [27].
По данным литературы, к наиболее значимым клиническим проявлениям ХИГМ относятся когнитивные нарушения различной степени выраженности. Иногда одновременно наблюдаются трудности при ходьбе, неустойчивость, падения, эмоционально-поведенческие нарушения и др. [28–31].
Для ХИГМ характерен подкорковый подтип сосудистых когнитивных нарушений (СКН). При этом в клинической картине преобладают симптомы лобно-подкорковой дисфункции: снижение концентрации внимания и темпа познавательной деятельности, нарушение управляющих функций (планирование и контроль), отмечаются импульсивность, эмоциональная лабильность, снижение интеллектуальной гибкости, зрительно-пространственная дисгнозия и диспраксия [32–34]. Для диагностики СКН применяют различные нейропсихологические тесты. Оптимальным считается монреальский когнитивный тест (МоСа): его чувствительность превышает 80% уже на стадии легких когнитивных нарушений [35].
СКН за редчайшим исключением сопровождаются очаговыми неврологическими расстройствами в виде псевдобульбарного синдрома, гипокинезии, нарушений равновесия и ходьбы, тазовых расстройств. Если когнитивные расстройства, особенно достигающие степени деменции, развиваются в отсутствие очаговых неврологических синдромов, следует рассмотреть несосудистую природу деменции: болезнь Альцгеймера, деменцию с тельцами Леви, лобно-височную дегенерацию и др. При ХИГМ память обычно страдает умеренно, тогда как при болезни Альцгеймера нарушение памяти по гиппокампальному типу становится ядром клинической картины. Не стоит забывать и о возможном сочетании сосудистого и нейродегенеративного заболевания (смешанная деменция). Установление верного диагноза на додементной стадии может помочь с подбором наиболее эффективных специфических препаратов (глутаматергических, холинергических). Однако необходимо отметить, что вклад сосудистого компонента считается значимым в большинстве случаев когнитивных расстройств, в том числе при болезни Альцгеймера, что должно подвигнуть врача к оценке и корректировке факторов сосудистого риска у любого пациента с когнитивными нарушениями [1, 36].
Профилактика инсульта
С учетом общности факторов риска, а также того, что произошедший инсульт резко повышает вероятность развития деменции на фоне ХИГМ или нейродегенеративного заболевания, мероприятия по предотвращению инсульта занимают центральное место при ведении пациентов с ХИГМ. Профилактика инсульта включает комплекс мер, направленных на нивелирование факторов сосудистого риска, а также лечение базисного сосудистого заболевания [37]. Выделяют первичную и вторичную профилактику инсульта. Последняя проводится пациентам с ИИ в анамнезе.
Немедикаментозные методы профилактики направлены на модификацию образа жизни. Они применяются в рамках как первичной, так и вторичной профилактики ИИ. Целесообразно увеличить физическую активность, прежде всего за счет аэробных упражнений умеренной или высокой интенсивности от 40 минут три-четыре раза в неделю. Безопасными и наиболее полезными считаются пешие прогулки на свежем воздухе и лечебная гимнастика на воздухе или в домашних условиях. Рекомендовано воздержание от курения для некурящих и отказ от курения для курильщиков, а также отказ от приема алкоголя. При наличии АГ следует уменьшить употребление натрия (пищевая соль) и повысить содержание калия в пищевом рационе. При наличии избыточного веса рекомендуется его снижение. К рекомендуемым схемам питания относится так называемая средиземноморская диета [38].
Среди направлений медикаментозной коррекции факторов сосудистого риска одним из ведущих является антигипертензивная терапия, поскольку именно АГ признана наиболее значимым фактором риска симптомных и немых инфарктов, кровоизлияний и ГБВ [23, 37]. Целевой уровень артериального давления (АД) независимо от исходного в отсутствие гемодинамически значимого стеноза магистральных артерий головы (более 70%) составляет менее 140/90 мм рт. ст., а при хорошей переносимости –130/80 мм рт. ст. и менее. Больным АГ в качестве средств как вторичной, так и первичной профилактики назначают различные антигипертензивные средства с учетом сопутствующих заболеваний.
В последние годы наиболее распространенными и эффективными признаны ингибиторы ангиотензинпревращающего фермента (иАПФ) (периндоприл, эналаприл, лизиноприл) и блокаторы рецепторов к ангиотензину II (сартаны). Иногда необходимо использовать более одного препарата, например иАПФ и диуретик. Предпочтение следует отдавать препаратам с длительным периодом полувыведения. Принимать их надлежит строго по времени, чтобы избежать суточных колебаний АД, представляющих собой самостоятельный фактор риска сосудистой лейкоэнцефалопатии [39].
В ряде крупных рандомизированных исследований показано, что контроль АД не только снижает вероятность повторного ОНМК, но и замедляет темпы прогрессирования постинсультных СКН и снижает риск развития деменции [40]. По мнению экспертов AHA–ASA (2017 г.), коррекция АГ представляется наиболее эффективным методом для предотвращения формирования или прогрессирования ГБВ [17, 40].
При наличии признаков дислипидемии необходимо назначение гиполипидемических препаратов (статинов) длительно. Статины достоверно уменьшают риск ИИ и инфаркта миокарда у пациентов с ишемической болезнью сердца, сахарным диабетом или уже перенесенным ИИ даже в отсутствие высокого уровня холестерина в крови [15, 32, 37, 41, 42]. Согласно позиции AHA–ASА (2017 г.), выявление микрокровоизлияний в веществе мозга не должно рассматриваться в качестве ограничения для применения статинов [17].
Некоторыми исследователями в последнее время обсуждается вопрос профилактического назначения статинов для профилактики сосудистой деменции [32]. При наличии выраженного стеноза (≥ 70%) пациент в обязательном порядке должен получить консультацию ангиохирурга для решения вопроса о возможности проведения одного из вариантов хирургического лечения (каротидной эндартерэктомии или стентирования).
Больным, имеющим факторы риска кардиоэмболии (страдающим фибрилляцией предсердий или клапанными пороками), а также пациентам, перенесшим кардиоэмболический инсульт или транзиторную ишемическую атаку (ТИА), в качестве профилактики показан постоянный прием пероральных антикоагулянтов. На протяжении многих лет с этой целью применялся варфарин, однако при его использовании необходимо один раз в две недели контролировать уровень международного нормализованного отношения (МНО) и корректировать дозу препарата для минимизации риска геморрагических осложнений. Целевое значение МНО при терапии варфарином находится в диапазоне от 2 до 3 [32, 42].
У пациентов с неклапанной фибрилляцией предсердий хорошо зарекомендовали себя альтернативные варфарину препараты: дабигатран, ривароксабан и апиксабан [7]. Механизм действия новых препаратов не связан с влиянием на витамин-К-зависимые факторы свертывания и не требует контроля МНО. Дабигатран является прямым ингибитором тромбина, а ривароксабан и апиксабан – селективными прямыми ингибиторами фактора Ха. Эффективность и профиль безопасности новых препаратов аналогичны таковым варфарина. При назначении этих препаратов нет необходимости регулярно сдавать анализы и менять дозу, что, безусловно, повышает приверженность пациентов проводимой терапии [42].
Выявление микрокровоизлияний у пациентов с фибрилляцией предсердий не рассматривается как повод для отказа от антикоагулянтной терапии при наличии показаний к ней [7, 17]. Однако, если имеются данные о повышенном риске внутричерепного кровоизлияния, целесообразно использовать один из новых препаратов вместо варфарина [17]. Другой альтернативой варфарину может быть чрескожное закрытие ушка левого предсердия [17]. Антитромбоцитарные средства не являются более безопасной заменой антикоагулянтам при наличии факторов риска кардиоэмболического инсульта.
Пациентам с некардиоэмболическим ИИ или ТИА в анамнезе для вторичной профилактики инсульта показаны антитромбоцитарные средства [7, 17, 24, 38, 41, 42]. Речь прежде всего идет об ацетилсалициловой кислоте (АСК) в малых дозах (75–300 мг/сут), клопидогреле (75 мг/сут), комбинации АСК (25 мг) и дипиридамола замедленного высвобождения (200 мг). В нескольких крупных исследованиях отмечалась более высокая эффективность клопидогрела и комбинации АСК и дипиридамола по сравнению с монотерапией АСК [37, 43, 44]. Результаты исследования ESPS-2 показали, что добавление к терапии АСК дипиридамола замедленного высвобождения снижает риск повторного инфаркта мозга, существенно не влияя на число геморрагических осложнений [45, 46]. В исследовании ESPRIT продемонстрировано преимущество комбинации АСК и дипиридамола замедленного высвобождения перед аспирином по комбинированному критерию соотношения повторных сердечно-сосудистых событий (ОНМК, острый инфаркт миокарда, смерть от сердечно-сосудистых причин) и серьезных кровотечений [46, 47]. В исследовании PRoFESS сравнивали эффективность клопидогрела и АСК в сочетании с дипиридамолом замедленного высвобождения: 20 332 пациента наблюдались в течение двух с половиной лет. В результате различий по количеству повторных сердечно-сосудистых событий не выявлено (8,8 и 9% соответственно) [43].
Выявление немых лакунарных инфарктов на МРТ само по себе не является показанием для назначения антитромботических препаратов [17]. Однако при обнаружении подобных изменений необходимо повторно тщательно проанализировать анамнестические данные, чтобы попытаться выявить перенесенные ТИА или ИИ с минимальными или атипичными неврологическими проявлениями. Если данные о перенесенном симптомном остром эпизоде получены, назначают антиагреганты в рамках вторичной профилактики. В противном случае ведение пациента основывается на принципах первичной профилактики [17].
Кроме модификации образа жизни и терапии базисного сосудистого заболевания у пациентов с ХИГМ целесообразно проведение патогенетической терапии.
В настоящее время большой интерес вызывает антиагрегантный препарат дипиридамол (Курантил N) в аспекте его недавно описанных плейотропных эффектов [46]. В России Курантил N признан референтным лекарственным препаратом, используемым для оценки биоэквивалентности или терапевтической эквивалентности, качества, эффективности и безопасности воспроизведенного или биоаналогового лекарственного препарата [48, 49]. Антитромботическое действие дипиридамола опосредовано подавлением фосфодиэстераз тромбоцитов. Повышение концентрации цАМФ и циклического гуанозинмонофосфата приводит к снижению агрегации тромбоцитов и усиливает антиагрегантный эффект простациклина. Одновременно снижается обратный захват аденозина клетками, что также тормозит агрегацию тромбоцитов [46, 50, 51].
Как уже отмечалось, добавление к АСК дипиридамола повышает эффективность антитромботической терапии после перенесенного некардиоэмболического инсульта или ТИА [37, 44, 52, 53].
В национальных рекомендациях по кардиоваскулярной профилактике (2017 г.) такая комбинация считается предпочтительной у пациентов после некардиоэмболического инсульта или ТИА (уровень доказательности IА) [53]. Кроме того, за счет повышения концентрации аденозина, стимуляции аденилатциклазы и усиления NO-опосредованной вазодилатации дипирадамол оказывает сосудорасширяющий эффект и повышает деформируемость форменных элементов крови [54, 55]. Сочетание сосудорасширяющего и антитромботического эффектов способствует значительному улучшению церебральной перфузии [46, 50, 56].
Помимо антитромботического и вазодилатирующего описаны плейотропные противовоспалительные и антиоксидантные эффекты дипиридамола. Дипиридамол снижает экспрессию провоспалительных цитокинов – интерлейкина 2 и фактора некроза опухоли альфа [57–59]. Кроме того, дипиридамол способен подавлять повышенную экспрессию матричной металлопротеиназы (ММР-9) – фермента, ускоряющего распад матрикса и увеличивающего площадь ИИ [57, 58, 60].
В одном из исследований показано положительное влияние дипиридамола на степень повреждения эндотелиальных клеток мозга после метаболического или воспалительного повреждения [61]. Дипиридамол также улучшает окислительно-восстановительный баланс эндотелия за счет подавления эндотелиальных клеток, выделяющих активные формы кислорода [54, 62, 63]. Дипиридамол повышает образование NO, что способствует улучшению кровотока и увеличению биодоступности NO в тканях при сахарном диабете.
Некоторые авторы предлагают рассматривать коморбидность АГ и сахарного диабета в качестве показания для назначения антиагрегантов даже в отсутствие перенесенного симптомного инсульта или ТИА [64].
В работе М.М. Таняшян и соавт. продемонстрирована высокая терапевтическая эффективность при ХИГМ. Дипиридамол (Курантил) назначали в дозе 75 мг три раза в день 32 пациентам (средний возраст – 56,1 года) с диагнозом дисциркуляторной энцефалопатии различных стадий. После двух месяцев лечения наблюдались достоверное уменьшение жалоб на головную боль (с 73,3 до 40% пациентов) и регрессия психоневрологических расстройств [65, 66].
Дипиридамол способен усиливать действие статинов, в частности симвастатина, и антигипертензивных препаратов [46]. Предполагается, что именно дополнительные плейотропные эффекты (противовоспалительный, антиоксидантный и некоторые другие) обусловливают преимущества при его добавлении к АСК в рамках вторичной профилактики инсульта [58].
К числу дополнительных фармакологических эффектов дипиридамола относятся его противовирусные свойства. Они обсуждаются и изучаются достаточно давно – c 1970–80-х гг. К настоящему моменту описана способность дипиридамола усиливать продукцию интерферонов (интерферона гамма – в несколько раз) и подавлять экспрессию генов интерлейкинов [57].
Недавно опубликованы данные о применении дипиридамола в комплексной терапии HCoV-19. Выявлено подавление репликации HCoV-19 in vitro [67]. В небольшом исследовании участвовали 12 пациентов с подтвержденной коронавирусной инфекцией, у которых при добавлении к лечению дипиридамола отмечалось более выраженное увеличение количества тромбоцитов и снижение уровня D-димера по сравнению с контрольной группой [67]. Высказывается предположение, что антиагреганты, включая дипиридамол, замедляют прогрессирование идиопатического легочного фиброза [68].
Дипиридамол имеет широкий спектр показаний к применению: лечение и профилактика ишемического поражения мозга, профилактика плацентарной недостаточности при осложненной беременности, профилактика тромбоэмболии после протезирования клапанов сердца, профилактика артериальных и венозных тромбозов и их осложнений, комплексная терапия нарушений микроциркуляции любого генеза. Дипиридамол имеет многолетний опыт применения и продемонстрировал хорошую переносимость и безопасность [55]. Необходимо отметить возможность управлять эффектом дипиридамола за счет вариативности дозы, а также его высокую степень безопасности. Дипиридамол реже, чем другие антиагреганты, вызывает геморрагические осложнения и гастроэнтерологические нежелательные явления [64]. Доза препарата подбирается врачом индивидуально. Влиять на выраженность терапевтических эффектов позволяет коррекция дозы. С целью профилактики и лечения нарушений мозгового кровообращения обычно назначают препарат по 75 мг 3–6 раз в день. Максимальная суточная доза составляет 450 мг, в тяжелых случаях она может быть увеличена до 600 мг/сут. При ведении пациентов необходимо учитывать, что дипиридамол может взаимодействовать с антикоагулянтами, АСК, антигипертензивными средствами, усиливая их эффекты. Ранее в исследованиях при использовании высоких доз описывалось проишемическое действие дипиридамола на сердечную мышцу (синдром коронарного обкрадывания). Однако при пероральном приеме в дозе 225–450 мг такая реакция практически исключена [46, 69].
Заключение
Инсульт и ХИГМ достаточно распространены в современном мире и тесно взаимосвязаны. Они вызываются общими причинами, такими как АГ, атеросклероз, кардиальная патология. Инсульт усиливает когнитивные нарушения и другие клинические проявления ХИГМ, а факторы риска ХИГМ являются одновременно и факторами риска инсульта. Именно поэтому особое внимание при планировании терапии ХИГМ необходимо уделять профилактике инсульта. Считается, что до 90% инсультов можно предотвратить при четком следовании рекомендациям по медикаментозной и немедикаментозной профилактике острых нарушений мозгового кровообращения.
Ye.Yu. Kalimeyeva, PhD, V.V. Zakharov, PhD, Prof., T.G. Fateyeva
I.M. Sechenov First Moscow State Medical University
Contact person: Vladimir V. Zakharov, zakharovenator@gmail.com
Ischemic stroke and silent cerebrovascular disease (sCVD) shared causes. The paper presents current international guidelines of stroke prevention in sCVD patients. Patients with sCVD signs should be thoroughly evaluated to reveal the reason – basic vascular disorder. Case history should be carefully assessed to find out previous strokes or TIAs including those with mild or atypical presentation. In patients with previous vascular events principles of secondary stroke prevention should be applied, in patients without such events – principles of primary prevention. Microbleeds should not be routinely considered as contraindication to anticoagulant or anti-platelet treatment in cases requiring these kinds of therapy. The paper presents data on dipyridamole experience in stroke prevention and pathogenetic treatment of sCVD.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.