Оценка гематологической токсичности эрибулина при метастатическом раке молочной железы
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проанализированы данные 40 пациенток с метастатическим РМЖ, получавших лечение эрибулином. Проведен ретроспективный анализ основных клинических и молекулярно-биологических характеристик исследуемой группы, а также оценка гематологической токсичности на фоне лечения эрибулином.
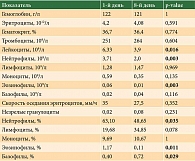
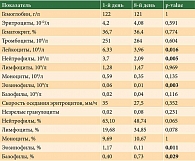
Результаты. Медиана терапии эрибулином составила четыре цикла (от одного до 12). Причинами завершения терапии послужили прогрессирование заболевания (82,5%) и гематологическая токсичность (15%) – два случая сочетания лейкопении и тромбоцитопении 3-й степени, четыре случая нейтропении 3-й степени. Медиана времени до прогрессирования заболевания составила 4,7 (1,9–11,2) месяца. Статистически значимые изменения наблюдались у всех пациенток в клиническом анализе крови на первом цикле лечения – снижение общего количества лейкоцитов к восьмому дню лечения (с 6,33 до 3,9 × 109/л; p = 0,016). Отмечалось уменьшение абсолютного и относительного количества нейтрофилов (с 63,10 до 48,65%; р = 0,035; с 3,71 до 2,0 × 109/л; p = 0,003), эозинофилов (с 1,17 до 0,11%; р = 0,011; с 0,06 до 0,01 × 109/л; р = 0,003) в лейкоцитарной формуле. При этом относительное количество базофилов статистически значимо увеличилось (с 0,40 до 0,72; р = 0,029). Схожие статистические изменения определялись на втором цикле на первый и восьмой дни введения препарата.
Заключение. Проведенное исследование показало наличие гематологической токсичности 1-й степени на первом и втором циклах лечения, однако она не носила прогрессирующего характера. Препарат эрибулин продемонстрировал приемлемый уровень гематологической токсичности у большинства пациенток.
Материал и методы. Проанализированы данные 40 пациенток с метастатическим РМЖ, получавших лечение эрибулином. Проведен ретроспективный анализ основных клинических и молекулярно-биологических характеристик исследуемой группы, а также оценка гематологической токсичности на фоне лечения эрибулином.
Результаты. Медиана терапии эрибулином составила четыре цикла (от одного до 12). Причинами завершения терапии послужили прогрессирование заболевания (82,5%) и гематологическая токсичность (15%) – два случая сочетания лейкопении и тромбоцитопении 3-й степени, четыре случая нейтропении 3-й степени. Медиана времени до прогрессирования заболевания составила 4,7 (1,9–11,2) месяца. Статистически значимые изменения наблюдались у всех пациенток в клиническом анализе крови на первом цикле лечения – снижение общего количества лейкоцитов к восьмому дню лечения (с 6,33 до 3,9 × 109/л; p = 0,016). Отмечалось уменьшение абсолютного и относительного количества нейтрофилов (с 63,10 до 48,65%; р = 0,035; с 3,71 до 2,0 × 109/л; p = 0,003), эозинофилов (с 1,17 до 0,11%; р = 0,011; с 0,06 до 0,01 × 109/л; р = 0,003) в лейкоцитарной формуле. При этом относительное количество базофилов статистически значимо увеличилось (с 0,40 до 0,72; р = 0,029). Схожие статистические изменения определялись на втором цикле на первый и восьмой дни введения препарата.
Заключение. Проведенное исследование показало наличие гематологической токсичности 1-й степени на первом и втором циклах лечения, однако она не носила прогрессирующего характера. Препарат эрибулин продемонстрировал приемлемый уровень гематологической токсичности у большинства пациенток.
Актуальность
Рак молочной железы (РМЖ) занимает второе место (11,6%) в структуре онкологической заболеваемости во всем мире, уступая только раку легкого [1]. В Российской Федерации в 2018 г. в общей (оба пола) структуре онкологической заболеваемости РМЖ также принадлежит второе место (11,4%) [2, 3].
Примерно у 20–30% пациенток с ранней стадией РМЖ заболевание прогрессирует с развитием метастатических форм [4]. В большинстве случаев прогрессирование заболевания происходит в течение 12–24 месяцев [5]. У 75% больных метастатическим РМЖ выявляются метастазы во внутренних органах [6]. Локализация и степень распространения метастазов служат важными прогностическими факторами у пациенток с метастатическим РМЖ [7].
Основным методом лечения метастатического РМЖ является системная лекарственная терапия. В настоящее время применяются различные схемы лечения больных метастатическим РМЖ в зависимости от поражения внутренних органов и молекулярно-биологического подтипа опухоли [7]. При проведении химиотерапии по поводу метастатического трипл-негативного либо люминального РМЖ с висцеральным кризом в первой и второй линиях терапии традиционно используют антрациклины и таксаны [8]. Однако длительность их применения ограничена развитием резистентности или выраженным токсическим действием на организм. Нейтропения считается самым частым нежелательным явлением на фоне химиотерапии [9]. Выбор третьей и последующих линий лечения у данной категории пациенток представляет достаточно сложную задачу. Одним из основных препаратов, используемых в случае резистентности к антрациклинам и таксанам, является эрибулин.
Эрибулин относится к ингибиторам динамики микротрубочек, принадлежащим к галихондриновой группе противоопухолевых средств. Механизм действия препарата основан на торможении фазы роста микротрубочек, что приводит к формированию тубулиновых агрегатов, не обладающих функциональной активностью [10]. Эрибулин также влияет на микроокружение опухоли и ее фенотип за счет ремоделирования сосудистого русла опухоли [11] и инверсии эпителиально-мезенхимального перехода [12].
В России эрибулин показан больным с местнораспространенным/метастатическим РМЖ, у которых отмечалось прогрессирование заболевания после применения одного или нескольких режимов химиотерапии по поводу распространенного заболевания.
Цель исследования – оценить гематологическую токсичность терапии эрибулином при метастатическом РМЖ.
Материал и методы
Объектом исследования стали 40 больных метастатическим РМЖ, получавших лечение эрибулином в 2018–2020 гг. в Красноярском краевом онкологическом диспансере им. А.И. Крыжановского. Пациенткам вводили эрибулин внутривенно в дозе 1,4 мг/м2 на первый и восьмой дни 21-дневного цикла. В большинстве случаев (85%) терапия проводилась в монорежиме, 4 (10%) пациентки получали комбинацию эрибулина и таргетной терапии при HER2-позитивном раке и 2 (5%) пациентки – аналог гонадотропин-рилизинг гормона при люминальном В HER2-негативном подтипе. Терапия прекращалась при прогрессировании заболевания и выраженных нежелательных явлениях.
Для оценки кроветворной функции и гематологической токсичности осуществляли забор крови для проведения клинического анализа с лейкоцитарной формулой на первый и восьмой дни введения препарата.
Статистическая обработка данных проводилась с помощью пакета прикладных программ Statistica 10,0 (StatSoft, США). Количественные параметры полученных результатов представлены в виде медианы (Ме) и интерквартильного интервала в виде 25-го и 75-го перцентилей (С25 и С75).
Средний возраст больных на момент проведения терапии эрибулином составлял 57,1 ± 10,97 года (от 34 до 72 лет). Общее состояние пациенток оценивалось по ECOG ≤ 2, одна пациентка – ECOG 3.
На момент постановки диагноза РМЖ у 22 (55%) пациенток уставлена II стадия опухолевого процесса, у 16 (40%) – III стадия, у 2 (5%) – IV стадия. Положительная экспрессия рецепторов эстрогена и прогестерона имела место у 12 (30%) и 14 (35%) больных соответственно. Высокий уровень пролиферативной активности (≥ 20%) выявлен у 36 (90%) больных. Лишь у 4 (10%) больных Ki-67 был менее 20%. Распределение по молекулярно-биологическим подтипам РМЖ было следующим: люминальный В (HER2-негативный) – 18 (45%) больных, люминальный В (HER2-позитивный) – 2 (5%), HER2-позитивный нелюминальный – 6 (15%), трипл-негативный – 14 (35%) больных.
У всех пациенток диагностировано распространенное метастатическое поражение – два очага и более. Висцеральные метастазы отмечались в легких (45%), печени (35%), органах малого таза (2,5%), головном мозге (2,5%). Поражение костей зафиксировано в 45% случаев, метастазы в лимфатических узлах – в 30%, локорегионарные метастазы – в 50% случаев.
Все больные получали предшествующую лекарственную терапию. Медиана количества линий химиотерапии – 3 (1–6): таксан-содержащая терапия (60%), антрациклин-содержащая терапия (100%), препараты платины (35%), лечение противоопухолевым препаратом группы антиметаболитов (капецитабин) (50%). Пациентки с положительными рецепторами эстрогена и/или прогестерона получали гормональную терапию, число линий – две-три. При HER2-позитивном раке лечение дополнялось таргетной терапией. При метастатическом поражении костей пациентки получали терапию остеомодифицирующими агентами.
Результаты
Медиана продолжительности терапии эрибулином составила четыре цикла (в диапазоне от одного до 12). Причинами завершения терапии служили прогрессирование заболевания (82,5%) и гематологическая токсичность (15%). В одном случае имел место летальный исход на первом цикле лечения – пациентка с метастатическим поражением органов грудной клетки и малого таза. Смерть наступила на фоне прогрессирования заболевания. Полная отмена препарата после первого курса потребовалась 6 (15%) больным и была связана с развитием гематологической токсичности – два случая сочетания лейкопении и тромбоцитопении 3-й степени, четыре случая нейтропении 3-й степени. Медиана времени до прогрессирования заболевания составила 4,7 (1,9–11,2) месяца.
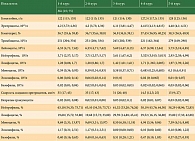
Статистически значимых изменений в клинических анализах крови пациенток между терапевтическими курсами не обнаружено. В таблице 1 представлены показатели клинического анализа крови у больных метастатическим РМЖ в ходе химиотерапии эрибулином.
Оценка показателей клинического анализа крови на первый и восьмой дни введения препарата на первом цикле лечения выявила статистически значимые изменения. Снижение общего количества лейкоцитов к восьмому дню лечения наблюдалось у всех пациенток и соответствовало 1-й степени токсичности. Следует отметить снижение абсолютного и относительного количества нейтрофилов, эозинофилов в лейкоцитарной формуле. При этом относительное количество базофилов статистически значимо увеличилось. В таблице 2 представлены показатели клинического анализа на первый и восьмой дни введения препарата на первом цикле химиотерапии.
Схожие статистически значимые изменения выявлены на втором цикле на первый и восьмой дни введения препарата. В таблице 3 представлены показатели клинического анализа на первый и восьмой дни введения препарата на втором цикле химиотерапии.
Обсуждение
Учитывая, что мишенью действия эрибулина являются микротрубочки, можно ожидать развития нежелательных явлений со стороны системы кроветворения в 4,2–53,3% случаев [13, 14]. К наиболее часто встречающимся побочным реакциям на фоне терапии эрибулином относят подавление функции костного мозга, выражающееся в нейтропении (53,6%), лейкопении (27,9%), анемии (21,8%), тромбоцитопении (4,2%) и лимфопении (5,7%) [14, 15].
Анализ результатов клинического анализа крови на первом курсе химиотерапии выявил отклонения общего количества лейкоцитов и нейтрофилов за счет их снижения до 1-й степени токсичности, что свидетельствует об угнетающем действии препарата на систему кроветворения. Выявленные изменения в показателях клинического анализа крови на втором цикле химиотерапии показали, что препарат продолжает оказывать угнетающее действие. Но выраженность изменений несколько меньше, чем на первом цикле. С третьего цикла различия в показателях на первый и восьмой дни не установлены. Это скорее всего говорит о том, что организм научился быстро восстанавливаться после приема препарата. Наблюдавшиеся нейтропения и лейкопения в лабораторных анализах на первом и втором циклах введения эрибулина были обратимыми и непрогрессирующими.
Полученные результаты подтверждаются данными литературы. Среднее время до ожидаемого минимума числа нейтрофилов составляет 13 дней, а среднее время до восстановления после тяжелой нейтропении (< 0,5 × 109/л) – восемь дней. В исследовании EMBRACE снижение числа нейтрофилов до значений < 0,5 × 109/л более семи дней отмечалось в 13% случаев [14].
Заключение
Проведенное исследование у больных метастатическим РМЖ, получавших терапию эрибулином на первом и втором циклах лечения, подтвердило наличие гематологической токсичности 1-й степени, но она не имела прогрессирующего характера. Эрибулин продемонстрировал приемлемый уровень гематологической токсичности у большинства пациенток.
Данная публикация подготовлена при финансовой поддержке компании Eisai.
Авторы несут полную ответственность за содержание публикации и редакционные решения.
A.V. Zyuzyukina, PhD, R.A. Zukov, PhD, Prof.
V.F. Voino-Yasenetsky Krasnoyarsk State Medical University
A.I. Kryzhanovsky Krasnoyarsk Regional Clinical Cancer Center
Contact person: Alena V. Zyuzyukina, alena-vz@mail.ru
The aim of the study was to evaluate the hematological toxicity of eribulin therapy in metastatic breast cancer.
Material and methods. The study included 40 patients with metastatic breast cancer treated with eribulin. There was made the retrospective analysis of the main clinical and molecular biological characteristics of the study group, as well as an assessment of hematological toxicity during treatment with eribulin.
Results. The median of eribulin therapy was four cycles (1 to 12). The reasons for the termination of therapy were the progression of the disease (82.5%) and hematological toxicity (15%) – two cases of the combination of leukopenia and thrombocytopenia of the 3rd degree, four cases of neutropenia of the 3rd degree. The median time to disease progression was 4.7 (1.9–11.2) months. Statistically significant changes were observed in all patients in the clinical blood test at the first treatment cycle – a decrease in the total number of white blood cells by the eighth day of treatment (from 6.33 to 3.9 × 109/l; p = 0.016). There was a decrease in the absolute and relative number of neutrophils (from 63.10 to 48.65%; p = 0.035; from 3.71 to 2.0 × 109/l; p = 0.003), eosinophils (from 1.17 to 0.11%; p = 0.011; from 0.06 to 0.01 × 109/l; p = 0.003) in the leukocyte formula. At the same time, the relative number of basophils increased significantly (from 0.40 to 0.72; p = 0.029). Similar statistical changes were determined on the second cycle on the first and eighth day of use of the drug.
Conclusion. The study showed the presence of hematological toxicity of the 1st degree in the first and second treatment cycles, but it was not progressive. The drug eribulin demonstrated the acceptable level of hematological toxicity in most patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.