Оценка различных режимов химиолучевой терапии локализованного мелкоклеточного рака легкого
- Аннотация
- Статья
- Ссылки
- English
Введение
Мелкоклеточный рак легкого (МРЛ) относится к низкодифференцированному нейроэндокринному раку. Основными иммуногистохимическими маркерами МРЛ являются панцитокератин, синаптофизин, хромогранин А, TTF1 и CD56. Основная причина развития – курение. 80% пациентов с МРЛ имеют метастатическое (стадия IV, или распространенная форма) заболевание, 20% – МРЛ стадий I–III (локализованная форма). Лишь 5% больных МРЛ при первичном обращении имеют стадию I (T12N0M0). У таких больных наилучший долгосрочный прогноз – пятилетняя выживаемость достигает 50% при условии адекватного оперативного вмешательства и проведения адъювантной химиотерапии «этопозид + цисплатин» (четыре курса) [1].
При МРЛ стадий II–III проводится химиолучевая терапия (ХЛТ). При этом наиболее эффективны режимы ХЛТ с использованием препаратов платины. Последовательность применения химиотерапии и лучевой терапии с высокой степенью достоверности еще не установлена. Результаты ряда исследований свидетельствуют о лучшей общей выживаемости у больных, получавших раннюю ХЛТ, то есть когда лучевая терапия начинается в течение 30 дней от начала химиотерапии – с первым или вторым курсом химиотерапии [2–6]. Обоснованием подобной тактики лечения является тот факт, что через 30 дней после начала химиотерапии начинается ускоренное формирование резистентных к химиотерапии клонов опухоли, что может повлиять на чувствительность к лучевой терапии [7–9]. В то же время в ряде исследований не подтверждена эффективность тактики ранней ХЛТ [10, 11]. Подробный метаанализ проведенных исследований в отношении сроков начала лучевой терапии при локализованном МРЛ также не выявил статистически достоверного преимущества ранней ХЛТ [12].
Медиана выживаемости у пациентов с локализованным МРЛ после одновременной ХЛТ составляет около 20 месяцев, пятилетняя выживаемость – около 20%.
Материал и методы исследования
Проведена ретроспективная оценка 30 больных локализованным МРЛ, получивших ХЛТ. 22 больных получили одновременную ХЛТ, восемь – последовательную (лучевая терапия после завершения химиотерапии). В группе одновременной ХЛТ пяти больным назначалась ранняя ХЛТ. Оставшиеся пациенты получили ХЛТ одновременно с третьим и четвертым (десять больных), пятым и шестым курсами химиотерапии (семь больных). 11 (37%) пациентам проведена химиотерапия этопозидом и цисплатином, 13 (43%) – иринотеканом и цисплатином, троим (10%) – иринотеканом и карбоплатином, двоим (7%) – этопозидом и карбоплатином, одному (3%) – паклитакселом и карбоплатином. Из 30 больных четверо (13%) получили лучевую терапию с разовой очаговой дозой (РОД) 2 Гр, 18 (60%) – с РОД 2,5 Гр, семь (23%) – 3 Гр и один (3%) пациент – в режиме гиперфракционирования 1,5 Гр два раза в день. 18 больным проведена лучевая терапия с суммарной очаговой дозой (СОД) ≥ 40 Гр, 12 пациентам – с СОД менее 40 Гр.
Результаты
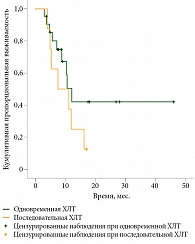
Медиана выживаемости до прогрессирования (ВДП) в группе одновременной ХЛТ составила 12,1 месяца (95%-ный доверительный интервал (ДИ) 9,4–15), последовательной ХЛТ – 7,5 месяца (95% ДИ 0–15,6). Однако различие оказалось статистически недостоверным (р = 0,2) скорее всего из-за недостаточного количества больных в группе последовательной ХЛТ (рис. 1).
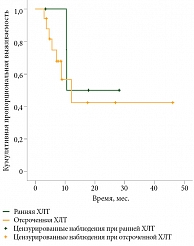
При оценке ВДП в группе одновременной ХЛТ в зависимости от сроков начала ХЛТ – ранняя и отсроченная – также достоверных различий не выявлено (р = 0,5). ВДП в группе ранней ХЛТ достигла 10,5 месяца, в группе отсроченной – 12,5 месяца (95% ДИ 4,5–19,7) (рис. 2).
ВДП также проанализирована в зависимости от схем химиотерапии. Так, медиана ВДП у больных, получавших комбинацию этопозида с препаратами платины (цисплатин/карбоплатин) и иринотекана с препаратами платины (цисплатин/карбоплатин), составила 11,9 (95% ДИ 4,5–19,4) и 10,5 месяца (95% ДИ 9,4–11,6) соответственно. Статистически достоверных различий не выявлено (р = 0,8). Медиана ВДП у больных, получавших комбинацию цисплатина с этопозидом или иринотеканом и карбоплатина с этопозидом, иринотеканом или паклитакселом, оказалась одинаковой – 11,1 месяца.
Медиана ВДП в группе больных, получивших лучевую терапию с СОД ≥ 40 Гр, была больше, чем в группе с СОД < 40 Гр, – 11,9 (95% ДИ 7,6–16,3) и 10,5 месяца (95% ДИ 5,9–15,1) соответственно, но различие недостоверно (р = 0,97).
Из 22 пациентов группы одновременной ХЛТ прогрессирование отмечалось у девяти больных. Из них у двоих зарегистрирован местный рецидив, у семи выявлены отдаленные метастазы.
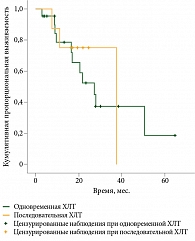
Медиана продолжительности жизни в группе последовательной ХЛТ достигла 37,6 месяца, в группе одновременной – 27,2 месяца (95% ДИ 15,2–39,2). Различие недостоверно (р = 0,8) (рис. 3).
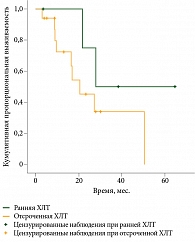
Медиана продолжительности жизни в группе ранней ХЛТ составила 27,9 месяца, в группе отсроченной – 20,4 месяца (95% ДИ 10,1–30,8). Различие статистически недостоверно (р = 0,2) (рис. 4).
Переносимость одновременной ХЛТ хуже последовательной. В группе одновременной ХЛТ лучевой эзофагит 1-й степени наблюдался у четырех (18%) больных, 2-й степени – у 17 (77%), 3-й степени – у одного (5%) пациента. Кроме того, лучевой пульмонит 2-й степени отмечался у двух (9%) больных, 2-й степени – у двух (9%), 1-й степени – у одного (5%) пациента. В группе последовательной ХЛТ эзофагит 1-й степени развился у троих (37,5%), 2-й степени – у троих (37,5%).
Обсуждение
Полученные данные свидетельствуют о преимуществе одновременной ранней ХЛТ над отсроченной. Достоверных различий не выявлено скорее всего вследствие недостаточного количества наблюдений. Хорошие показатели продолжительности жизни в группе последовательной ХЛТ, вероятно, обусловлены тем, что в данную группу не входят больные с первично рефрактерной формой МРЛ. Лучевую терапию получали больные без прогрессирования во время проведения химиотерапии. Преимущество последовательной ХЛТ над одновременной очевидно в отношении переносимости, в частности частоты лучевых эзофагитов и пульмонитов. Качество жизни у длительно живущих больных локализованным МРЛ играет не последнюю роль.
Для достижения статистической достоверности полученных результатов необходим дальнейший набор больных в исследовательские группы.
A.Ye. Kuzminov, V.A. Gorbunova, M.B. Bychkov, T.N. Borisova, S.G. Bagrova, A.A. Kuznetsova, I.E. Kuliyeva, I.V. Fray
N.N. Blokhin Russian Cancer Research Center
Contact person: Aleksandr Yevgenyevich Kuzminov, alexkouzminov@mail.ru
Treatment of small-cell lung cancer (SCLC) is based on applying chemoradiotherapy with platinum-containing drugs. However, a proper high confidence onset for radiotherapy vs. chemotherapy has not been yet determined. Here, we share with the experience accumulated at the Department of Chemotherapy in the N.N. Blokhin Russian Cancer Research Center in treatment of patients with localized SCLC. There were retrospectively assessed 30 patients with localized SCLC, 22 of whom received simultaneous chemoradiotherapy (CRT; group 1), eight patients – sequential CRT (group 2). In group 1, five patients received early CRT (together with one or two CRT courses). 24 (80%) patients received chemotherapy with cisplatin in combination with etoposide or irinotecan, six (20%) – carboplatin in combination with irinotecan, etoposide or paclitaxel. Median progression-free survival (PFS) in group 1 was 12.1 months (95% confidence interval (CI) 9.4–15), in group 2 – 7.5 months (95% CI 0–15.6) (р = 0.2). Median PFS in group with early CRT reached 10.5 months, whereas in group with delayed CRT – 12.5 months (95% CI 4.5–19.7) (р = 0.5). No significant differences in magnitude of median PFS depending on chemotherapy regimen (cisplatin versus carboplatin and irinotecan versus etoposide) was found. Median total survival in group 1 was 37.6 months, in group 2 – 27.2 months (95% CI 15.2–39.2) (р = 0.8). Median life expectancy in group with early CRT reached 27.9 months, group with delayed CRT – 20.4 months (95% CI 10.1–30.8) (р = 0.2). Tolerability of simultaneous vs. sequential CRT was poor. In group 1, radiation esophagitis (Grade 3–4) was developed in 18 (82%) patients, radiation pneumonitis (Grade 2) – in two (9%) patients, radiation dermatitis (Grade 2) – nine (9%) patients. In group 2, esophagitis (Grade 2) was recorded in three (37.5%) cases. The data obtained evidence that simultaneous early vs. delayed CRT was more advantageous. Lack of significant differences was most probably due to insufficient number of clinical cases assessed in the study. Good range of life expectancy in sequential CRT was, probably, due to the fact that patients with primary chemotherapy-resistant SCLC were not included into this group. It seems that benefits of sequential vs. simultaneous CRT were observed in terms of tolerability, particularly, rate of radiation esophagitis and pneumonitis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.