Сочетанная химиолучевая терапия немелкоклеточного рака легкого
- Аннотация
- Статья
- Ссылки
Cовременное консервативное лечение рака легкого подразумевает проведение химиотерапии, лучевой терапии или сочетание лекарственного и лучевого методов в разной последовательности в зависимости от клинической ситуации.
Неоперабельные пациенты с Т3-4 или N2-3 (IIIA-IIIB стадия) – основные претенденты на проведение химиолучевой терапии, больные с I-II стадией, но имеющие противопоказания к хирургическому лечению, также могут получать консервативное лечение.
В настоящее время химиолучевая терапия стала стандартным подходом в лечении больных НМРЛ с неоперабельной III стадией, имеющих удовлетворительное общее состояние.
Многочисленные рандомизированные исследования показали преимущества по выживаемости у больных с нерезектабельной IIIB стадией при одновременном проведении цисплатин-содержащей химиотерапии и лучевой терапии по сравнению с одной лучевой терапией. Ослабленные больные с IIIB стадией являются кандидатами для паллиативной лучевой терапии. Основными вопросами, которые обсуждаются в настоящее время, являются выбор оптимальной последовательности и режима химиотерапии и лучевой терапии, конкретных цитостатиков с учетом их радиосенсибилизирующих свойств.
В клиническом исследовании LAMP (Locally Advanced Multimodality Protocol) изучали 3 различных режима с Таксолом при IIIВ cт. НМРЛ (1):
- Таксол + карбоплатин (2 цикла), затем лучевая терапия (ЛТ) в дозе 63 г. Медиана выживаемости – 12,5 мес.
- Таксол + карбоплатин (2 цикла), затем Таксол + карбоплатин в еженедельном режиме + ЛТ в течение 7 нед., 63 г. Медиана выживаемости – 11 мес.
- Таксол + карбоплатин + ЛТ в течение 7 нед., 63 г, затем Таксол + карбоплатин (2 цикла). Медиана выживаемости – 16,1 мес.
Наилучший терапевтический эффект был получен в 3-й группе. Лечение оказалось хорошо переносимым. Несмотря на частые эзофагиты, 67% больных закончили химиолучевую терапию и 75% – консолидирующую химиотерапию.
Другие исследователи также сравнивали одновременную и последовательную химиолучевую терапию, и многие продемонстрировали лучшие результаты при одновременной химиолучевой терапии, позволяющей улучшить медиану выживаемости с 13 до 17 месяцев и двухлетнюю выживаемость с 15 до 30% (2-5). Однако проведение одновременной химиолучевой терапии может приводить к усилению токсичности.
Широко изучался режим Таксол + карбоплатин в сочетании с лучевой терапией, демонстрируя общий эффект 50-79% и медиану выживаемости 14-26 мес, при хорошей общей переносимости (6-8).
В современных программах химиолучевого лечения интенсивно изучается гемцитабин, являющийся сильным радиосенсибилизатором с коэффициентом улучшения ≥1,8-3 и продолжительностью радиосенсибилизирующего действия 48 ч, и новый мультитаргетный антифолат алимта.
По мнению некоторых исследователей, назначение индукционной химиотерапии перед химиолучевой терапией может ухудшать переносимость последней, что в свою очередь может привести к ухудшению отдаленных результатов. Целесообразность проведения поддерживающей (консолидирующей) химиотерапии после химиолучевого лечения остается в настоящее время предметом изучения.
Сочетанная химиолучевая терапия стала стандартным методом лечения больных с неоперабельной III стадией НМРЛ и для больных с любой стадией, которые не могут быть оперированы по медицинским показаниям. Тактика лечения может меняться в зависимости от индивидуальных особенностей пациента. Для ослабленных и пожилых больных полные дозы сочетанной химиолучевой терапии могут оказаться токсичными, что требует их редукции или расщепления курса.
При проведении химиолучевой терапии лучевая составляющая имеет очень большое значение. Эффективность лучевой терапии зависит от двух основных параметров, связанных между собой, – суммарной дозы радиации и объема облучения. Чтобы контролировать опухоль диаметром 3 см, требуются дозы до 70 г, но большинство опухолей легкого обычно имеют диаметр больше 3 см. Использование более высоких доз ионизирующего излучения ограничивается переносимостью нормальных тканей, входящих в объем облучения: пораженная часть легкого, сердце, спинной мозг, пищевод. Имеется несколько подходов для улучшения местного контроля: увеличение физической дозы (конформальная пространственная лучевая терапия − 3D-CRT (3D conformal Radio-therapy), эндобронхиальное облучение − brachytherapy, интраоперационная лучевая терапия), увеличение биологической дозы (гиперфракционирование, радиосенсибилизация) или сочетание лекарств и излучения.
Последние 10 лет при активном применении новых схем ХТ, с развитием и внедрением новых диагностических методов исследования и планирования лучевой терапии, появились данные о возможности уменьшения объема облучения до границ определяемой опухоли + 1,5-2 см вокруг. Предложено исключать непораженный противоположный корень легкого и надключичные области из зоны «профилактического» облучения, что осуществлялось в прежних программах.
Проблема фракционирования (разовые и суммарные очаговые дозы, количество фракций, общее время лечения) является не менее важной, так как определяет продолжительность облучения, эффективность и степень постлучевых повреждений.
В настоящее время стандартным фракционированием является доза 2 г один раз в день, продолжительность курса 5-7 недель при облучении 5 раз в неделю. В США используются дозы 1,8 г, дозы 3-4 г и более используются в исследовательских программах и в качестве паллиативных курсов. Теоретически предполагается, что небольшие фракции (1-1,3 г) меньше повреждают нормальные ткани по сравнению со стандартными фракциями и что нормальные ткани более способны к восстановлению, чем опухолевые клетки.
Гиперфракционирование – это облучение, проводимое несколько раз в день в дозе от 1,0 до 1,3 г.
Очень интересный подход состоит в объединении 3D-CRT с гиперфракционным облучением с сохранением постоянного времени курса лечения или даже уменьшением его длительности. Во второй фазе испытания показана возможность подведения к опухоли суммарно 80 г за 5 недель лечения, выполняя облучение два раза в день по 1,6 г.
Определенные надежды возлагаются на методику 3-D планирования с проведением облучения на ускорителях с многолепестковой диафрагмой, с созданием индивидуальных фигурных полей. Существенным для этой методики является организация постоянного контроля выполнения плана лечения с помощью изготовления гаммаграмм, симуляционных снимков. Эта методика позволяет подводить к первичной опухоли суммарные дозы до 70-80 г, определять лучевую нагрузку на критические органы (непораженное легкое, спинной мозг, сердце, пищевод, печень) в объеме. В то же время этот метод требует хорошего технического обеспечения лучевых отделений, подготовленных кадров физиков, врачей, постоянного анализа результатов лечения.
Лучевая терапия, особенно проводимая одновременно с химиотерапией, сопровождается побочными явлениями, которые могут препятствовать выполнению плана лечения (эзофагит, гематологическая токсичность) и ухудшать качество жизни больных в будущем из-за развития пульмонита.
Изучение эффективности и переносимости химиолучевой терапии с использованием современных достижений и возможностей лучевой терапии, в частности режима динамического гиперфракционирования, и новых противоопухолевых препаратов (Таксол, Таксотер, Гемзар) является весьма актуальным направлением в лечении местнораспространенных форм НМРЛ.
Представляем опыт лечения 43 больных НМРЛ, которым проведена химиолучевая терапия в режиме динамического гиперфракционирования в РОНЦ РАМН в 2000-2003 гг.
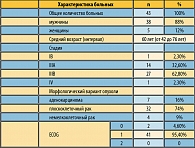
В исследование включались больные НМРЛ с местнораспространенной формой заболевания и невозможностью оперативного лечения, с подтвержденным морфологическим диагнозом, общим состоянием (ЕСОG) 0-II, ожидаемой продолжительностью жизни не менее трех месяцев и адекватными показателями лабораторных анализов.
Одновременное химиолучевое лечение проводилось в течение 4,5-5 недель с последующими тремя курсами поддерживающей химиотерапии.
При проведении сочетанной химиотерапии использовались следующие режимы лечения:
- Доцетаксел 25 мг/м2 еженедельно (1, 8, 15, 22-ой дни), курсовая доза 100 мг/м2 + Цисплатин 25мг/м2 еженедельно (1, 8, 15, 22-ой дни), курсовая доза 100 мг/м2;
- Паклитаксел 50 мг/м2 еженедельно (1, 8, 15, 22 дни), курсовая доза 200 мг/м2 + Цисплатин 25 мг/м2 еженедельно (1, 8, 15, 22-ой дни), курсовая доза 120 мг/м2;
- Гемцитабин 800 мг/м2 еженедельно (1, 8, 15, 22-ой дни), курсовая доза 3200 мг/м2 + Цисплатин 25 мг/м2 еженедельно (1, 8, 15, 22-ой дни), курсовая доза 120 мг/м2.
Лучевая терапия проводилась по следующей схеме:
- 1-я неделя – 14,85 г:1-2 дни по 1,35 г 1 раз в день; 3-5 дни по 1,35 г 3 раза в день (интервал 4 часа);
- 2-5-я недели по 12 г в неделю по 1,2 г 2 раза в день ( интервал 6 часов).
За курс лучевой терапии СОД составляет 58-63 г. По таблицам ВДФ без учета размеров полей и расщепления суточной дозы СОД составляет 68-72 г. В условиях недостаточной информации о локорегиональном процессе лечение делится на II этапа. Первый этап (3 недели, СОД 38,8 г) обрабатывание наибольшего объема определяемого распространенностью местного процесса (Т и N), степенью дифференцировки опухоли. Второй этап (4 и 5 недели, СОД до 63 г) уменьшение объема облучения с максимальной защитой критических органов.
У больных в нашем исследовании облучение надключичных лимфатических узлов с профилактической целью не проводилось. Кроме того, неувеличенные лимфоузлы средостения на II этапе не облучались.
Клиническая характеристика больных, получавших химиолучевую терапию, представлена в таблице 1.
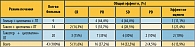
Непосредственный эффект лечения больных представлен в таблице 2.
Медиана времени наблюдения составила 3,5 года. Эффект лечения оценен у 37 больных, эффект не удалось оценить у 6 больных. Из 43 больных полная (CR) и частичная (PR) регрессия опухоли отмечена у 21 (48,8%) больного, из них у 5 (11,6%) – CR и у 16 (37,2%) – PR. Кроме того, стабилизация процесса наблюдалась у 14 (32,5%) больных.
Наиболее частыми ранними осложнениями, развивавшимися на фоне проводимой химиолучевой терапии, были эзофагит I-II, реже III степени, – 74,4% больных, тромбоцитопения I-II степени – 25,6%, нейтропения чаще I-II степени – 16,2% больных, общая слабость – 16,2% больных. Серьезным отсроченным осложнением являлся лучевой пульмонит с исходом в фиброз и клиническими симптомами легочной недостаточности разной степени выраженности, который был отмечен у 20,9% больных.
Медиана выживаемости составила 17 месяцев, медиана времени до прогрессирования – 7 месяцев. 1- 2- 3-летняя выживаемость – 60,5%, 32,9%, 23,5% соответственно.
Таким образом, эффективность и хорошие отдаленные результаты носят весьма обнадеживающий характер, однако высокий риск непосредственных и отсроченных побочных явлений (эзофагит, пульмонит) требуют тщательного отбора больных, общее состояние которых позволяет перенести это лечение, адекватной редукции доз препаратов и дозы облучения в процессе одновременной химиолучевой терапии при первых признаках побочных явлений.
Последовательное проведение химиотерапии и лучевой терапии позволяет использовать каждый метод в оптимальных дозах и допустимой токсичности, такая тактика остается методом выбора у ослабленных больных и при значительном местном распространении опухоли в легком.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.