Оценка роли микробиоты зева в формировании хронического лимфопролиферативного синдрома лор-органов у детей младшего возраста
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить роль микробиоты ротоглотки в формировании хронического лимфопролиферативного синдрома лор-органов у детей младшего возраста.
Материал и методы. У 44 пациентов в возрасте двух-трех лет выполнены культуральные бактериологические исследования мазков из зева, серологические и молекулярно-генетические анализы маркеров вируса Эпштейна – Барр (ВЭБ), цитомегаловируса (ЦМВ), вируса герпеса человека 6-го типа (ВГЧ-6) в крови, полимеразная цепная реакция (ПЦР) и реакция иммунофлуоресценции в соскобах медиальной поверхности миндалин.
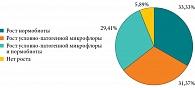
Результаты. В мазках из глотки рост микроорганизмов условно-патогенной и сапрофитной микробиоты не обнаружен в диагностически значимом количестве у 5,88% детей. Изолированный рост нормальной аэробной и/или факультативно-анаэробной микробиоты наблюдался у 33,33% детей. Условно-патогенная микробиота выявлена в 60,78% случаев, в том числе ассоциации сапрофитной микробиоты и условно-патогенных микроорганизмов – в 29,41% случаев. Наиболее часто у детей обнаруживали Staphylococcus aureus (61,29%). Известные респираторные патогены встречались реже: Haemophilus influenzae – 29,04%, Streptococcus pneumoniae – 12,91%, Moraxella catarrhalis – 3,23%. Str. pyogenes группы A выделен также в 3,23% случаев. У большинства пациентов (77,41%) выявлен один вид патобионтов. Инфицирование герпесвирусными инфекциями установлено у 97,73% детей, в том числе ВЭБ – у 70,45%, ВГЧ-6 – у 54,55%, ЦМВ – у 50,00% детей. Преобладали микст-инфекции (62,79%). Среди моноинфекций превалировала ВЭБ-инфекция (68,75%). Активная стадия герпесвирусной инфекции отмечалась в 63,64% случаев, из них в 64,29% имели место микст-инфекции. Признаки активной ВЭБ-инфекции зафиксированы у 52,27% детей, реактивация ВГЧ-6 – у 18,18%, активная персистенция ЦМВ – у 6,82%. Активная стадия герпесвирусных инфекций подтверждена исследованием браш-мазков слизистой оболочки зева методами иммунофлуоресценции и ПЦР.
Заключение. Выполненные традиционные полуколичественные исследования культур бактериальных колоний из образцов биотопа ротоглотки не выявили единый этиологический агент (патоген) хронического лимфопролиферативного синдрома лор-органов у детей младшего возраста.
Цель – оценить роль микробиоты ротоглотки в формировании хронического лимфопролиферативного синдрома лор-органов у детей младшего возраста.
Материал и методы. У 44 пациентов в возрасте двух-трех лет выполнены культуральные бактериологические исследования мазков из зева, серологические и молекулярно-генетические анализы маркеров вируса Эпштейна – Барр (ВЭБ), цитомегаловируса (ЦМВ), вируса герпеса человека 6-го типа (ВГЧ-6) в крови, полимеразная цепная реакция (ПЦР) и реакция иммунофлуоресценции в соскобах медиальной поверхности миндалин.
Результаты. В мазках из глотки рост микроорганизмов условно-патогенной и сапрофитной микробиоты не обнаружен в диагностически значимом количестве у 5,88% детей. Изолированный рост нормальной аэробной и/или факультативно-анаэробной микробиоты наблюдался у 33,33% детей. Условно-патогенная микробиота выявлена в 60,78% случаев, в том числе ассоциации сапрофитной микробиоты и условно-патогенных микроорганизмов – в 29,41% случаев. Наиболее часто у детей обнаруживали Staphylococcus aureus (61,29%). Известные респираторные патогены встречались реже: Haemophilus influenzae – 29,04%, Streptococcus pneumoniae – 12,91%, Moraxella catarrhalis – 3,23%. Str. pyogenes группы A выделен также в 3,23% случаев. У большинства пациентов (77,41%) выявлен один вид патобионтов. Инфицирование герпесвирусными инфекциями установлено у 97,73% детей, в том числе ВЭБ – у 70,45%, ВГЧ-6 – у 54,55%, ЦМВ – у 50,00% детей. Преобладали микст-инфекции (62,79%). Среди моноинфекций превалировала ВЭБ-инфекция (68,75%). Активная стадия герпесвирусной инфекции отмечалась в 63,64% случаев, из них в 64,29% имели место микст-инфекции. Признаки активной ВЭБ-инфекции зафиксированы у 52,27% детей, реактивация ВГЧ-6 – у 18,18%, активная персистенция ЦМВ – у 6,82%. Активная стадия герпесвирусных инфекций подтверждена исследованием браш-мазков слизистой оболочки зева методами иммунофлуоресценции и ПЦР.
Заключение. Выполненные традиционные полуколичественные исследования культур бактериальных колоний из образцов биотопа ротоглотки не выявили единый этиологический агент (патоген) хронического лимфопролиферативного синдрома лор-органов у детей младшего возраста.
Введение
В этиологии и патогенезе множества заболеваний важную роль играет микробиота человека [1, 2]. Уточнение этой комплексной роли требует целенаправленной характеристики микробных сообществ, населяющих соответствующие экологические ниши в критические периоды патогенеза.
Верхние дыхательные пути детей младшего возраста (до 36 месяцев жизни) часто бессимптомно колонизируют Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis и Staphylococcus aureus [3]. В то же время Str. pneumoniae, H. influenzae и M. catarrhalis – наиболее распространенные возбудители среднего отита. Str. pneumoniae также часто вызывает пневмонию, сепсис и менингит у детей раннего возраста. S. aureus ассоциируется с широким спектром заболеваний, включая инфекции мягких тканей, сепсис и пневмонию. Колонизация является начальным этапом патологического процесса, а колонизированные дети служат резервуаром для дальнейшей передачи инфекции [3].
Объектом для изучения в настоящей работе стало горло, в частности ротоглотка, которая является доступным источником микробных сообществ лор-органов, а также своеобразным коридором для продвижения патогенов, ассоциированных с заболеваниями нижних дыхательных путей и желудочно-кишечного тракта.
Хроническая патология лимфаденоидного глоточного кольца доминирует в структуре заболеваемости детей младшего возраста. К заболеваниям с лимфопролиферативным синдромом относят доброкачественные заболевания инфекционной природы, сопровождающиеся увеличением периферических лимфоидных органов (лимфатических узлов, миндалин, иногда печени и селезенки) [4]. Этиология лимфопролиферативного синдрома разнообразна и включает как лимфотропные патогены (герпесвирусы [5], аденовирусы [6, 7], энтеровирусы, вирусы кори, краснухи, токсоплазмы, иерсинии, микобактерии, бруцеллы, трепонемы, листерии, Str. pyogenes группы A и др.), так и нелимфотропные возбудители (стафилококки, сальмонеллы, стрептококки, боррелии и др.) [4]. Типичный клеточный и гуморальный иммунный ответ направлен на эффективную защиту от большинства антигенов. Вместе с тем существуют патогены, для разрушения и элиминации которых эффекторных механизмов иммунитета недостаточно [4]. Детский возраст характеризуется транзиторным физиологическим иммунодефицитом, обусловленным естественными процессами формирования. Третий критический период становления функциональных возможностей иммунной системы, когда иммунитет дает неадекватный или даже парадоксальный ответ на антигенное воздействие, приходится на второй год жизни. Именно в этом возрасте значительно расширяются контакты ребенка с внешним миром на фоне смены супрессорного типа иммунной системы на хелперный, но система местного иммунитета остается несовершенной [8]. Предполагают, что обитающая в специфических анатомических областях основная («ядерная») микробиота непосредственно влияет на иммунитет и функцию эпителиального барьера [2]. Физиологическая иммунокомпрометация у детей младшего возраста (два-три года) сопровождается слабостью клеточного иммунного ответа и местного иммунитета и высокой чувствительностью к вирусным инфекциям верхних дыхательных путей и бронхолегочной системы [4, 8].
Цель – оценить роль микробиоты зева в формировании хронического лимфопролиферативного синдрома лор-органов у детей младшего возраста (два-три года) на основании результатов бактериологического исследования мазков отделяемого задней стенки глотки и серологических исследований.
Материал и методы
В исследование были включены 44 ребенка (29 мальчиков и 15 девочек) в возрасте двух-трех лет (средний возраст – 3 года 2 месяца). Критериями включения пациентов в исследование служили ранний детский возраст и клиническая картина хронического лимфопролиферативного синдрома продолжительностью свыше 3–6 месяцев. Для исключения иммунопролиферативных заболеваний всем детям выполнено лабораторное исследование с полной гемограммой (клинический анализ крови с лейкоцитарной формулой). Сбор жалоб, анамнеза жизни и заболевания проведен по общепринятой методике. Согласно данным объективного исследования (традиционная передняя и задняя риноскопия, фарингоскопия, непрямая ларингоскопия и отоскопия, для детального осмотра – оптическая эндоскопия носоглотки, отомикроскопия, импедансометрия), всем пациентам была показана плановая операция в области лимфоэпителиального глоточного кольца.
Культуральное бактериологическое исследование мазков из зева включало микроскопическое исследование, идентификацию вида бактерий после выделения чистой культуры по набору морфологических, тинкториальных, культуральных, биохимических и антигенных свойств, определение чувствительности выделенных штаммов к антимикробным препаратам традиционным диско-диффузионным методом в соответствии с приказом Минздрава СССР от 22 апреля 1985 г. № 535 «Об унификации микробиологических методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений». В соскобах (браш-мазки) со слизистой оболочки задней стенки глотки проведена полимеразная цепная реакция (ПЦР) для выявления ДНК вируса Эпштейна – Барр (ВЭБ), цитомегаловируса (ЦМВ) и вируса герпеса человека 6-го типа (ВГЧ-6). В браш-мазках со слизистой медиальной поверхности миндалин части детей выполнена реакция иммунофлуоресценции (РИФ) с родовыми антигерпетическими сыворотками (вирусы ВЭБ, ЦМВ, ВГЧ-6). Биологический материал отбирали перед началом применения противобактериальных, антивирусных и противопаразитарных лекарственных средств, а также до любых лечебных или диагностических мероприятий, не менее чем через полторы-две недели после окончания использования лекарственных средств местного действия и минимум через месяц после общего лечения.
Выполнены серологические и молекулярно-генетические анализы маркеров герпесвирусных инфекций (ВЭБ, ЦМВ и ВГЧ-6) в крови, ПЦР и РИФ с одноименными родовыми антигерпетическими сыворотками в отделяемом задней стенки глотки.
Детекцию серологических маркеров инфицирования герпесвирусами проводили методом количественного иммуноферментного анализа (ИФА) с определением специфических антител классов иммуноглобулинов M и G к антигенным детерминантам ЦМВ, ВГЧ-6, ядерному, вирусному капсидному антигенам и комплексу ранних антигенов ВЭБ. Для выявления вирусной ДНК в лимфоцитах крови использовали молекулярно-генетические методы (ПЦР).
Статистический анализ выполнен с помощью программного обеспечения GraphPad Prism 5. Для сравнения долей между группами использованы двусторонний вариант точного теста Фишера (Fisher’s exact test) и показатель отношения шансов (odds ratio). Значения p < 0,05 считали статистически значимыми.
Результаты и обсуждение
С применением классических бактериологических (культуральных) методов в мазках из зева рост микроорганизмов патогенной, условно-патогенной и сапрофитной микробиоты не обнаружен в диагностически значимом количестве (1 × 104 КОЕ/мл и больше) у 5,88% детей. Представители патогенной микробиоты I и II групп патогенности отсутствовали во всех наблюдениях. Изолированный рост нормальной аэробной и/или факультативно-анаэробной микробиоты наблюдали у 33,33% детей. Вне ассоциаций с условно-патогенными микроорганизмами детектирован обильный (53,85%), умеренный (38,46%) и скудный (7,69%) рост Streptococcus группы viridans (псевдотаксономический термин (под ним понимают группу видов, как если бы они были одним видом), часто используемый для обозначения группы видов альфа-гемолитических стрептококков или Streptococcus viridans group, или стрептококков группы viridans) (65,00%), умеренный (81,18%), обильный или скудный (по 9,09%) рост Neisseria spp. (55,00%), обильный и умеренный рост Corynebacterium spp. (10,00%), умеренный рост негемолитического стрептококка (5,00%), скудный рост коагулазоотрицательных Staphylococcus spp. (5,00%). В нормобиоте преобладали монокультуры (60,00%), реже встречались двухкомпонентные ассоциации (40,00%). В большинстве из них одним из нормобионтов были непатогенные Neisseria spp. (75,00%) и Streptococcus группы viridans (62,50%).
Условно-патогенная микробиота в мазках со слизистой оболочки задней стенки глотки выявлена у 60,78% детей (рис. 1). Наиболее часто обнаруживали S. aureus – 61,29%. В большинстве случаев (68,43%) наблюдали умеренный рост (104–105 КОЕ/мл), реже скудный (102–103 КОЕ/мл) – 21,06% или обильный рост (106 КОЕ/мл и выше) – 10,53%. Известные респираторные патогены в ротоглотке встречались реже: H. influenzae – 29,04% случаев (в частности, в 66,67% случаев имел место умеренный рост, в 33,33% – обильный), Str. pneumoniae – 12,91% (умеренный и скудный рост с одинаковой частотой), M. catarrhalis – 3,23% случаев (обильный рост). Наиболее значимый бактериальный возбудитель острых тонзиллитов и фарингитов S. pyogenes группы A выделен в 3,23% случаев, обильный рост патобионта отмечали на фоне клинического благополучия. Через десять дней после бактериологического исследования у девочки диагностирован стрептококковый назофаринготонзиллит (антистрептолизин-О 366 МЕ/мл). У большинства пациентов (77,41%) выделены монокультуры условно-патогенных микробов. Поликомпонентные ассоциации условно-патогенных микроорганизмов чаще содержали два компонента (85,71%), реже три (14,29%). В 71,43% двухкомпонентных ассоциаций условно-патогенных микроорганизмов присутствовал S. aureus: обильный рост в сочетании с умеренным ростом H. influenzae, умеренный рост в сочетании с умеренным ростом Str. pneumoniae, скудный рост в сочетании со скудным ростом Str. pneumoniae либо скудным ростом Candida albicans или скудным ростом C. glabrata. Пневмококк выделен исключительно в ассоциациях (57,14%), в половине случаев с S. aureus, двухкомпонентной ассоциации с H. influenzae (умеренный рост обоих патобионтов) и трехкомпонентной ассоциации. Умеренный рост H. influenzae зарегистрирован в 42,86% поликомпонентных ассоциаций, а именно двухкомпонентных ассоциаций S. aureus и Str. pneumoniae, а также трехкомпонентной ассоциации, характеризовавшейся скудным ростом Str. pneumoniae и Corynebacterium xerosis. Микологическое исследование мазков из зева на дрожжеподобные грибы рода Candida показало скудный рост в единичных случаях (9,68%). Из них монокультура C. albicans выявлена в 33,33% случаев, упомянутые ассоциации со скудным ростом S. aureus – в 66,67%. Из отделяемого зева 3,23% детей выделен нетрадиционный для данной локализации микроорганизм – монокультура Escherichia coli (умеренный рост). Кишечная палочка относится к кишечным комменсалам, в больших количествах входит в состав кишечной микробиоты здоровых людей, хотя отдельные штаммы являются патогенными и для желудочно-кишечного тракта. Однако вне места нормального обитания E. coli может выступать в роли внекишечного патогена, в частности быть причиной инфекций дыхательных путей. Вызванные кишечной палочкой инфекции расценивают как показатель микробиологического неблагополучия. Скудный (пограничный с умеренным) рост условно-патогенной коринебактерии Corynebacterium xerosis [9] обнаружен только у 3,23% детей в составе вышеприведенной трехкомпонентной ассоциации. В целом в этиологически значимом количестве условно-патогенные микроорганизмы выделены из слизи задней стенки глотки у 50,98% детей: S. aureus – у 57,69%, H. influenzae – у 30,77%, Str. pneumoniae – у 7,69%, M. catarrhalis – у 3,85%, S. pyogenes группы A – у 3,85%, E. coli – у3,85% детей.
Ассоциации сапрофитной микробиоты и условно-патогенных микроорганизмов выявлены у 29,41% детей. В ассоциации с условно-патогенными микроорганизмами обнаружены представители нормобиоты: Streptococcus группы viridans (80,00%), Neisseria spp. (60,00%), S. salivarius (6,67%), H. parainfluenzae (6,67%), Corynebacterium spp. (6,67%). В 33,33% ассоциаций резидентных и условно-патогенных микроорганизмов имел место рост представителей нормобиоты в виде монокультуры. Интенсивность роста микроорганизмов в ассоциациях нормобиоты и условно-патогенных микроорганизмов была одинаковой в 53,33% случаев. В 40,00% рост условно-патогенных микроорганизмов был выше, в 6,67% ниже (при выявлении C. albicans). Обильный (26,67%) и скудный (13,33%) рост патобионта сопровождался обильным ростом нормобиоты. Умеренный рост патобионтов ассоциирован с обильным, умеренным или скудным ростом нормобиоты – 42,85, 42,85 и 14,29% случаев соответственно. В составе ассоциаций нормобиоты с условно-патогенными микроорганизмами S. aureus составил 60,00%, H. influenzae – 40,00%, Str. pneumoniae – 13,33%, C. albicans и Corynebacterium xerosis – по 6,67%.
Почти у трети детей (31,37%) в ротоглотке наблюдался изолированный рост условно-патогенных микроорганизмов. Вне ассоциаций с нормобиотой условно-патогенные микроорганизмы в зеве были представлены S. aureus – 62,50%, H. influenzae – 18,75%, Str. pneumoniae – 12,50%, M. catarrhalis, S. pyogenes группы А, E. coli, C. albicans, C. glabrata – по 6,25%, в том числе 25,00% двухкомпонентных ассоциаций с преобладанием патобионта S. aureus (75,00%).
Более чем у трети детей (37,25%) сапрофитная микробиота из отделяемого слизистой оболочки глотки не выделена. В целом среди облигатных представителей слизистой оболочки ротоглотки выявлены Streptococcus группы viridans (49,06%), S. salivarius (1,89%), негемолитический стрептококк (1,89%), непатогенные Neisseria spp., в том числе N. mucosa, N. flavescens, N. subflava, N. perflava (37,74%), коагулазоотрицательные Staphylococcus spp. (1,89%), H. parainfluenzae (1,89%), Corynebacterium spp. (5,66%).
Проведенный нами анализ культивируемой микробиоты зева в двух группах больных, сформированных в зависимости от степени выраженности лимфопролиферативного синдрома (выраженный – 33 ребенка, умеренно выраженный – 11 детей), статистически значимых различий не продемонстрировал (точный тест Фишера, p > 0,05 во всех случаях). Критерии определения степени выраженности лимфопролиферативного синдрома изложены нами ранее [10].
Сложные микробные сообщества присутствуют на всем протяжении верхних дыхательных путей, бактериальное разнообразие ротоглотки выше, чем передних отделов носа [2]. В полости рта здорового человека идентифицировано свыше 700 неродственных видов или филотипов бактерий, более 60% которых некультивируемые [11]. Ротовая полость человека значительно колонизирована вирусами, грибами, простейшими, археями и бактериями, как комменсалами, так и условно-патогенными. Как показал анализ, проведенный в рамках проекта «Микробиом человека», среди систем организма с наибольшим бактериальным разнообразием микробиом полости рта уступает только ободочной кишке, при этом уникальные члены сообщества обнаруживаются в горле [12, 13]. Многие обитатели полости рта ассоциированы с заболеваниями зубов, в том числе пародонтитом и инфекциями корневых каналов, и тонзиллитом [12, 14]. Некоторые виды коринебактерий могут вызывать гнойное воспаление в ротовой полости [15]. Микробиота глотки многочисленна, вариабельна, в норме сходна с микробиотой пищеварительного и респираторного трактов [16, 17]. Спектр комменсалов формируется благодаря эволюционно сложившимся симбиозу и антагонизму между микроорганизмами и их взаимоотношениям с организмом человека. Ротоглотка содержит кольцо Пирогова – Вальдейера, состоящее из лимфоидной ткани, которую подобно пейеровым бляшкам кишечника рассматривают как первичный участок распознавания антигенов и инфекционного контроля. На уровне бактериальных семейств в ротоглотке наиболее распространенным является Streptococcaceae [12]. Примерно 30–60% всей микрофлоры полости рта составляют факультативно- и облигатно-анаэробные стрептококки [15]. В нашей работе стрептококки составили свыше половины (52,83%) выделенных из зева культур нормобиоты и 34,78% от общего числа выделенных культур. Другие резидентные микроорганизмы полости рта, в частности обнаруженные у наших пациентов стафилококки (коагулазоотрицательные Staphylococcus spp.), нейссерии, дрожжеподобные грибы Candida, относятся к второстепенным представителям микробиоты и находятся в гораздо меньшем количестве [15], что подтвердили наши наблюдения. Непатогенные нейссерии, в том числе N. sicca, N. flavescens, N. perflava, N. mucosa, N. lactamica, – представители нормальной микробиоты ротовой полости, верхних дыхательных путей обитают на слизистых оболочках человека. Условно-патогенные нейссерии являются этиологическими агентами отитов, синуситов и других гнойно-воспалительных заболеваний у иммунокомпрометированных лиц. К настоящему времени N. mucosa, N. sicca и N. flavescens зарегистрированы в качестве возбудителей пневмонии, эмпиемы, бронхопневмонии или бронхоэктатической болезни, N. flavescens также как возбудитель септицемии, менингита и эндокардита [18]. В литературе в отношении N. subflava у пациентов с иммуносупрессией и детей описаны инвазивные инфекции, в том числе бактериемия у новорожденного [19]. В единичных случаях умеренный или скудный рост этих микроорганизмов отмечался в мазках из зева обследованных нами детей.
Изменение пропорционального относительного содержания многочисленных ротоглоточных бактерий способствует развитию рецидивирующего тонзиллита [12]. При сравнении микробиома небных миндалин больных рецидивирующим тонзиллитом взрослых и гипертрофией миндалин детей установлено наличие стрептококков во всех образцах. В то же время нетипируемый H. influenzae, виды Neisseria и Str. pneumoniae чаще присутствуют у детей [12].
Полученные нами результаты согласуются с данными литературы: уменьшение микробного разнообразия и низкие уровни роста в ротоглотке нормальных для данной локализации микроорганизмов являются частыми признаками хронических воспалительных заболеваний с дисбиозом в верхних дыхательных путях [13]. В анамнезе обследованных нами детей в возрасте двух-трех лет имели место частые простудные заболевания вирусной и бактериальной этиологии, рецидивирующие острые отиты (до шести эпизодов в год) и аллергические реакции. Все дети неоднократно проходили курсы антибактериальной, противовирусной, антимикотической, кортикостероидной и иммуномодулирующей терапии. Свыше половины детей (65,91%) участковыми педиатрами отнесены к категории часто болеющих (шесть и более острых и обострений хронических заболеваний за год).
Стабильность микробиоты верхних дыхательных путей снижается на фоне медикаментозной терапии [3, 20]. Антибиотики нарушают паттерн бессимптомной колонизации [1]. Широко применяемые лечебные и профилактические процедуры, такие как антибиотикотерапия, вакцинация, меняют состав локальной микробиоты, вызывают утрату микробного разнообразия не только в кишечнике, но и в верхних отделах дыхательных путей детей и взрослых, что способствует увеличению относительного содержания грамотрицательных бактерий, а также Moraxella spp., Haemophilus spp., Staphylococcus spp. и Streptococcus spp. [13, 21]. В нормальных условиях указанные бактерии не способны конкурировать в этой нише, но благодаря толерантности к некоторым антибиотикам (например, H. influenzae и Chlamydia pneumoniae резистентны к бета-лактамным антибиотикам, S. pneumoniae – к аминогликозидам, фторхинолонам и бета-лактамам) могут развиваться во время антибиотикотерапии и становятся патогенными [13]. Дисбиозы (функциональные нарушения или изменения состава микробиома) часто характеризуются потерей полезных, комменсальных (сопутствующих) бактерий, которые защищают организм от чрезмерного роста условно-патогенных бактерий. Это может встречаться также на фоне усиленного роста обитающих в биопленках анаэробных бактерий [13]. В результате утраты защитных резидентных непатогенных бактерий происходит отбор микроорганизмов с патогенным потенциалом [12]. Представители факультативной микробиоты замещают нишу конкретного биотопа, освободившуюся в случае нарушений или гибели резидентной микробиоты, что в дальнейшем способствует развитию патологического процесса [15].
Бессимптомное носительство каждого вида комменсалов, которые обладают патогенным потенциалом при воспалительных процессах респираторного тракта (S. aureus, Str. pneumoniae, H. influenzae, M. catarrhalis) и в норме бессимптомно колонизируют слизистую [3], может быть стабильным на протяжении недель или месяцев и встречается более чем у половины представителей некоторых групп населения, особенно у маленьких детей [21]. Ведущую роль в развитии воспалительных заболеваний глотки и небных миндалин играют микроорганизмы, вегетирующие на слизистой оболочке ротовой полости и глотки [16]. Факторами риска носительства респираторных патогенов H. influenzae и Str. pneumoniae признаны возраст до трех лет (p < 0,05) и посещение детского сада (p < 0,05) [22]. При вирус-ассоциированных острых респираторных инфекциях у детей критического первого года жизни отмечаются транзиторные инвазии Streptococcus spp., Moraxella spp. или Haemophilus spp. [1]. H. influenzae и Str. pneumoniae вызывают болезни, когда получают доступ к другим в норме стерильным участкам [21]. Бессимптомное носительство S. aureus в популяции имеет место у 20–30% населения [20, 23]. Штаммы S. aureus колонизируют до 35% здоровых детей в возрасте 6–36 месяцев [3].
В обследованной нами группе детей двух-трех лет частота выявления S. aureus составила 37,25%, а в этиологически значимом количестве – 29,41%, что не выше показателей в общей популяции и у здоровых детей того же возраста. Низкая частота выделения из зева культур оппортунистических микроорганизмов – возбудителей персистирующих бактериальных инфекций, главным образом S. aureus, Haemophilus spp., Streptococcus spp., может быть обусловлена персистенцией этих бактерий преимущественно внутриклеточно или внутри биопленок слизистых оболочек [24]. Колонизация носоглотки M. catarrhalis также происходит чаще, чем ее выявляют культуральные методы, поскольку помимо адгезии к эпителиальной поверхности M. catarrhalis внедряется в клетки эпителия и субэпителиальное пространство.
Стратегия вакцинации и антимикробная терапия, нацеленные на специфические виды бактерий, могут изменять микробиоту в непредсказуемых направлениях [3]. Внедрение пневмококковых вакцин привело к повышению уровня защиты, особенно у детей в возрасте до пяти лет, снижению частоты носительства и заболеваемости пневмококковыми инфекциями (пневмония, сепсис, менингит, средний отит). В процессе подготовки к иммунизации здоровых детей в возрасте 6–24 месяцев пневмококк выделяется у 45,0%, при этом почти у четверти детей имеет место колонизация вакцинными серотипами пневмококка [25]. Завершенная трехкратная серия вакцинации против H. influenzae типа b также снижает частоту носительства пневмококка (p < 0,04) [25].
Среди факультативных микроорганизмов, кратковременно заселяющих полость рта и не приводящих к развитию патологического процесса, чаще встречаются энтеробактерии [15]. Выделение нетрадиционных для зева микроорганизмов кишечной микробиоты согласуется с представлениями о формировании иммунной оси «кишечник – легкие» в рамках существующей концепции иммунной солидарности слизистых оболочек, согласно которой кишечный микробиом влияет на анатомически удаленные слизистые и иммунную систему в целом. Принято считать, что приблизительно до трех лет микробиота верхних дыхательных путей сходна с микробиотой кишечника, а в более старшем возрасте приобретает относительную специфичность [20, 26]. Проведенные нами традиционные полуколичественные исследования культур бактериальных колоний из образцов биотопа ротоглотки не выявили единый причинный агент (патоген) хронического лимфопролиферативного синдрома лор-органов у детей младшего возраста.
Известно, что используемые с конца XIX в. культуральные анализы (посевы) выявляют не более 1% микрофлоры, особенно при культивировании анаэробов, в отличие от пришедших в 1985–1993 гг. им на смену физико-химических методов анализа и молекулярно-генетических методов (ПЦР) [15, 26]. Высказывается предположение, что вирусы, особенно бактериофаги, численно превосходят бактериальное сообщество в соотношении по крайней мере 10:1 и вносят не менее существенный вклад в гомеостаз организма-хозяина, воздействуя на бактериальный фенотип и функцию или непосредственно взаимодействуя со слизистыми оболочками организма [20]. Роль микробиома верхних дыхательных путей и различных вирусно-бактериальных ассоциаций в возникновении и поддержании воспалительного процесса в миндалинах лимфаденоидного глоточного кольца детей раннего дошкольного возраста активно изучается. Физиологическая незрелость иммунной системы детского организма не позволяет вырабатывать длительную защиту от основных вирусных агентов, тропных к лимфоидной ткани и способствующих развитию хронических персистирующих заболеваний, протекающих с лимфопролиферативным синдромом: герпесвирусных инфекций (ВЭБ, ВГЧ-6, ЦМВ и др.), аденовирусной инфекции, полиэтиологических рекуррентных респираторных заболеваний [27–29]. Наряду с выделением вирусов в культуре клеток (доступно только специализированным лабораториям) или ПЦР Всемирная организация здравоохранения рекомендует использовать метод флуоресцирующих антител для идентификации возбудителей респираторных вирусных инфекций [30].
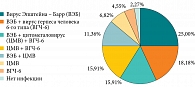
Выполненные нами серологические и молекулярно-генетические исследования маркеров герпесвирусных инфекций при хроническом лимфопролиферативном синдроме лор-органов у детей младшего возраста показали инфицирование в 97,72% случаев, в том числе ВЭБ – 70,45%, ВГЧ-6 – 56,45%, ЦМВ – 50,00% случаев. Преобладали микст-инфекции – 62,79%, среди моноинфекций превалировала ВЭБ-инфекция – 68,75% (рис. 2).
Активная стадия герпесвирусной инфекции отмечалась более чем у половины обследованных детей (63,64%), в частности у 35,71% – по типу моноинфекции (90,00% – ВЭБ, 10,00% – ВГЧ-6) и 64,29% – микст-инфекции (44,44% – ВЭБ + ВГЧ-6). В целом часто выявлялись признаки активной ВЭБ-инфекции – 52,27%. Реактивация ВГЧ-6 наблюдалась в 18,18% случаев. Заметно реже регистрировалась активная персистенция ЦМВ – 6,82%. Активность инфекционного процесса среди детей с герпетическими микст-инфекциями в 77,78% случаев обусловлена реактивацией ВЭБ, в 44,44% – ВГЧ-6, в 16,67% – ЦМВ. Одновременная реактивация двух герпетических инфекций имела место у 27,78% детей. Активная стадия герпесвирусных инфекций подтверждена исследованием браш-мазков слизистой оболочки медиальной поверхности миндалин иммунофлуоресцентным методом и ПЦР. Тропные к лимфоидной и эпителиальной ткани слизистой оболочки дыхательных путей герпесвирусы представляют серьезную угрозу мукозальному иммунитету [31]. Внедрение методов прямого определения вируса в секретах и клетках эпителия респираторного тракта путем обнаружения вирусных антигенов непосредственно в клиническом материале расширило возможности верификации этиологически детерминированных вирусных инфекций. Для верификации диагноза герпесвирусной инфекции необходимо использовать комплекс методов лабораторной диагностики [32]. Молекулярно-генетические методы отличаются высокой чувствительностью и специфичностью, но генетический материал в виде фрагментов ДНК нежизнеспособных микроорганизмов может выявляться приблизительно в течение месяца после элиминации возбудителя [32]. Высокие циклы ПЦР-амплификации обычно детектируют субвирусные структуры персистирующих вирусов в латентном состоянии, то есть с низкой способностью к репликации [28]. Реакция иммунофлуоресценции выявляет вирусные антигены в ядрах мононуклеаров и эпителиоцитов слизистой оболочки и позволяет дифференцировать инаппарантные формы от реактивации [28].
Заключение
В традиционно проводимых культуральных исследованиях микробиоты зева по ассоциации конкретных бактериальных паттернов с формированием хронического лимфопролиферативного синдрома лор-органов у детей младшего возраста не получено согласующихся последовательных доказательств того, что какие-либо конкретные микроорганизмы способствуют развитию лимфоидной пролиферации и являются причиной заболевания. Однако, по некоторым данным, помимо ассоциированного с хроническим лимфопролиферативным синдромом лор-органов сниженного микробного разнообразия имеет место дисбиоз (или микробный дисбаланс): нарушенный микробиоценоз зева (бактериальная колонизация слизистой глотки условно-патогенными микроорганизмами в диагностически значимом количестве), обогащение золотистым стафилококком. Снижение микробного разнообразия и увеличение численности патогенных микроорганизмов могут способствовать развитию хронических воспалительных заболеваний пограничных к инфекции лимфоэпителиальных органов, прежде всего глоточной и небных миндалин.
Общим этиологическим агентом хронического лимфопролиферативного синдрома у детей младшего возраста является герпесвирусная инфекция. В предоперационном периоде у детей двух-трех лет с клинической картиной хронического лимфопролиферативного синдрома целесообразно верифицировать герпесвирусную инфекцию с использованием комплекса методов лабораторной диагностики. Речь идет о количественном ИФА, РИФ, ПЦР в режиме реального времени. Эти методы позволяют установить наличие инфицирования и степень активности индуцированного герпесвирусами инфекционного процесса. Для определения вирусных антигенов в секретах и клетках эпителия (мазках из зева) применяют метод флуоресцирующих антител, достоверно дифференцирующий фазы латенции (носительство) и репликации вируса. Этот метод отличается высокой чувствительностью и неинвазивностью, что особенно важно в педиатрии.
Авторы заявляют об отсутствии конфликта интересов.
E.V. Tyrnova, PhD, S.N. Larionova, M.V. Drozdova, PhD, Prof.
Saint-Petersburg Research Institute of Ear, Throat, Nose and Speech
Contact person: Elena V. Tyrnova, 7101755@mail.ru
Introduction. The etiology of chronic lymphoproliferative syndrome of ENT organs in the younger children has not yet been fully deciphered.
Aim. To assess the oropharyngeal microbiota role in the formation of chronic lymphoproliferative syndrome of ENT organs in the younger children.
Material and methods. Cultural bacteriological study of pharyngeal smears; serological and PCR analysis of EBV, CMV, HHV-6 markers of blood; PCR and immunofluorescence reaction with generic antiherpetic sera of the same name in scrapings of the pharyngeal mucosa were performed in 44 patients aged 2–3 years.
Results. In pharyngeal swabs, the growth of microorganisms of opportunistic and saprophytic microbiota was not detected in a diagnostically significant amount in 5.88% of children, an isolated growth of normal aerobic and/or facultative anaerobic microbiota was observed in 33.33% of children. Opportunistic microbiota was detected in 60.78% of cases, including associations of saprophytic microbiota and opportunistic microorganisms were detected in 29.41% of children. Most often, Staphylococcus aureus was detected in children (61.29%), known respiratory pathogens were found less frequently: Haemophilus influenzae 29.04%, Streptococcus pneumoniae 12.91%, Moraxella catarrhalis 3.23%. Streptococcus pyogenes group A was also isolated in 3.23% of cases. In the majority of patients (77.41%), one type of pathobiont was isolated. Infection with herpesvirus infections was found in 97.73% of children, including EBV 70.45%, HHV-6 54.55%, CMV 50.00%. Mixt infections dominated (62.79%), EBV infection prevailed among mono-infections (68.75%). The active stage of herpes virus infection was found in 63.64% of children, of which 64.29% were mixt infections. The most frequently detected signs of active EBV infection were 52.27%, HHV-6 reactivation was 18.18%, active CMV persistence was 6.82%. The active stage of herpesvirus infections was confirmed by the study of scrapings of the pharyngeal mucosa by immunofluorescence and PCR.
Conclusion. The traditional semi-quantitative study of cultures of bacterial colonies from samples of the pharyngeal biotope did not reveal a unified causative agent (pathogen) of chronic lymphoproliferative syndrome of ENT organs in the younger children.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.