Оценка сердечно-сосудистого риска у больных саркоидозом легких и артериальной гипертензией
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В открытом сравнительном одномоментном исследовании в параллельных группах участвовали 94 больных саркоидозом легких. Пациенты были разделены на две группы. Основную группу составили 46 больных АГ, группу сравнения – 48 больных без АГ. Проанализированы анамнестические данные, лучевые и функциональные параметры, оценены факторы риска АГ и сердечно-сосудистых осложнений в каждой группе, их суммарное влияние на общий сердечно-сосудистый риск.
Результаты. Индекс фатальных сердечно-сосудистых событий (индекс SCORE) у больных саркоидозом и АГ достоверно выше, чем у больных без АГ, – 6,9 ± 1,4 и 3,4 ± 0,8 соответственно; p < 0,05.
Выявлены показатели, ассоциируемые с высоким индексом SCORE: уровень систолического и диастолического артериального давления, частота сердечных сокращений, среднее давление в легочной артерии, толщина комплекса «интима – медиа», функциональные показатели DLCO и МСВ25. У пациентов основной группы зафиксированы факторы, влияющие на нарастание сердечно-сосудистого риска: пожилой возраст, семейный анамнез АГ, длительность табакокурения, высокая приверженность употреблению соли, ожирение, злоупотребление алкоголем. Формирование гипертрофии левого желудочка (увеличение массы миокарда левого желудочка, толщины межжелудочковой перегородки, толщины задней стенки левого желудочка) и повышение сосудистой жесткости (скорости пульсовой волны в аорте, индекса ригидности артерий) увеличивают риск сердечно-сосудистых осложнений.
Заключение. Градация сердечно-сосудистого риска у пациентов с саркоидозом на фоне АГ позволяет оценить прогноз легочного и сосудистого заболеваний, разработать индивидуальную программу их лечения.
Материал и методы. В открытом сравнительном одномоментном исследовании в параллельных группах участвовали 94 больных саркоидозом легких. Пациенты были разделены на две группы. Основную группу составили 46 больных АГ, группу сравнения – 48 больных без АГ. Проанализированы анамнестические данные, лучевые и функциональные параметры, оценены факторы риска АГ и сердечно-сосудистых осложнений в каждой группе, их суммарное влияние на общий сердечно-сосудистый риск.
Результаты. Индекс фатальных сердечно-сосудистых событий (индекс SCORE) у больных саркоидозом и АГ достоверно выше, чем у больных без АГ, – 6,9 ± 1,4 и 3,4 ± 0,8 соответственно; p < 0,05.
Выявлены показатели, ассоциируемые с высоким индексом SCORE: уровень систолического и диастолического артериального давления, частота сердечных сокращений, среднее давление в легочной артерии, толщина комплекса «интима – медиа», функциональные показатели DLCO и МСВ25. У пациентов основной группы зафиксированы факторы, влияющие на нарастание сердечно-сосудистого риска: пожилой возраст, семейный анамнез АГ, длительность табакокурения, высокая приверженность употреблению соли, ожирение, злоупотребление алкоголем. Формирование гипертрофии левого желудочка (увеличение массы миокарда левого желудочка, толщины межжелудочковой перегородки, толщины задней стенки левого желудочка) и повышение сосудистой жесткости (скорости пульсовой волны в аорте, индекса ригидности артерий) увеличивают риск сердечно-сосудистых осложнений.
Заключение. Градация сердечно-сосудистого риска у пациентов с саркоидозом на фоне АГ позволяет оценить прогноз легочного и сосудистого заболеваний, разработать индивидуальную программу их лечения.


Введение
По данным эпидемиологических исследований, в Российской Федерации свыше 47% мужчин и 43% женщин страдают артериальной гипертензией (АГ) [1]. АГ является ведущим фактором развития сердечно-сосудистых заболеваний: ишемической болезни сердца (ИБС), инфаркта миокарда, сердечной недостаточности, транзиторной ишемической атаки и ассоциируется с повышением риска смертности у 70% больных [2]. Более чем в трети случаев АГ протекает латентно и обнаруживается только в ходе объективного обследования пациента [3]. Распространенность саркоидоза в РФ составляет 8,2–51,4 на 100 тыс. населения [4]. Его клинические признаки неспецифичны, у 35% больных он выявляется случайно при плановом рентгенологическом обследовании [5]. АГ обнаруживается у 15,6–28,8% пациентов с саркоидозом легких и внутригрудных лимфатических узлов [6].
Длительное бессимптомное течение саркоидоза и АГ, высокий риск жизнеугрожающих событий при их сочетании подтверждают необходимость изучения взаимосвязи этих заболеваний [7].
Кроме общих патогенетических механизмов (гипоксическая вазоконстрикция, ремоделирование сосудов, эндотелиальная дисфункция, системное воспаление), задействованных в прогрессировании АГ, у больных саркоидозом к процессу присоединяются механизмы, характерные только для этого интерстициального заболевания. Имеются в виду облитерация микроциркуляторного русла вследствие паренхиматозного фиброза, внешняя компрессия легочных сосудов увеличенными лимфатическими узлами, сосудистая васкулопатия из-за поражения сосудистой стеки саркоидными гранулемами [8, 9].
По данным аутопсийных исследований, саркоидоз миокарда выявляется в 25,2% всех случаев саркоидоза [10, 11]. Гранулематозное воспаление и фиброз миокарда осложняются дилатационной кардиопатией и гипертрофией левого желудочка (ЛЖ) [12].
Ремодемирование ЛЖ сопровождается развитием нарушений сердечного ритма и хронической сердечной недостаточностью (ХСН) [13, 14]. На фоне эксцентрической или концентрической гипертрофии ЛЖ и ХСН возрастает вероятность фатальных сердечно-сосудистых событий [1–3].
У 22,1% больных саркоидозом регистрируются обструктивные изменения на дистальном участке бронхиального дерева и снижение диффузионной способности легких [15]. Функциональные нарушения часто сочетаются с гипоксемией и наблюдаются при рецидивирующем течении саркоидоза органов дыхания [16]. В условиях гипоксемии возрастает активность симпатоадреналовой системы. Гиперкатехоланемия, периферическая симпатическая вазоконстрикция усиливают проявления легочной и системной гипертензии, замыкая порочный круг патологических гемодинамических изменений [17].
Нежелательные явления стероидной терапии (гипергликемия, дислипидемия, морбидное ожирение) ограничивают физическую нагрузку и рассматриваются как факторы, утяжеляющие АГ у больных саркоидозом [18].
Модификация образа жизни (изменение режима питания, повышение двигательной активности, отказ от вредных привычек), а также своевременное обследование с выявлением субклинических ассоциированных состояний могут существенно замедлить прогрессирование этих заболеваний, улучшить эффект проводимых терапевтических вмешательств.
Цель – оценить сердечно-сосудистый риск у больных саркоидозом легких на фоне АГ.
Материал и методы
Проведен ретроспективный анализ историй болезни больных, находившихся на лечении в терапевтическом и кардиологическом отделениях Городской клинической больницы (ГКБ) № 24 (Москва) и пульмонологических отделениях Центрального научно-исследовательского института туберкулеза (ЦНИИТ) (Москва) с установленным диагнозом саркоидоза органов дыхания.
Были сформированы две группы пациентов. Основную составили 46 пациентов с саркоидозом легких и внутригрудных лимфатических узлов, а также АГ. В группу сравнения вошли 48 больных саркоидозом без АГ. Диагностика саркоидоза осуществлялась в соответствии с Национальными клиническими рекомендациями Российского респираторного общества [19]. Наличие АГ подтверждали на основании алгоритма обследования и лечения взрослых пациентов АГ, утвержденного профессиональной ассоциацией кардиологов РФ [12]. Диагностика ИБС, ХСН, хронического легочного сердца (ХЛС) проводилась по критериям диагностики этих заболеваний [20–22].
В исследование не включались пациенты с сердечной недостаточностью третьего и четвертого функционального класса NYHA, злокачественными новообразованиями, диффузными поражениями легких и внутригрудной лимфаденопатией, генез которых на момент скрининга не уточнен.
Протокол исследования одобрен локальным этическим комитетом ГКБ № 24 и ФГБУ ЦНИИТ. От каждого пациента получено письменное информированное согласие на участие в исследовании. Проведен анализ длительности легочного заболевания, болезней сердечно-сосудистой системы, ассоциированных клинических состояний. У больных оценивали индекс курения, рассчитывали индекс массы тела (ИМТ).
Каждый из обследованных был опрошен по стандартному вопроснику, разработанному на основании адаптированных международных методик и национального исследования ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний в Российской Федерации) [23, 24]. Вопросник построен по модульному типу и содержит сведения о демографических характеристиках, поведенческих привычках, анамнестических данных (наличие/отсутствие ассоциированных клинических состояний).
Поведенческие привычки включали приверженность избыточному потреблению поваренной соли: менее одной чайной ложки (5 г NaCl ) в сутки и более 5 г/сут, а также статус употребления алкоголя: высокое потребление этанола – более 168 г/нед для мужчин и более 84 г/нед для женщин и умеренное – 84–168 и 42–84 г/нед соответственно. Анамнестические данные составляли сведения о ранее перенесенных жизнеугрожающих событиях: в частности, инфаркт миокарда, транзиторная ишемическая атака, геморрагический инсульт; наличие ранее диагностированных сосудистых заболеваний – облитерирующего атеросклероза сосудов нижних конечностей, ретинопатии, сахарного диабета и др.
Всем больным выполнено лабораторное исследование: клинический и биохимический анализы крови (общий холестерин, холестерин липопротеинов высокой и низкой плотности, глюкоза, креатинин, мочевина, уровень газового состава крови). Скорость клубочковой фильтрации (СКФ) рассчитывали по модифицированной формуле MDRD (Modification of Diet in Renal Disease) [25]. С целью выявления субклинического атеросклероза проведено дуплексное сканирование сонных артерий с измерением толщины комплекса «интима – медиа» (ТКИМ). Суточный мониторинг артериального давления (АД) с измерением жесткости сосудистой стенки и центрального давления в аорте проводили с использованием диагностической системы BPLab МнСДП-2 Vasotens «Петр Телегин» (Россия). С целью исследования параметров центральной гемодинамики выполнена эхокардиография (ЭхоКГ).
При анализе изменений компьютерной томографии применяли полуколичественную шкалу оценки по E.A. Kazerooni. Фиброзирование очаговых образований, уплотнение стенок сегментарных бронхов и их ветвей, утолщение междолевых перегородок, участки консолидации, ретикулярные изменения, зоны паренхиматозно-интерстициального фиброза, деформация и фиброз корней легких трактовались как фиброзные изменения. Инфильтрация вокруг очагов, инфильтрация междольковых и внутридольковых перегородок; периваскулярная, перилимфатическая инфильтрация, участки «матового стекла» расценивали как инфильтративные изменения. Выраженность фиброзных и интерстициальных изменений оценивали по пятибалльной шкале [26].
Статистический анализ полученных результатов выполняли с помощью статистической программы SPSS, версия 22. Вид распределения данных определяли на основании критерия Колмогорова – Смирнова. Для описания выборки использовали медиану, первый и третий квартили. Две независимые выборки сравнивали с помощью критерия Манна – Уитни, две зависимые выборки – с помощью двустороннего Т-критерия Вилкоксона. Статистически значимыми считали различия при p < 0,05.
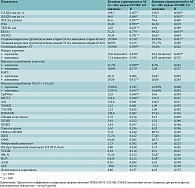
Демографические данные, поведенческие характеристики, а также анамнез заболеваний исследуемых больных представлены в табл. 1.
Группы не различались по возрасту, полу, в обеих группах преобладали женщины. При наличии АГ больные были старше, чем при ее отсутствии. Не зафиксировано различий по продолжительности легочного и сосудистого заболевания: у пациентов основной группы длительность саркоидоза легких практически совпадала с длительностью АГ. Проведена оценка факторов риска развития АГ и их влияния на стратификацию общего сосудистого риска: Systematic COronary Risk Evaluation (SCORE). Семейный анамнез АГ, пожилой возраст, мужской пол, длительный стаж табакокурения, ожирение, алкоголизм, избыточное потребление натрия являются предрасполагающими факторами развития АГ, независимо связанными с повышением АД. Старшую возрастную группу (более 55 лет для мужчин и 65 лет для женщин) составили десять больных саркоидозом с АГ и десять больных «изолированным» саркоидозом; то есть число пациентов в группах, соответствовавших критериям, было приблизительно одинаковым – 19,5 и 20,83% соответственно.
Семейный анамнез (наличие АГ у обоих родителей) достоверно чаще встречался у пациентов основной группы (р < 0,05). Индекс курения у больных АГ был выше, чем у больных «изолированным» саркоидозом; статистических различий между группами не зарегистрировано. Более трети больных основной группы (36,95%) злоупотребляли приемом поваренной соли. У пациентов группы сравнения злоупотребление поваренной солью регистрировалось реже – 29,16% случаев.
При анализе нутритивного статуса ИМТ был повышен у больных основной группы, статистических различий между группами не отмечено. Сахарный диабет у больных основной группы встречался достоверно чаще, чем у пациентов группы сравнения, – 8,69 и 4,16% соответственно (р < 0,05). Сахарный диабет, длительный стаж табакокурения, избыточная солевая нагрузка у больных АГ являются модифицируемыми факторами развития хронической болезни почек. Анамнестические сведения об этом заболевании имелись у 4,34% больных АГ и 2,07% пациентов с саркоидозом без АГ (р < 0,05).
Наблюдалась еще одна негативная поведенческая привычка, повышающая суммарный сердечно-сосудистый риск, – частый неконтролируемый прием крепких спиртных напитков. Не отрицал употребления высоких доз алкоголя каждый третий больной основной группы и каждый девятый – группы сравнения. Превышение дозы потребления алкоголя нередко приводит к недостаточному контролю АГ, поскольку употребляющие алкоголь недооценивают опасность осложнений и важность лечения. Лишь 77,08% больных саркоидозом и АГ систематически измеряли АД и регулярно использовали гипотензивные средства. Треть больных (22,9%) не выполняли назначения лечащего врача. Подобная тенденция отмечалась и при анализе терапии основного заболевания: 30,44% больных ассоциативной группы и 10,4% больных группы сравнения признались в нерегулярном приеме рекомендованных препаратов.
Анамнестические и демографические данные больных саркоидозом свидетельствуют о наличии состояний, ассоциированных с высоким сердечно-сосудистым риском. Повышение массы тела, табакокурение, негативные поведенческие привычки повышают чувствительность миокарда и артериальной стенки к ишемии. ИБС, ишемический инсульт, инфаркт миокарда в анамнезе статистически чаще регистрировались у пациентов основной группы. Изучение причин развития жизнеугрожающих событий у больных саркоидозом органов дыхания требовало проведения специализированного обследования. Результаты этого обследования отражены в табл. 2.
Проведена оценка факторов риска сердечно-сосудистой патологии у больных саркоидозом. Дислипидемия с повышением уровня общего холестерина > 4,9 ммоль/л и липопротеинов низкой плотности (ЛПНП) > 3,0 ммоль/л, нарушение гликемии натощак, тахикардия > 80 уд/мин являются доказанными факторами сердечно-сосудистого риска у больных АГ.
У пациентов основной группы отмечалось повышение значений общего холестерина, ЛПНП, уровня глюкозы крови, поскольку эти пациенты чаще страдали сахарным диабетом и ИБС. У больных «изолированным» саркоидозом влияние указанных факторов минимально, анализируемые показатели входили в диапазон нормы. Снижение СКФ можно рассматривать как независимый маркер сердечно-сосудистой заболеваемости и смертности, а усугубление нарушений функционального состояния почек часто сопровождается увеличением сердечно-сосудистого риска [25]. При анализе этого показателя у пациентов обеих групп выявлены статистически значимые различия по абсолютным значениям СКФ (р < 0,05).
Исследование функции внешнего дыхания регистрирует умеренные рестриктивные изменения (уменьшение жизненной емкости легких (ЖЕЛ)) и незначительные обструктивные нарушения (снижение объема форсированного выдоха за первую секунду (ОФВ1) и мгновенной скорости выдоха (МСВ25)) без достоверного различия между группами. У больных основной группы снижение ЖЕЛ объяснялось ретикулярными и фиброзными изменениями: уменьшение МСВ25 могло быть вызвано компрессией бронхов увеличенными медиастинальными лимфатическими узлами, саркоидным эндобронхиальным поражением, отеком слизистой оболочки мелких бронхов с нарушением их проходимости. Диффузионная способность легких (DLCO) была снижена у пациентов обеих групп с тенденцией большего снижения у больных АГ. Допустимо предположение, что уменьшение DLCO обусловлено гиперплазией гладкомышечных клеток и уплотнением субэндокардиального слоя сосудов.
О структурных изменениях артериол эластического типа свидетельствует увеличение ТКИМ. При сравнении ТКИМ отмечалось его небольшое превышение в группе сочетанной патологии, однако данные различия не были статистически значимыми. Не выявлено достоверных различий выраженности фиброзного и интерстициального компонентов по данным компьютерной томографии.
При исследовании параметров ЭхоКГ у больных саркоидозом обнаружены признаки легочной гипертензии и гипертрофии правых отделов сердца. Более выраженные изменения наблюдались у больных основной группы. Глобальная сократительная способность миокарда сохранена: фракция выброса у пациентов обеих групп в пределах нормальных значений. Гипертрофия левых отделов выявлена у 7 (15,2%) больных АГ: у них регистрировались утолщение межжелудочковой перегородки (1,12 ± 0,19 см) и задней стенки ЛЖ (1,13 ± 0,17 см). Увеличение индекса миокарда ЛЖ более 115 г/м2 и повышение индекса относительной толщины ЛЖ более 0,42 свидетельствовали об эксцентрической гипертрофии ЛЖ. Нарушения геометрии левых отделов сердца у пациентов группы сравнения не зафиксировано.
При анализе показателей суточного мониторирования АД уровень систолического АД (САД24) и диастолического АД (ДАД24) достоверно выше при наличии АГ. В то же время наблюдались более высокие среднесуточные показатели частоты сердечных сокращений. У пациентов этой группы зарегистрировано снижение проходимости мелких бронхов (уменьшение МСВ25). На фоне нарушений бронхиальной проходимости у больных АГ отмечается высокая вариабельность электрической активности сердца с повышением частоты сердечных сокращений и развитием аритмии [27]. Высказано предположение, что более высокие значения ЧСС в группе пациентов с АГ вызваны активацией симпатоадреналовой системы, обусловленной нарушением бронхиальной проходимости.
При оценке параметров жесткости сосудистой стенки оценочная скорость пульсовой волны в аорте (срPWao) превышала норму в обеих группах, но оказалась выше в группе АГ. Время распространения отраженной волны (RWTT) также было выше в группе с сочетанной патологией, без достоверного различия показателей между группами. Повышение срPWao и RWTT отражало снижение эластичности сосудистой стенки. О нарастании артериальной ригидности свидетельствовал анализ других показателей. У больных саркоидозом и АГ в отличие от пациентов группы сравнения достоверно выше индекс артериальной жесткости – 143,8 ± 4,8 и 126,5 ± 2,6 и амбулаторный индекс ригидности – 0,36 ± 0,04 и 0,24 ± 0,02 соответственно. Возможно, нарушение микроциркуляции альвеолярно-капиллярной мембраны и снижение диффузии газов через нее обусловлены изменением эластических свойств сосудистой стенки, что объясняет уменьшение показателя DLCO у исследуемых больных. Проведена суммация всех факторов риска пациентов обеих групп. Один фактор риска имели 6 (13,04%) больных основной и 10 (20,8%) пациентов группы сравнения, два фактора – 7 (15,31%) и 8 (17,39%) пациентов соответственно. Сочетание трех и четырех факторов отмечалось у 9 (19,56%) больных саркоидозом и АГ и 3 (6,25%) пациентов группы сравнения. Ни у одного из больных «изолированным» саркоидозом не наблюдалось сочетание трех или четырех факторов риска. Большая сумма факторов риска объясняет большую вероятность фатальных осложнений в ближайшие десять лет: индекс SCORE у больных саркоидозом и АГ – 6,9 ± 1,4, у пациентов с «изолированным» саркоидозом – 3,4 ± 0,8.
Обсуждение
Уровень АД – важный, но не единственный фактор, определяющий тяжесть АГ у больного саркоидозом, прогноз пациента и тактику лечения. Значение имеет также оценка общего сердечно-сосудистого риска, степень которого зависит как от величины АД, так и от наличия/отсутствия других факторов риска, ассоциированных клинических состояний. Повышенный уровень АД, факторы риска взаимно усиливают влияние друг друга, что приводит к увеличению степени сердечно-сосудистого риска, превышающего сумму отдельных его компонентов. Чтобы выявить взаимосвязь между индексом SCORE и результатами обследования, был проведен корреляционный анализ (табл. 3). У пациентов обеих групп были выявлены статистически значимые корреляционные связи между значениями индекса SCORE и показателями уровня САД и ДАД, частоты сердечных сокращений, среднего давления в легочной артерии, ТКИМ, а также с функциональными показателями: DLCO и МСВ25.
Результаты многоцентровых клинических исследований доказали ассоциацию этих параметров с высоким сердечно-сосудистым риском. Вариабельность АД с эпизодами повышения САД и ДАД, развитием пароксизмальных нарушений ритма увеличивает риск развития фатального инсульта на 41%, сердечно-сосудистой смерти – на 27%, кардиальной смерти – на 13% [28]. Развитие легочной гипертензии негативно влияет на течение саркоидоза органов дыхания. При повышении среднего давления в легочной артерии выше 31,7 мм рт. ст. выживаемость в течение пяти лет составляет только 58% [9, 19]. Бронхообструктивный синдром характерен для саркоидоза, не имеет строгой корреляции со стадией заболевания [29]. Проводя корреляцию уровня DLCO с показателями спирометрии, отечественные исследователи высказали мнение, что снижение диффузионной способности легких у пациентов с саркоидозом является следствием обструктивных изменений мелких бронхов и рестриктивных нарушений, вызванных фиброзом [30, 31]. Развитие значительных обструктивных и рестриктивных изменений может свидетельствовать о прогностически неблагоприятном течении саркоидоза [4, 29, 31]. Изменения ТКИМ у больного АГ проявляются гипертрофией и гиперплазией эндотелия и субэндотелиальных слоев, коррелируют с тяжестью АГ. Увеличение ТКИМ служит предиктором субклинического атеросклероза. Наличие атеросклероза повышает сердечно-сосудистый риск [32].
Средней силы корреляционная связь выявлена между SCORE и демографическими показателями (возраст, семейный анамнез АГ), модифицируемыми факторами (индекс курения, ИМТ), поведенческими характеристиками (солевая диета, злоупотребление алкоголем), а также с показателями ригидности сосудистой стенки и данными ЭхоКГ: толщиной межжелудочковой перегородки и задней стенки ЛЖ. У больных саркоидозом и АГ старшей возрастной группы (более 55 лет для мужчин и 65 лет для женщин) выявленная взаимосвязь имела высокую статистическую значимость и более высокий коэффициент корреляции, чем у больных младшего возраста. Аналогичная тенденция прослеживалась у пациентов с «изолированным» саркоидозом [28]. С возрастом изменяются гемодинамические показатели, определяющие уровень системного АД: уменьшается сердечный выброс из-за снижения сократимости миокарда ЛЖ и возрастает общее периферическое сопротивление из-за увеличения жесткости артерий эластического типа.
У пациентов основной группы линейный характер связи прослеживался между SCORE и семейным анамнезом АГ, что подтверждает зависимость сердечно-сосудистого риска от наследственной отягощенности. Изучение взаимосвязи индекса и модифицируемых факторов риска АГ выявило гендерные различия. При проведении статистического анализа установлена зависимость между интенсивностью курения, употреблением крепких спиртных напитков у мужчин и показателями массы тела, приверженности злоупотреблению солью у женщин.
Сигаретный дым оказывает цитотоксическое действие на эндотелий сосудов, активирует симпатоадреналовую систему и выработку вазоконстрикторных эндотелиальных факторов, способствующих стабилизации повышенного АД. Сведения о влиянии курения на течение саркоидоза противоречивы. По одним данным, саркоидоз среди курильщиков встречается не чаще, чем в общей популяции. В бронхоальвеолярном лаваже у курильщиков наблюдается меньшая выраженность лимфоцитоза и альвеолита, чем у некурящих [4]. По другим данным, курильщики, страдающие саркоидозом, имеют более низкие показатели функции внешнего дыхания, у них чаще регистрируются интерстициальные изменения и более высокий уровень нейтрофилов в бронхоальвеолярном лаваже [29]. Выявленная связь у пациентов основной группы имела большую статистическую значимость.
Злоупотребление алкоголем приводит к уменьшению чувствительности барорецепторов сосудов, нарушению центральной регуляции АД, повышает риск внезапной смерти [12, 33]. Значимость этой связи у больных АГ характеризовал больший коэффициент корреляции.
Вкусовые предпочтения пересаливать пищу чаще регистрировались у женщин основной группы, чем у мужчин. У больных «изолированным» саркоидозом это соотношение приблизительно одинаково. Бесконтрольное поступление натрия с пищей сопровождается увеличением объема внеклеточной жидкости, возрастанием сердечного выброса и повышением АД. Обнаруженная корреляционная взаимосвязь отражает повышение сердечно-сосудистого риска при избыточной солевой нагрузке.
Прибавка веса у больного АГ является самостоятельным фактором сердечно-сосудистого риска [28]. Повышение ИМТ чаще регистрировалось у женщин обеих групп, более выраженное увеличение ИМТ наблюдалось у пациенток с АГ. Выявление связи между сердечно-сосудистым риском и ИМТ подчеркивало значимость ожирения в увеличении сердечно-сосудистого риска у больных АГ.
Зафиксирована статистически достоверная связь между индексом SCORE и показателями жесткости сосудистой стенки (СрPWao, RWTT, АSI), а также показателями ЭхоКГ: индексом массы миокарда ЛЖ, толщиной межжелудочковой перегородки, толщиной задней стенки левого желудочка. Полученная связь отражает зависимость возрастания сердечно-сосудистого риска от увеличения показателей ригидности артерий и степени гипертрофии ЛЖ.
Значения индекса SCORE не имели корреляционных взаимосвязей с длительностью саркоидоза, показателями СКФ, глюкозы крови, липидного спектра, функциональными параметрами (ЖЕЛ, ОФВ1), фракцией выброса ЛЖ, результатами компьютерной томографии и показателями сосудистой жесткости (АASI, AIX).
Отсутствие статистически значимой корреляционной связи может быть обусловлено статистическими причинами, небольшой вариабельностью значения SCORE и показателей функциональных, инструментальных и лабораторных шкал. Возможно участие других факторов, связанных с субъективным восприятием количества употребляемой соли и выпитого алкоголя, нерегулярным мониторингом АД на амбулаторном этапе, что приводит к неверной трактовке данных показателей. Для исключения влияния этих факторов требуются разработка более сложной статистической модели и увеличение объема выборки.
Заключение
Пациенты с саркоидозом и АГ – контингент больных, с которым наиболее часто сталкивается практикующий врач. Нередко уровни САД и ДАД утрачивают свою главную роль и на первый план выходят другие факторы риска и ассоциированные клинические состояния. Градация сердечно-сосудистого риска у пациентов с саркоидозом в сочетании с АГ позволяет оценить прогноз легочного и сосудистого заболеваний, разработать индивидуальную программу их лечения.
Работа выполнена в рамках темы НИР № 0515-2019-00-14 «Совершенствование методов лечения гранулематозных, интерстициальных и неспецифических заболеваний легких».
A.V. Medvedev, PhD, A.F. Abubikirov, PhD, L.A. Mazaeva, PhD, N.N. Makaryants, PhD, N.M. Shmeleva, PhD, Ye.I. Shmelev, PhD, Prof.
Central Research Institute of Tuberculosis, Moscow
Contact person: Aleksandr V. Medvedev, alexmedved_1@mail.ru
The purpose: assessment of cardiovascular risk in patients with pulmonary sarcoidosis associated with arterial hypertension.
Study design: open-label, parallel-group, comparative, cross-sectional study.
Material and methods. 94 patients with pulmonary sarcoidosis are included in the study. Patients are divided into two groups. The main group consisted of 46 patients associated with arterial hypertension (AH), the comparison group – 48 patients without this association. Anamnestic data, data of radiation and functional parameters were analyzed, risk factors for AH and cardiovascular complications in each group were assessed, their total effect on the total cardiovascular risk.
Results. Index of fatal cardiovascular events (SCORE index) in sarcoidosis patients combined with arterial hypertension is significantly higher than in patients without this disease: 6.9 ± 1.4 and 3.4 ± 0.8; p < 0.05. The indicators associated with high SCORE were revealed: systolic and diastolic blood pressure, heart rate, mean pulmonary artery pressure, thickness of the ‘intima – media’ complex, functional indicators: DLCO and MSV25. In the main group, factors affecting the increase in cardiovascular risk were noted: elderly age, family history of hypertension, duration of tobacco smoking, high adherence to salt consumption, obesity, alcohol abuse. The formation of left ventricular hypertrophy (increased left ventricular myocardial mass, interventricular septum thickness, left ventricular posterior wall thickness) and increased vascular stiffness (aortic pulse wave velocity, arterial stiffness index) increase the risk of cardiovascular complications.
Conclusion. The gradation of cardiovascular risk in sarcoidosis patients combined with arterial hypertension makes it possible to assess the prognosis of pulmonary and vascular diseases, to develop an individual treatment program for this category of patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


