Патогенетическое обоснование применения высоких доз витаминов группы В при хронической спондилогенной дорсопатии
- Аннотация
- Статья
- Ссылки
Развитие остеохондроза может привести со временем к формированию грыжи диска. Так, межпозвонковый диск постепенно деформируется, теряет воду и смещается к периферии, формируя протрузию (выпячивание) в просвет позвоночного канала. Смещаясь в сторону позвоночного канала или межпозвонкового отверстия, грыжа может компримировать прилегающий спинномозговой корешок, что ведет к возникновению корешкового синдрома (радикулопатии). Компрессия корешка сопровождается формированием болевого синдрома, имеющего нейропатический характер. Повреждение корешка обусловлено не только его механическим сдавлением, но также и асептическим воспалением, отеком и демиелинизацией, в генезе которых определенная роль может принадлежать иммунным нарушениям.
Радикулопатия считается хронической, если продолжается более 4 недель и характеризуется моторными и сенсорными нарушениями в шее, руках и ногах, в зависимости от локализации поврежденного спинального корешка. Согласно данным масштабных исследований, у 80% пациентов боли проходят под влиянием лечения в достаточно короткий срок – от нескольких недель до месяца, однако у остальных 20% пациентов боли приобретают хронический характер [5]. В случае тяжелой или длительно существующей компрессии корешка при сдавлении кровоснабжающих его артерий возникает радикулоишемия, которая проявляется нарушением двигательных и чувствительных функций – так называемыми симптомами «выпадения». Может обнаруживаться снижение чувствительности в зоне иннервации пораженного корешка, угнетение или полное отсутствие сухожильных или периостальных рефлексов, мышечная гипотрофия или гипотония, вялые парезы.
Вследствие ряда особенностей клинического течения радикулопатий – прогрессирующего или хронического характера заболевания, резистентности к лечебному воздействию и склонности к рецидивированию, необходимость повторных госпитализаций данных больных сопровождается длительной утратой трудоспособности [1–3].
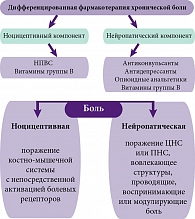
В зависимости от патофизиологических особенностей процесса, различают ноцицептивную и нейропатическую боль. Ноцицептивной считается боль, обусловленная действием конкретного повреждающего фактора (механическая травма, ожог, воспаление и т. д.) на периферические болевые рецепторы при сохранности всех отделов нервной системы. Под нейропатической подразумевается боль, возникающая при органическом поражении различных отделов нервной системы, участвующих в контроле боли. Крупные эпидемиологические исследования свидетельствуют о том, что у 20–35% пациентов с дискогенной радикулопатией преобладает нейропатический компонент имеющегося болевого синдрома [4, 6].
Механизм формирования хронической боли опосредуется афферентными сигналами от болевых рецепторов (ноцицепторов), расположенных в сухожилиях и фасциях спины, поступающими в спинной мозг через синапсы. Вырабатываемые в ответ провоспалительные цитокины (интерлейкины) и простагландины активируют интактные рецепторы, расположенные вне болевой зоны. Новые афферентные (восходящие) импульсы от интактных рецепторов вызывают повторную волну выброса медиаторов воспаления в нервных окончаниях. Особо следует отметить, что повышение возбудимости ноцицепторов вызывает рефлекторную активацию мотонейронов в соответствующих сегментах спинного мозга и сокращение иннервируемых ими мышц. Длительное напряжение мышц инициирует локальные механизмы нейрогенного воспаления. Появляются локусы болезненных мышечных уплотнений, усиливающие афферентный поток ноцицептивных импульсов в структуры ЦНС и, как следствие этого, возбуждается большее количество центральных ноцицептивных нейронов. Этот порочный круг играет важную роль в пролонгировании соматогенной боли и развитии хронических болевых синдромов. На месте пораженных воспалением аксонов со временем начинает разрастаться соединительная ткань, нарушается целостность миелиновой оболочки и замыкается порочный круг хронизации ноцицептивной боли в спине.
Эффективность лечения спондилогенной дорсопатии в значительной степени зависит от конкретных патогенетических механизмов. Комплексная патогенетическая терапия направлена на купирование болевого синдрома, устранение мышечно-тонических нарушений и миогенных триггерных зон, поддержание метаболических процессов.
В терапии нейропатической боли широко применяется медикаментозное лечение, включающее назначение антидепрессантов, противоэпилептических препаратов, опиоидных анальгетиков. Имеются данные об определенной эффективности витаминов группы В. На сегодняшний день отсутствует достаточное количество убедительных данных об эффективности применения консервативных немедикаментозных методов лечения (например, физиотерапии, физических упражнений, чрескожной электронейростимуляции).
В случае ноцицептивной боли эффективным является назначение нестероидных противовоспалительных препаратов (НПВП) и миорелаксантов. Длительность применения НПВП зависит от выраженности и продолжительности дорсопатии. При остро возникшей боли в спине бывает достаточно кратковременного (в течение нескольких дней) применения НПВП. При наличии интенсивной, особенно корешковой боли длительность лечения может достигать 3–4 недель. Одним из серьезных последствий приема НПВП является их негативное воздействие на желудочно-кишечный тракт с повышенным риском язвообразования. При нейропатической боли применение НПВП малоэффективно.
Повышение эффективности лечения как нейропатических, так и ноцицептивных болевых синдромов связано с высокими лечебными дозами витаминов группы В (В1, В6, В12), благодаря чему отчетливее проявляется анальгетический эффект. Патогенетически обоснованная терапия спондилогенной дорсопатии и радикулопатии должна включать не только подавление синтеза медиаторов воспаления, но воздействие, направленное на сохраненность целостности миелиновой оболочки нервного корешка. Применение нейротропных витаминов группы В – распространенный в клинической практике метод лечения больных с поражением периферической нервной системы, в том числе неврологическими проявлениями дегенеративных поражений позвоночника. Ранее традиционно использовался способ попеременного введения растворов тиамина (витамина В1), пиридоксина (витамина В6) и цианокобаламина (витамина В12) – по 1–2 мл внутримышечно с ежедневным чередованием каждого препарата – в течение 2–4 недель. Недостатками такой схемы лечения являются неэффективные дозы вводимых препаратов, необходимость частых болезненных инъекций, приводящая к низкому комплаенсу.
Появление трехкомпонентного нейротропного комплекса Мильгамма® и Мильгамма® композитум (Верваг Фарма ГмбХ, Германия) сделало возможным повысить приверженность пациентов назначенной терапии. Каждая ампула Мильгаммы® содержит по 100 мг тиамина, пиридоксина и 1000 мкг цианокобаламина, а также лидокаин, обеспечивающий местный анестезирующий эффект при внутримышечном введении препарата. Антиноцицептивное действие препарата объясняется угнетением локального синтеза медиаторов воспаления, а также модуляцией взаимодействия медиаторов с рецепторным аппаратом. Кроме того, цианокобаламин положительно влияет на процессы регенерации нервных волокон и миелиновой оболочки, что является одной из ключевых мишеней терапии хронической радикулопатии. Витамин B6 участвует в регуляции обмена ключевых нейромедиаторов и аминокислот, оказывает влияние на трофические процессы в нервной ткани: повышение синтеза протеинов под действием витаминов группы В создает условия для более успешной регенерации нервных волокон. Тиамин обеспечивает нормальную регуляцию углеводного обмена в периферической нервной ткани и также способен тормозить прохождение болевой импульсации на уровне задних рогов спинного мозга и таламуса [11–13].
В качестве поддерживающей терапии целесообразно проведение регулярных курсов лечения витаминами группы В. Учитывая нейротропное действие Мильгаммы®, препарат желательно применять как в остром, так и в хроническом периоде болевого синдрома. Пероральная форма препарата Мильгамма® композитум содержит бенфотиамин, который обладает высокой биодоступностью по сравнению с водорастворимой формой – тиамином. Также в состав препарата входит пиридоксин. Оба компонента взаимно усиливают нейротропное действие, способствуя восстановлению нарушенной чувствительности и сохранению структуры нервных волокон. Рекомендованная схема приема при спондилогенной дорсопатии включает в себя назначение инъекций Мильгаммы® на протяжении 10 дней с последующим переходом на пероральный прием драже Мильгамма® композитум в течение 14 дней.
В недавно законченном исследовании [7] было показано, что применение Мильгаммы® в составе комплексной терапии достоверно снижает интенсивность болевого синдрома, увеличивает двигательную активность больных, улучшает показатели качества жизни, в частности сон и эмоционально-аффективные проявления. Регулярное (не менее 2 раз в год) применение Мильгаммы® композитум препятствует хронизации болевого синдрома при радикулопатии.
В ходе другого исследования была подтверждена эффективность препарата у данного контингента больных и показан продолжительный эффект и после его отмены [10]. В исследование было включено 38 пациентов с умеренным или выраженным болевым синдромом на фоне радикулопатии (оценка по ВАШ не менее 4 баллов) и длительностью обострения не менее 1 месяца. В обеих группах исключался прием витаминов группы B в течение 2 месяцев. Первая группа включала в себя 19 пациентов, которым назначалась Мильгамма® и Мильгамма® композитум в сочетании с диклофенаком. Больные второй группы (19 пациентов) получали только диклофенак. Между группами не было достоверных различий по возрасту, полу, длительности заболевания, длительности обострения и интенсивности болевого синдрома. Диагноз радикулопатии выставлялся при наличии корешкового болевого синдрома и как минимум одного симптома выпадения (например, снижение соответствующего сухожильного рефлекса). Из терапии исключались физиотерапевтические методы лечения, рефлексотерапия и массаж. Пациенты первой группы получали следующую схему лечения: в первые 10 дней внутримышечные инъекции Мильгаммы® и диклофенака в дозе 75 мг в сутки с целью снижения выраженности болевого синдрома. В последующем для снижения риска возможных рецидивов пациенты получали Мильгамму® композитум по 1 драже 3 раза в день в течение 2 недель. В контрольной группе лечение ограничивалось применением только диклофенака, который также вводился внутримышечно в фиксированной дозе 75 мг в сутки, а далее назначался внутрь по потребности. Оценка состояния больных проводилась в момент включения в исследование, на 10‑й и 24‑й дни, а также через 3 месяца после окончания терапии. Использовались шкалы ВАШ, шкала вертебрального синдрома и невропатической боли, а также специально разработанный телефонный опросник, который включал в себя следующие пункты: выраженность болевого синдрома в пояснице, выраженность болевого синдрома в ноге и степень ограничения подвижности. Продолженную фазу (до конца 6‑го месяца) завершили 30 (79%) пациентов, из них 16 (84%) в основной группе и 14 (73%) в контрольной группе. Результаты исследования продемонстрировали лучшую динамику симптомов в основной группе пациентов. Так, к 10‑му дню суммарная оценка по ШБС (шкала боли в спине) в основной группе снизилась в среднем на 35%, в контрольной группе – на 30%, к 24‑му дню суммарная оценка по ШБС снизилась на 49% в основной группе, а в группе сравнения – на 43%. Оценка симптомов невропатической боли с помощью шкалы NPS показала, что только на фоне комбинированной терапии, включавшей Мильгамму®, по сравнению с исходным уровнем достоверно уменьшились такие характеристики боли, как интенсивность, острота и переносимость. Кроме того, на фоне комбинированной терапии, включавшей Мильгамму®, отмечены более значительный регресс симптомов натяжения и восстановление двигательных функций. При оценке по Шкале общего клинического впечатления на фоне применения комбинированной терапии, включающей Мильгамму®, на 10‑й день исследования значительный эффект отмечен у 6 пациентов (25%), в контрольной – только у 2 пациентов (10%). Следует отметить, что на эффективность терапии не влияли возраст, исходная интенсивность и длительность боли, наличие симптомов выпадения, выраженность болевого синдрома. Спустя 3 месяца болевой синдром в пояснице и/или ноге отсутствовал или был минимальным у 10 пациентов 1‑й группы (63% от числа завершивших 1‑ю фазу исследования) и у 7 (50%) пациентов 2‑й группы (p < 0,05). В ходе исследования отмечена высокая безопасность Мильгаммы®. Легкая диспепсия в виде тошноты и/или диареи, связанная с приемом диклофенака, была зафиксирована у 5 (10%) пациентов в контрольной группе и у 4 (5%) пациентов основной группы.
Полученные данные свидетельствуют о том, что достаточные дозы нейротропных витаминов в составе препаратов Мильгамма® и Мильгамма® композитум могут потенцировать обезболивающий эффект НПВС и способствовать более быстрому регрессу болевого синдрома у больных со спондилогенной дорсопатией и вертеброгенной радикулопатией. Результаты исследования свидетельствуют о высокой эффективности комплекса витаминов группы В при радикулопатии. Добавление к 10‑дневному курсу внутримышечного введения Мильгаммы® 14‑дневного курса перорального приема препарата Мильгамма® композитум способствует более полному проявлению терапевтического потенциала препаратов. И, наконец, полученные данные подтверждают эффективность комбинированного курса лечения Мильгаммой® не только в краткосрочной, но и в среднесрочной (3‑месячной) перспективе, что важно для предупреждения хронизации боли.
Таким образом, применение высоких доз витаминов группы В является эффективным при нейропатическом болевом синдроме, спондилогенной дорсопатии и дискогенной радикулопатии. Устранение боли – это, с одной стороны, подавление синтеза медиаторов воспаления в очаге повреждения, с другой – ограничение ноцицептивной импульсации из зоны повреждения в центральную нервную систему. Мильгамма® – нейротропный препарат, восстанавливающий структуру и функцию нервных волокон и обладающий анальгетическим действием. Фармакологические свойства препарата создают клинические предпосылки для его широкого применения у пациентов с нейропатической болью в спине. Особенно показан препарат пациентам с частыми обострениями радикулопатии. Рекомендуется повторять курсы терапии 2 раза в год, включая 10‑дневное назначение внутримышечных инъекций и последующий переход на пероральную форму – Мильгамма® композитум по 1 драже 3 раза в день в течение 2 недель.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.