Перекрестный синдром хронического гепатита С и аутоиммунного гепатита 1-го типа с последующей трансформацией в аутоиммунный гепатит 2-го типа: клиническое наблюдение
- Аннотация
- Статья
- Ссылки
- English


Аутоиммунный гепатит (АИГ) – хроническое воспалительное заболевание печени неизвестной этиологии, характеризующееся перипортальным или более обширным воспалением, протекающее со значительной гипергаммаглобулинемией и появлением в сыворотке аутоантител широкого спектра [1].
На основании профиля серологических маркеров различают два основных типа АИГ. При АИГ 1-го типа выявляются антинуклеарные антитела (АNА) и/или антитела к гладкой мускулатуре (АSMA), иногда в комбинации с антителами к растворимому печеночному и печеночно-панкреатическому антигенам (анти-SLA/LP). К 1-му типу относятся 80% всех случаев АИГ. Пациенты женского пола составляют 70%, пик заболеваемости приходится на возраст от 16 до 30 лет. АИГ 2-го типа характеризуется положительными антителами к микросомам печени и почек 1-го типа (анти-LKM-1) и/или антителами к печеночным цитозольным антигенам (анти-LC1, анти-LC3). Подавляющее большинство (80–96%) больных АИГ 2-го типа – дети. Выделяют также серонегативный АИГ, для которого типично отсутствие сывороточных аутоантител [2–4].
По данным наблюдательных исследований, сывороточные аутоантитела выявляются у 40–65% больных хроническим гепатитом С (ХГС). В отличие от аутоантител при АИГ обычно это поликлональные аутоантитела, титр которых чаще ниже диагностического; их присутствие в большинстве случаев не влияет на естественное течение болезни [5, 6], хотя и может ассоциироваться с ускоренным прогрессированием [7]. Вместе с тем в «интерфероновую» эру лечения ХГС признаки перекреста с АИГ служили основанием для предварительного подавления аутоиммунных реакций иммуносупрессорами [5, 8].
Пациентка П., 1985 г.р., в июне 2009 г. обратилась в поликлинику по месту жительства с жалобами на мигрирующие боли в крупных суставах и повышенную утомляемость. При обследовании выявлено четырехкратное превышение нормальных значений аланиновой трансаминазы (АЛТ) и аспарагиновой трансаминазы (АСТ), что послужило основанием для установки диагноза «хронический гепатит» и назначения препаратов гепатопротективного ряда. Ввиду отсутствия клинического и биохимического эффекта в июне 2009 г. пациентка обратилась к гастроэнтерологу; к этому моменту активность АЛТ повысилась до 244 ед/л, АСТ – до 203 ед/л (норма ≤ 40 ед/л). Тогда же впервые были выявлены антитела к вирусу гепатита С (HCV). С диагнозом «хронический гепатит С» больная была направлена в МОНИКИ им. М.Ф. Владимирского на консультацию к гепатологу.
Пациентка родилась и на тот момент времени проживала в Рязанской области. Образование среднее специальное, работает оператором в колл-центре. Не курит, алкоголь употребляет эпизодически. Из перенесенных заболеваний отмечает детские инфекции, периодонтит, тонзиллэктомию (1993 г.), аппендэктомию (2001 г.). Наследственность по заболеваниям печени не отягощена.
На момент осмотра больная предъявляла жалобы на утомляемость, транзиторную мигрирующую боль в плечевых, тазобедренных, коленных суставах. Состояние удовлетворительное. Телосложение нормостеническое, индекс массы тела (ИМТ) 24,8 кг/м2. Кожа и слизистые нормальной окраски, «печеночных знаков» нет. Лимфоузлы не увеличены. Над легкими везикулярное дыхание. Тоны сердца ритмичные, шумы не выслушиваются, артериальное давление (АД) 125 и 80 мм рт. ст., пульс 88 уд/мин. Живот при пальпации мягкий, безболезненный. Печень на 1 см ниже края реберной дуги, уплотнена. Селезенка не пальпируется.
Анализы крови (05.06.2009). Клинический анализ: Hb 117 г/л, эритроциты 4,9 млн/мкл, лейкоциты 5,5 тыс/мкл, тромбоциты 199 тыс/мкл, СОЭ 27 мм/ч. Основные биохимические тесты (N – норма): АЛТ 246 ед/л (6 N), АСТ 242 ед/л (6 N), гамма-глутамилтранспептидаза (ГГТ) 58 ед/л (N), щелочная фосфатаза (ЩФ) 33 ед/л (N), общий билирубин 1,4 мг%, прямой билирубин 0,9 мг%, общий белок 8,0 г%, альбумин 3,9 г%, протромбиновый индекс 97%. Электрофорез белков: альбумин 44,9 отн.%; глобулины: α1 3,9 отн.%, α2 11,3 отн.%, β 12,6 отн.%, γ 27,3 отн.%. Иммуноглобулины: IgA 239 мг%, IgM 125 мг%, IgG 2040 мг%. Аутоантитела: ANA 1:40, ASMA 1:160, анти-SLA/LP (+), анти-LKM-1 отр., антимитохондриальные М2 отр., антинейтрофильные антитела отр. Церулоплазмин, ферритин, α1-антитрипсин – N. Анти-ВИЧ отр., RW отр., HBsAg отр., HBV ДНК отр., анти-НСV (+), HCV РНК (+), генотип 1b, 96700 коп/мл.
Общий анализ мочи (05.06.2009): патологических изменений не выявлено.
Биопсия печени (11.06.2009) малоинформативна: в биоптате три портальных тракта; выявлены некровоспалительные изменения, соответствующие хроническому активному гепатиту.
Эластография печени (20.06.2009): 6,9 кПа (стадия фиброза F1 по METAVIR).
Подсчет диагностических баллов: по IAIHG 11 баллов – вероятный диагноз, по упрощенной системе 6 баллов – вероятный диагноз. Следует отметить, что установлению определенного диагноза АИГ препятствовало в первую очередь наличие HCV РНК.
Клинический диагноз (20.06.2009): хронический гепатит С, HCV РНК (+), генотип 1b, низкая виремия, с аутоиммунным компонентом (ANA 1:40, ASMA 1:160, SLA/LP (+)), с умеренной гистологической активностью и слабым фиброзом.
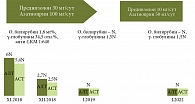
Учитывая, что на момент установления диагноза возможности терапии ХГС ограничивались применением стандартного или пегилированного интерферона α в комбинации с рибавирином, во избежание неблагоприятного при АИГ иммуномодулирующего действия интерферона было принято решение о подавлении аутоиммунного компонента иммуносупрессорами. С 01.07.2009 назначена терапия метилпреднизолоном 24 мг/сут и азатиоприном 100 мг/сут с последующей редукцией доз по общепринятой схеме [1, 3]. На фоне лечения наблюдалось постепенное снижение активности трансаминаз, сывороточных уровней билирубина и γ-глобулинов. При контрольном обследовании 28.12.2009 активность АЛТ составила 81 ед/л (2 N), АСТ – 62 ед/л (1,5 N), уровень общего билирубина 1,0 мг%, γ-глобулины 18,8 отн.% (рис. 1). По завершении первого этапа иммуносупрессоры были отменены, и с 03.01.2010 начата противовирусная терапия стандартным интерфероном α 3 MU трижды в неделю и рибавирином 1000 мг/сут. На фоне терапии наблюдались умеренная астенизация, снижение веса на 14 кг в течение года, выраженное выпадение волос; при этом клинически значимых отклонений лабораторных показателей отмечено не было. Были последовательно констатированы ранний вирусологический ответ (апрель 2010 г.), ответ на момент окончания 48-нельного курса терапии (декабрь 2010 г.) и, наконец, устойчивый вирусологический ответ (июль 2011 г.) (рис. 2). При очередном контрольном обследовании отмечены полная нормализация всех клинических и биохимических показателей, белковых фракций, исчезновение аутоантител. Результат контрольной эластографии печени от 11.07.2011: 4,9 кПа (стадия фиброза F0 по METAVIR). Полученные результаты позволили подтвердить ранее установленный диагноз и констатировать клиническое выздоровление.
Клинический диагноз (11.07.2011): состояние после противовирусной терапии хронического гепатита С в 2009 г. с достижением устойчивого вирусологического ответа, носительство антител к HCV.
Учитывая аутоиммунные проявления в анамнезе, было рекомендовано определение активности трансаминаз 1 раз каждые 6 месяцев с повторным обращением в случае их повышения.
В ноябре 2018 г. пациентка обратилась по поводу повышения сывороточных трансаминаз: АЛТ до 238 ед/л (6 N), АСТ до 214 ед/л (5,4 N). Лекарственные препараты на протяжении указанного периода не употребляла, алкоголь – не чаще двух раз в месяц в небольших количествах.
На момент осмотра жалоб нет. Состояние удовлетворительное. Телосложение нормостеническое, ИМТ 27,9 кг/м2. Кожа и слизистые нормальной окраски, «печеночных знаков» нет. Лимфоузлы не увеличены. Над легкими везикулярное дыхание. Тоны сердца ритмичные, шумы не выслушиваются, АД 130 и 80 мм рт. ст., пульс 84 уд/мин. Живот при пальпации мягкий, безболезненный. Печень на 2 см ниже края реберной дуги, плотная. Селезенка не пальпируется.
Анализы крови (17.11.2018). Клинический анализ: Hb 125 г/л, эритроциты 4,7 млн/мкл, лейкоциты 7,7 тыс/мкл, тромбоциты 204 тыс/мкл, СОЭ 33 мм/ч. Основные биохимические тесты: АЛТ 279 ед/л (7 N), АСТ 248 ед/л (6,2 N), ГГТ 55 ед/л (N), ЩФ 40 ед/л (N), общий билирубин 1,8 мг%, прямой билирубин 1,1 мг%, общий белок 8,3 г%, альбумин 3,9 г%, протромбиновый индекс 92%. Электрофорез белков: альбумин 42,4 отн.%; глобулины: α1 3,1 отн.%, α2 9,1 отн.%, β 10,9 отн.%, γ 34,5 отн.%. Иммуноглобулины: IgA 288 мг%, IgM 129 мг%, IgG 3015 мг%. Аутоантитела: ANA 1:20, ASMA отр., анти-SLA/LP отр., анти-LKM-1 1:640, антимитохондриальные М2 отр., антинейтрофильные отр. Церулоплазмин, ферритин, α1-антитрипсин – N. Анти-ВИЧ отр., RW отр., HBsAg отр., HBV ДНК отр., HCV РНК отр.
Общий анализ мочи (17.11.2018): патологических изменений не выявлено.
Эластография печени (25.11.2018): 8,8 кПа (стадия фиброза F2 по METAVIR).
Таким образом, в ноябре 2018 г. у больной имелись серологические признаки аутоиммунного гепатита 2-го типа.
Клинический диагноз (25.11.2018): аутоиммунный гепатит 2-го типа (анти-LKM-1 1:640) с умеренной биохимической активностью и умеренным фиброзом; состояние после противовирусной терапии хронического гепатита С в 2010 г. с достижением устойчивого вирусологического ответа; носительство антител к HCV.
С 26.11.2018 начата иммуносупрессивная терапия преднизолоном 30 мг/сут и азатиоприном 100 мг/сут с последующей редукцией. На 12.12.2018 активность АЛТ снизилась до 109 ед/л (2,7 N), АСТ до 100 ед/л (2,5 N); через 4 недели констатирована нормализация показателей. В то же время концентрация γ-глобулинов и IgG, заметно снизившись, сохранялась на уровне 1,5 N. Переносимость терапии была удовлетворительной, однако пациентка значительно прибавила в весе (ИМТ увеличился с 27,9 до 32,1 кг/м2), что сопровождалось повышением активности ГГТ до 2,5 N. Указанные изменения были расценены как вторичный стеатоз печени на фоне приема кортикостероидов. Соблюдение диеты и режима физических нагрузок, наряду с уменьшением дозы преднизолона, позволило снизить ИМТ до 28,5 кг/м2. Контрольная эластография печени (01.12.2019): 6,8 кПа – стадия фиброза F1 по METAVIR. С 24.12.2018 по настоящее время больная получает поддерживающую медикаментозную иммуносупрессию 10 мг преднизолона и 50 мг азатиоприна с сохранением биохимической ремиссии (рис. 3). Попытки дальнейшего снижения доз иммуносупрессоров ведут к росту активности трансаминаз.
В процессе анализа литературы нам не удалось найти убедительные доказательства возможности трансформации АИГ из одного серологического типа в другой. В то же время некоторые авторы предпочитают употреблять обобщающий термин АИГ, поскольку, по их мнению, между АИГ-1 и АИГ-2 недостаточно клинических, биохимических, гистологических и генетических различий [9]. Дополнительный интерес представляет тот факт, что в дебюте болезни у пациентки наблюдалось сочетание ХГС с лабораторными признаками АИГ 1-го типа: повышением уровня γ-глобулинов, IgG, ANA и ASMA в сочетании с положительными анти-SLA/LP. Как отмечалось выше, неспецифические аутоантитела часто встречаются у пациентов с ХГС, что в случае их высоких титров затрудняет дифференциальную диагностику с АИГ. S. Antonaci и соавт. предлагают выделение ложного и истинного синдрома перекреста ХГС и АИГ, при этом последний, встречающийся весьма редко, характеризуется набором диагностических критериев, достаточных для диагноза АИГ [6]. На основании оценки динамики течения заболевания у нашей пациентки можно констатировать истинный синдром перекреста.
До 2014 г. в лечении ХГС базисным препаратом был интерферон α, обладающий иммуномодулирующими свойствами. Периодически появлялись сообщения о развитии АИГ de novo или о его обострении в процессе или после интерферонотерапии [10, 11], в связи с чем логичным выбором являлся предварительный курс иммуносупрессоров, что и было предпринято в нашем наблюдении. Внедрение в клиническую практику препаратов прямого противовирусного действия позволило успешно излечивать большинство больных с перекрестным синдромом ХГС/АИГ [11–13]. Вместе с тем описаны случаи дебюта АИГ – истинного и лекарственно-индуцированного – во время и после лечения препаратами прямого действия [14–16]. В любом случае при наличии у пациента диагностических признаков АИГ необходим регулярный (1 раз в 3–6 месяцев) контроль активности трансаминаз, позволяющий своевременно диагностировать рецидив и инициировать либо возобновить иммуносупрессивную терапию.
A.O. Buyeverov, PhD, Prof., K.M. Roschina, O.S. Kuzmina, PhD, P. O. Bogomolov, PhD
I.M. Sechenov First Moscow State Medical University
M.F. Vladimirsky Moscow Regional Research Clinical Institute
Contact person: Aleksey O. Buyeverov, bcl72@yandex.ru
We present clinical case of patient with initially diagnosed chronic hepatitis C with an autoimmune component corresponding to type 1 autoimmune hepatitis. Considering that at the time of diagnosis, the therapeutic possibilities of hepatitis C were limited to the use of standard or pegylated interferon α in combination with ribavirin, in order to avoid the adverse immunomodulatory effect of interferon, we previously suppressed the autoimmune component with immunosuppressors. After 6-month course of prednisolone and azathioprine, antiviral therapy with interferon α and ribavirin was carried out with the achievement of sustained virological and biochemical response. After 7 years of complete virological, immunological and biochemical remission, the patient manifested autoimmune hepatitis type 2. The appointment of prednisolone and azathioprine led to a stable drug-induced remission.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.