количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
Переосмысление успеха терапии: лечение псориаза как системного заболевания
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Дерматовенерология и дерматокосметология" № 1 (4)
- Аннотация
- Статья
- Ссылки
Увеличение в структуре заболеваемости псориазом тяжелых форм, частое развитие сопутствующего псориатического артрита, приводящего к инвалидизации, значительное снижение качества жизни больных, развитие резистентности к терапии делают актуальным поиск новых высокоэффективных подходов к лечению данного заболевания. Современные возможности ингибиторов фактора некроза опухоли альфа в подавлении воспалительного процесса и повышении качества жизни пациентов со среднетяжелым и тяжелым псориазом обсуждали на симпозиуме «Переосмысление успеха терапии: лечение псориаза как системного заболевания», организованном при поддержке компании AbbVie. Мероприятие состоялось 25 октября 2013 г. в рамках VII Российской научно-практической конференции «Санкт-Петербургские дерматологические чтения».

Профессор Е.В. Соколовский

К.м.н. М.М. Хобейш
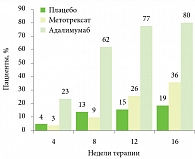
Рис. 1. Достижение индекса PASI 75 в исследовании CHAMPION
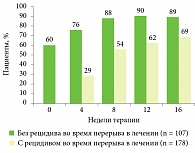
Рис. 2. Восстановление ответа на лечение препаратом Хумира® после перерыва в терапии (рецидив определен как PGA ≥ 3)

Профессор А.В. Самцов
Псориаз как системное заболевание. Оценка реального риска коморбидных состояний. Оптимальный подход к терапии
Псориаз относится к системным иммуноассоциированным многофакторным заболеваниям. В развитии псориаза доминирующая роль отводится генетическим факторам. Как отметил заведующий кафедрой дерматовенерологии с клиникой
ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, д.м.н., профессор Евгений Владиславович СОКОЛОВСКИЙ, системность заболевания проявляется не только в поражении кожи, ногтей, суставов, но и в наличии разнообразных метаболических нарушений, сопутствующих психологических расстройств, а в конечном итоге – в низком качестве жизни. Установлено, что ключевую роль в иммунопатогенезе псориаза играют фактор некроза опухоли альфа (ФНО-альфа) и интерлейкины 12, 17, 23.
Особое значение придается ФНО-альфа, определяющему развитие синовиального воспаления и остеокласт-опосредованной резорбции кости при артритах. С ФНО-альфа связано развитие коморбидных состояний при псориазе, таких как метаболический синдром, сердечно-сосудистые заболевания, когнитивные расстройства. Доказано, что при метаболическом синдроме риск возникновения сердечно-сосудистых заболеваний особенно высок у пациентов с тяжелым поражением кожи и активно прогрессирующим псориатическим артритом (ПсА). Это сказывается на продолжительности жизни: у пациентов с тяжелой формой псориаза риск смерти от сердечно-сосудистых осложнений возрастает на 50%[1]. Именно поэтому, назначая терапию конкретному пациенту, следует учитывать не только степень тяжести псориаза, но и коморбидный фон. Только такой подход позволяет рассчитывать на успех терапии.
Как известно, объем терапии при псориазе зависит от тяжести заболевания. Согласно Европейскому консенсусу при легкой степени тяжести бляшечного псориаза (BSA (Body Surface Area – площадь пораженной псориазом кожи), PASI (Psoriasis Area and Severity Index – индекс площади поражения и тяжести псориаза), DLQI (Dermatology Life Quality Index – дерматологический индекс качества жизни) ≤ 10) назначается топическая терапия, при средней или тяжелой степени (BSA, PASI, DLQI > 10) – системная[2].
Необходимо учитывать не только площадь и степень выраженности псориатического поражения, но и степень изменения качества жизни. Поэтому, если индексы BSA и PASI невысокие, а DLQI высокий, на фоне значимого ухудшения качества жизни псориаз следует оценивать как тяжелый. В этом случае назначают системную терапию.
В соответствии с международными и отечественными рекомендациями в качестве основных системных терапевтических средств при среднетяжелом и тяжелом течении псориаза применяются небиологические иммуносупрессивные средства, такие как метотрексат, циклоспорин А, синтетические ретиноиды, глюкокортикостероиды (ГКС), системная фотохимиотерапия, и биологические препараты. Небиологические иммуносупрессивные средства могут оказывать ряд побочных эффектов и ограниченны в применении из-за способности повышать атерогенный риск и даже индуцировать артериальную гипертонию.
Системные ГКС рассматриваются как средства скорой помощи для выведения пациентов из тяжелого состояния при острой псориатической эритродермии или генерализованном пустулезном псориазе. Для постоянного и длительного лечения пациентов с псориазом системные ГКС не подходят.
Современное целенаправленное лечение псориаза предполагает соблюдение терапевтических алгоритмов, регулярное отслеживание терапевтического ответа и своевременную модификацию лечения при неэффективности проводимой терапии или непереносимости системной терапии у больных со среднетяжелым и тяжелым псориазом. При неудовлетворительном ответе или непереносимости небиологической системной терапии необходимо пересмотреть лечение в пользу генно-инженерных биологических препаратов (ГИБП).
Генно-инженерные моноклональные антитела представляют собой новое концептуальное направление для патогенетической терапии среднетяжелого и тяжелого псориаза. Именно знание иммунопатогенеза псориаза позволяет применить таргетную терапию ингибиторами ФНО-альфа (адалимумаб), ингибиторами отдельных интерлейкинов и киназ, а также блокаторами рецепторов к отдельным интерлейкинам. Так, ингибирование ФНО-альфа при псориазе обеспечивает целенаправленное блокирование воспалительного процесса в коже и суставах и нормализует метаболические процессы, патологические отклонения которых ассоциированы с действием ФНО-альфа (атеросклероз, инсулинорезистентность и т.д.). Патогенетическая терапия ГИБП снижает риск коморбидного фона, в том числе метаболического синдрома. Данные ретроспективного когортного исследования продемонстрировали снижение риска развития сахарного диабета 2-го типа у пациентов с ревматоидным артритом и псориазом, получавших терапию ингибиторами ФНО-альфа[3].
Согласно Европейскому консенсусу 2010 г. системная терапия ГИБП показана пациентам со среднетяжелым и тяжелым псориазом при активно прогрессирующем поражении суставов и сочетании псориаза с коморбидными состояниями[2].
Достижение целей терапии псориаза в условиях реальной клинической практики. Десятилетний опыт применения препарата Хумира®
Аспектам эффективности и безопасности терапии адалимумабом, выпускаемым под торговым наименованием Хумира®, был посвящен доклад руководителя Центра генно-инженерной биологической терапии, доцента кафедры дерматовенерологии с клиникой ГБОУ ВПО «Первый СПбГМУ им. акад. И.П. Павлова», к.м.н. Марианны Михайловны ХОБЕЙШ.
Препарат Хумира® (адалимумаб) – это моноклональные антитела, полностью идентичные человеческим, специфически нейтрализующие растворенный и связанный с рецепторами ФНО-альфа, с периодом полувыведения в среднем 14 дней. Препарат Хумира® входит в проект российского стандарта специализированной, в том числе высокотехнологичной, медицинской помощи при тяжелых формах псориаза обыкновенного, резистентного к другим видам системной терапии. В настоящее время в мире свыше 742 тыс. пациентов получают лечение препаратом Хумира®. Препарат Хумира® назначается больным псориазом по следующей схеме: начальная доза в виде подкожной инъекции – 80 мг, затем по 40 мг 1 раз в 2 недели, начиная через неделю после введения первой дозы.
Преимущества препарата Хумира® заключаются в его низкой иммуногенности. Как известно, высокий титр аутоантител коррелирует с инфузионными реакциями и потерей эффективности[4]. Согласно результатам исследований, если на фоне монотерапии инфликсимабом аутоантитела появляются в 28% случаев, то на фоне монотерапии адалимумабом лишь
в 1,9–8,4%[5, 6]. Ни в одном из рандомизированных клинических исследований адалимумаба, включавших в общей сложности 36730,5 пациенто-лет, не было зарегистрировано ни одного случая тяжелой аллергической реакции[6].
Показания к применению препарата Хумира®:
- активный ПсА (в режиме монотерапии или в комбинации с метотрексатом либо другими базисными противовоспалительными препаратами);
-
хронический бляшечный псориаз (среднетяжелой и тяжелой степени), когда показана системная терапия или фототерапия и когда другие варианты системной терапии неоптимальны.
Доказано, что на фоне терапии адалимумабом (препарат Хумира®) у больных псориазом удается быстро достичь улучшения кожного процесса. Это подтвердили результаты двойного слепого рандомизированного плацебоконтролируемого исследования REVEAL[7]. Уже через 16 недель после начала лечения адалимумабом у 71% пациентов снижались проявления псориаза на 75% (PASI 75) по сравнению с 7% больных, принимавших плацебо, 45% пациентов достигали индекса PASI 90 и у 20% полностью отсутствовали проявления псориаза (PASI 100). Важно, что более 75% пациентов, ответивших на терапию, сохранили PASI 75 через 3 года после лечения. Не случайно в Европе и Америке адалимумаб наряду с инфликсимабом считается препаратом первой линии терапии у больных с тяжелым кожным поражением.
Эффективность адалимумаба в лечении псориаза существенно превышает таковую метотрексата (рис. 1). Согласно результатам исследования CHAMPION, через 8 недель терапии 62% пациентов в группе адалимумаба достигли PASI 75, в то время как в группе метотрексата такой эффект наблюдался у 9% пациентов. Через 16 недель данное соотношение составило 80/36%[8]. Это говорит о том, что адалимумаб (Хумира®) в 2–2,5 раза эффективнее снижает кожные проявления псориаза по сравнению с метотрексатом.
Доказано, что длительное лечение препаратом Хумира® позволяет контролировать течение основных симптомов ПсА. Активно подавляется воспалительный процесс в суставах, предотвращается развитие костно-деструктивных изменений. Как показали результаты исследования ADEPT, через 48 недель терапии препаратом Хумира® значительное улучшение симптомов ПсА
(ACR 50 (American College of Rheumatology – Американская коллегия ревматологов)) отмечалось у 43% больных. У 79% пациентов, получавших препарат Хумира® в течение 144 дней, отсутствовали рентгенологические признаки прогрессирования повреждений суставов[9].
Актуальным остается вопрос о состоянии кожного или суставного процесса в случае прекращения терапии, например, из-за сложностей с обеспечением пациентов препаратом. Как показали результаты исследования по восстановлению ответа на лечение препаратом Хумира® после 40-недельного перерыва в терапии, уже к 16-й неделе 89% пациентов без рецидива в период, когда терапия не проводилась, и 69% больных с рецидивом достигли очищения кожных покровов (PGA (Physician Global Assessment – глобальная оценка врача) 0 или 1)[10] (рис. 2).
Эффективность препарата Хумира® была продемонстрирована на собственном клиническом опыте М.М. Хобейш. 54-летний пациент, работавший шофером-дальнобойщиком, поступил в клинику с псориатической эритродермией тяжелой степени и мутилирующей формой активного прогрессирующего ПсА. Больному назначили лечение адалимумабом. Улучшение наступило уже через 2 недели терапии, а через 8 недель на фоне лечения адалимумабом удалось добиться значительного снижения индекса PASI на 90% и ACR на 50%. Пациент находился на лечении биологическим препаратом более года, после чего вернулся к активной трудовой деятельности. Через 9 месяцев он вновь пришел в клинику на консультацию. «Мы смогли убедиться в уникальных возможностях препарата. Пациент в течение 9 месяцев не получал терапию адалимумабом. Тем не менее синдрома отмены, которого мы всегда опасаемся, работая с метотрексатом, циклоспорином, ацетрином, не наблюдалось. К приему этого препарата всегда можно вернуться», – пояснила М.М. Хобейш.
В 2007 г. фармакологи признали препарат Хумира® лучшим биотехнологическим продуктом года (премия Галена (Prix Galien)). Он уже 10 лет присутствует на мировом фармацевтическом рынке (зарегистрирован в 89 странах), в том числе почти 7 лет – на российском. Среди ГИБП препарат Хумира® обладает одной из крупнейших доказательных баз: его эффективность и безопасность подтверждены результатами 71 международного клинического исследования по 6 показаниям с участием более 23 000 пациентов[11].
Эволюция целей терапии псориаза
Псориаз считается одним из наиболее распространенных заболеваний. Как сообщил заведующий кафедрой кожных и венерических болезней Военно-медицинской академии им. С.М. Кирова, главный дерматолог Министерства обороны РФ, д.м.н., профессор Алексей Викторович САМЦОВ, в развитых странах распространенность псориаза оценивается в 1,5–2%. При этом около 20% больных имеют среднетяжелую или тяжелую степень заболевания, около 30% страдают ПсА. Доказана связь псориаза с метаболическим синдромом, сердечно-сосудистыми заболеваниями, сахарным диабетом, что приводит к значительному ухудшению качества жизни больных. Поэтому «мозаика» успешной терапии складывается из достижения целей терапии – очищения кожных покровов (PASI 75), выявления коморбидных состояний и осуществление контроля над ними, удовлетворенности пациента лечением.
Безусловно, цели лечения крайне важны, поскольку позволяют выбрать оптимальный способ терапии и предупредить осложнения, связанные с неконтролируемой активностью заболевания. Эволюция целей лечения псориаза предполагает и эволюцию применяемых терапевтических методов – от топических препаратов, УФ-терапии и традиционной системной терапии к ГИБП, обеспечивающим пациентам с тяжелой формой псориаза контроль над системным воспалением. Согласно Европейскому консенсусу фаза индукции для системной терапии охватывает период от момента назначения до 16 недель лечения включительно, по окончании которой следует оценить эффективность проводимого лечения[2]. На протяжении всего периода после фазы индукции проводится поддерживающая терапия. Мониторирование состояния пациента и степени достижения поставленных целей лечения рекомендовано проводить каждые 8 недель.
Современная тактика ведения пациентов со среднетяжелым и тяжелым псориазом должна предусматривать междисциплинарный подход, то есть необходимо участие не только дерматолога, но также ревматолога, гастроэнтеролога и кардиолога. Роль ревматолога в данном вопросе трудно переоценить. Дело в том, что от 10 до 40% больных псориазом имеют ПсА, у 84% пациентов кожные проявления псориаза отмечаются в течение 12 лет до дебюта ПсА, 40–60% пациентов с ПсА страдают эрозивным и деформирующим артритом. Участие гастроэнтеролога обусловлено тем, что у 0,5% больных псориазом выявляется болезнь Крона, у 20% определяются высокие уровни кальпротектина в фекалиях, у 50–60% – неалкогольная жировая дистрофия печени. Без сомнения, псориаз связан с различными метаболическими нарушениями. Кардиолога не может не беспокоить тот факт, что у пациентов с тяжелой формой псориаза риск развития инфаркта миокарда в 2–3 раза выше, чем в целом в популяции. Продолжительность жизни таких больных сокращается на 3–4 года из-за сердечно-сосудистых осложнений. Именно терапия псориаза ингибиторами ФНО-альфа снижает риск развития сердечно-сосудистых осложнений.
«Таким образом, происходит переоценка целей терапии. Если старая парадигма подразумевала эффективность и безопасность лечения, то новая предполагает эффективность, безопасность и органопротекцию», – подчеркнул в заключение профессор
А.В. Самцов.
Заключение
Подводя итоги, председатель симпозиума, заведующий кафедрой дерматовенерологии с клиникой ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, д.м.н., профессор Евгений Владиславович СОКОЛОВСКИЙ заметил, что представленные докладчиками данные позволяют четко понять, что псориаз – системное заболевание, требующее единого междисциплинарного подхода к лечению. Особая роль в достижении контроля над воспалительным процессом и улучшении качества жизни пациентов принадлежит ингибиторам ФНО-альфа, в частности представителю последнего поколения генно-инженерных моноклональных антител препарату Хумира®. Солидная доказательная база и десятилетний опыт его применения дают все основания утверждать, что Хумира® – эффективный и безопасный биологический препарат для лечения хронического бляшечного псориаза и псориатического артрита.
1. Gelfand J.M., Troxel A.B., Lewis J.D. et al. The risk of mortality in patients with psoriasis: results from a population-based study // Arch. Dermatol. 2007. Vol. 143. № 12. P. 1493–1499.
2. Mrowietz U., Kragballe K., Reich K. et al. Definition of treatment goals for moderate to severe psoriasis: a European consensus // Arch. Dermatol. Res. 2011. Vol. 303. № 1. P. 1–10.
3. Solomon D.H., Massarotti E., Garg R. et al. Association between disease-modifying antirheumatic drugs and diabetes risk in patients with rheumatoid arthritis and psoriasis // JAMA.. 2011. Vol. 305. № 24. P. 2525–2531.
4. Thaçi D. Long-term data in the treatment of psoriasis // Br. J. Dermatol. 2008. Vol. 159. Suppl. 2. P. 18–24.
5. SPC Remicade, Jan 2012.
6. SPC Humira, Jan 2012.
7. Menter A., Tyring S.K., Gordon K. et al. Adalimumab therapy for moderate to severe psoriasis: A randomized, controlled phase III trial // J. Am. Acad. Dermatol. 2008. Vol. 58. № 1. P. 106–115.
8. Saurat J.H., Stingl G., Dubertret L. et al. Efficacy and safety results from the randomized controlled comparative study of adalimumab vs. methotrexate vs. placebo in patients with psoriasis (CHAMPION) // Br. J. Dermatol. 2008. Vol. 158. № 3. P. 558–566.
9. Mease P.J., Ory P., Sharp J.T. et al. Adalimumab for long-term treatment of psoriatic arthritis: 2-year data from the Adalimumab Effectiveness in Psoriatic Arthritis Trial (ADEPT) // Ann. Rheum. Dis. 2009. Vol. 68. № 5. P. 702–709.
10. Papp K., Crowley J., Ortonne J.P. et al. Adalimumab for moderate to severe chronic plaque psoriasis: efficacy and safety of retreatment and disease recurrence following withdrawal from therapy // Br. J. Dermatol. 2011. Vol. 164. № 2. P. 434–441.
11. Burmester G.R., Mease P., Dijkmans B.A. et al. Adalimumab safety and mortality rates from global clinical trials of six immune-mediated inflammatory diseases // Ann. Rheum. Dis. 2009. Vol. 68. № 12. P. 1863–1869.
Новости на тему
06.07.2022 13:00:00
07.12.2021
25.10.2021
27.07.2021
01.03.2021
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.