Перспективы применения Гепа-Мерц (L-орнитин-L-аспартат) для профилактики и лечения лекарственного поражения печени
- Аннотация
- Статья
- Ссылки



В современной онкогематологии достижение заметных успехов лечения стало возможным благодаря разработке новых подходов и интенсификации режимов химиотерапии. Однако негативной стороной химиотерапии остаются побочные эффекты противоопухолевых препаратов, обусловленные низкой селективностью действия большинства из них, что служит серьезным ограничением в достижении их максимального лечебного действия (2, 3). Для адекватного эффекта терапии необходимо осуществление целого ряда мероприятий, получивших название терапии сопровождения. Это обусловлено тем, что этиология, патогенез, клинические проявления развившихся осложнений, структура и методы их лечения у больных гемобластозами в условиях тяжелой иммуносупрессии, депрессии одного или нескольких ростков кроветворения имеют отличительные клинические черты: скоротечность, полиэтиологичность, однообразие клинических проявлений, выраженную тяжесть состояния, частое сочетание поражений органов и систем. Сегодня сопроводительная терапия является обязательной составляющей противоопухолевых протоколов. Данные обстоятельства способствовали рождению новой области гематологии – интенсивной терапии при гемобластозах, которая позволяет больному пережить тяжелые, но потенциально обратимые расстройства жизненно важных органов и систем на всех этапах лечения.
Хотя все врачи осведомлены о возможности развития гепатотоксических реакций на разнообразные препараты, в клинической практике диагноз лекарственного поражения печени формулируется неоправданно редко. Поскольку печень играет центральную роль во многих метаболических и иммунных процессах, при лекарственном воздействии на организм могут возникнуть серьезные, подчас необратимые изменения в клетках этого органа. Повреждение печени от субклинических форм до фульминантной печеночной недостаточности (ФПН) описано приблизительно для 1000 лекарственных средств (3, 4, 5, 6, 7). В последние годы наблюдается четкая тенденция к росту числа лекарственных поражений, вызванная постоянным расширением фармацевтического рынка. Так, в Японии за 30-летний период констатирован 11-кратный (!) рост лекарственной гепатотоксичности (1).
Особо сложную задачу для врача представляет то, что у пациентов, которым «причинный» препарат назначен по витальным показаниям, развивается лекарственная гепатотоксичность. В частности, это происходит при полихимиотерапии, антимикробной и антивирусной терапии при фебрильной нейтропении, сепсисе и т.д. В этих ситуациях, с одной стороны, отмена лечения невозможна из-за опасности прогрессирования основного заболевания, с другой – продолжение его нежелательно ввиду риска развития тяжелого гепатита. Кроме того, многокомпонентная терапия, представляющая собой комплекс потенциально гепатотоксичных субстанций, часто не позволяет конкретизировать вещество, вызвавшее патологическую реакцию.
Все нежелательные эффекты лекарственных средств на печень с патогенетической точки зрения можно подразделить на следующие: токсические; реакции гиперчувствительности (аллергические, псевдоаллергические, идиосинкразические).
Необходимо принимать во внимание, что в некоторых случаях механизмы повреждения печени могут сочетаться (5, 7, 8). Также известно, что у детей реакции на лекарства развиваются редко, за исключением существенного превышения дозы препарата. У пожилых людей выведение лекарств из организма замедляется из-за уменьшения объема печеночной паренхимы и снижения в ней интенсивности кровотока. Отмечено также, что лекарственные поражения печени чаще возникают у женщин.
Большое значение в патогенезе лекарственных поражений печени придается процессам биотрансформации, подразделяющимся на фазы (4, 5, 7, 8).
Фаза 1 включает метаболизм с участием системы микросомальной фракции гепатоцитов, монооксигеназ, цитохром-С-редуктазы и цитохрома Р450. Универсальным кофактором в этих системах служит восстановленный NADP.
Фаза 2 – биотрансформация, которой подвергаются лекарства или их метаболиты. Сущность данной фазы состоит в конъюгации упомянутых метаболитов с эндогенными молекулами – глутатионом, сульфатом или глюкуронидом с формированием нетоксичных гидрофильных соединений. При этом следует подчеркнуть, что ферментные системы, обеспечивающие эту конъюгацию, не являются специфичными для печени, однако обнаруживаются в ней в достаточно высокой концентрации.
Фаза 3 – активный транспорт биотрансформированных продуктов из печени в кровь или желчь и экскреция их с мочой.
Какова же тактика врача при поражении печени в процессе химиотерапии? Первый вопрос, который возникает у врача, – это вопрос об этиологии. Второй важный вопрос касается морфологических изменений, происходящих в печени при ее повреждении. Третий важный вопрос касается диагноза и включает детальное изучение субъективных симптомов и оценку результатов клинико-лабораторного обследования.
Терапия представляет собой четвертый и наиболее решающий вопрос. При лекарственной печеночной недостаточности оказываются угнетенными в той или иной степени все функции печени, но, как показывают клинические наблюдения, самым серьезным является нарушение ее детоксикационной способности (2, 9, 10). Особую роль в детоксикационных процессах играет группа связанных с глутатионом ферментов – глутатионтрансферазы, которые катализируют реакцию конъюгирования тиоловых групп глутатиона с токсическими веществами (11, 12). Существует несколько типов глутатионтрансфераз, среди которых основное значение имеют изоферменты АI, МI и PI, кодируемые соответственно генами GSTAI, GSTMI, GSTPI. Эти гены подвержены полиморфизму. Ферменты, кодируемые полиморфными аллелями, существенно различаются по активности и детоксикационной способности, что имеет большое значение для переносимости ПХТ (13). Центральным участком собственной системы детоксикации является цитохром Р450, с помощью которого осуществляется окисление большого числа лекарственных соединений, в том числе и цитостатиков. Система цитохрома Р450 представлена семейством гемопротеинов, которое расположено в эндоплазматической сети гепатоцитов. В настоящее время идентифицировано как минимум 55 изоферментов системы Р450, кодируемых отдельными генами. Лекарственный метаболизм обеспечивают цитохромы 3 семейств: Р450 I, II, III, каждый из которых способен метаболизировать несколько препаратов.
Существуют и иные механизмы повреждения печени при приеме лекарственных средств. К настоящему времени изучен механизм иммунной гепатотоксичности, когда лекарственное вещество или его метаболит может оказаться гаптеном для белков печеночной паренхимы и вызывает ее иммунное повреждение (14, 15).
Важное место в развитии печеночной токсичности отводится поражению клеточных мембран. Ведущее звено в патогенетическом механизме их функциональных нарушений принадлежит активации процессов свободного перекисного окисления липидов (СПОЛ), снижению антиоксидантной защиты и повышению активности лизосомальных ферментов (10, 16, 17).
Первый шаг к установлению диагноза лекарственного поражения печени – тщательный сбор информации о принимаемых препаратах, включая дозировку и длительность приема. Исключение вирусного, алкогольного, аутоиммунного гепатита и других патологических состояний требует выполнения комплекса лабораторных и инструментальных методов диагностики, при этом всегда необходимо помнить о возможности наложения действия лекарства на уже имеющееся заболевание печени.
Внедрение в клиническую практику прижизненной пункционной биопсии печени явилось важнейшим этапом формирования современных представлений в оценке патоморфологических изменений, развивающихся при патологических состояниях. Наиболее информативен динамический морфологический контроль. Однако число повторных биопсий печени, трудности морфологической оценки биоптатов в связи с очень небольшим объемом исследуемого материала, порой не характеризующим изменения органа в целом, в повседневной практике ограничено. Учитывая, что морфологическое исследование печени удается провести далеко не всем больным, анализ биохимических показателей, с определенной долей вероятности, позволяет уточнить уровень и ведущий механизм развития нарушений функции печени. В клинической практике именно измененные лабораторные показатели часто являются отправным пунктом для проведения дифференциальной диагностики и определения формы патологии печени. На основании лабораторных показателей можно судить о тяжести патологического процесса в печени, прогнозировать течение заболевания, а также оценить эффективность проводимой терапии.
Клинико-морфологические сопоставления позволяют констатировать диспропорционально выраженные патологические изменения по сравнению с удовлетворительным общим состоянием пациента и умеренными сдвигами стандартных печеночных тестов.
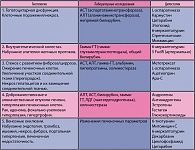
В таблице 1 приведены клинико-патогистологические варианты поражения печени, развивающиеся на фоне приема цитостатиков (18).
Согласно рекомендациям ВОЗ, различают 5 степеней интенсивности побочного действия противоопухолевых препаратов, в том числе проявлений гепатотоксичности от 0 (отсутствие проявлений) до 4 (печеночная кома). С учетом этого разработана следующая корректировка доз цитостатиков в зависимости от сохранности функции печени:
- уменьшение дозы антрациклинов на 50%, прочих цитостатиков на 25% при повышении уровня общего билирубина в 1,26-2,5 раза, трансаминаз – в 2-5 раз;
- снижение дозы антрациклинов на 75%, прочих цитостатиков – на 50% при повышении уровня общего билирубина в 2,6-5 раз, трансаминаз – в 5,1-10 раз.
При сохраняющемся дальнейшем отклонении лабораторных показателей от нормального уровня рекомендуется прекращение противоопухолевой терапии.
Для оценки степени и глубины повреждения гепатоцитов обычно применяют клинико-биохимические исследования:
- целостности клетки,
- экскреторной активности и холестаза,
- функциональной способности печени,
- мезенхимальной активности,
- иммунной реакции.
Для оценки целостности клетки во многих клиниках и поликлиниках используются рутинные традиционные энзимные тесты, показатели обмена билирубина и белковые пробы. Сывороточные энзимные тесты – высокочувствительные индикаторы цитолиза гепатоцитов, что определяет их роль в первичной диагностике острых гепатитов разной этиологии. Определение активности АлАт многие авторы характеризуют как беспункционную биопсию печени. Повышение активности всех трансаминаз рассматривается как очень чувствительный показатель степени повреждения клеток печени. Параллельное определение 2 энзимов позволяет полнее оценить происхождение гиперферментемии. Обычно рассчитывается коэффициент АсАт:АлАт, в норме близкий к 1. Его снижение менее 0,7 дополнительно подтверждает печеночный, а повышение более 1,3 – непеченочный генез гиперферментемии. Особенно значительное снижение этого коэффициента рассматривают как индикатор тяжелого повреждения печени. Ценность энзимных тестов состоит в том, что они являются, по существу, наиболее ранними критериями постановки синдромного диагноза острого поражения печени.
При развитии печеночной недостаточности поврежденные клетки печени отвечают структурным изменениям паренхимы и мезенхимальной ткани, а клинические симптомы часто характеризуются интоксикацией и желтухой различной степени выраженности. Параметры экскреторной способности и холестаза определяют степень повреждения паренхимы печени. Показатели обмена билирубина существенно дополняют клиническую оценку желтухи. Более информативны результаты раздельного количественного определения в крови свободной и связанной фракций билирубина. В качестве информативного параметра степени повреждения паренхимы печени может быть рассмотрен также билирубиновый показатель (БП), характеризующий отношение связанной фракции билирубина к его общему содержанию. Билирубиновый показатель при вирусных гепатитах достигает 50-60%, в то время как в физиологических условиях связанная фракция отсутствует или ее содержание не превышает 20-25%. Важно отметить, что уробилиногены могут быть обнаружены в моче еще до появления желтухи, исчезновение в кале стеркобилина сигнализирует о начале фазы ахолии. Динамический контроль показателей обмена билирубина имеет первостепенное значение как в дифференциальной диагностике желтух разного типа, так и для характеристики холестатического синдрома.
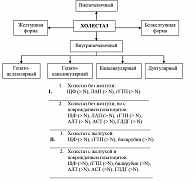
Холестаз может иметь самое разное происхождение. Прежде всего, это понятие функциональное, характеризующее нарушение оттока желчи. Соответственно, в печени и в крови накапливаются не только желчные пигменты (билирубинглюкурониды), как при желтухах цитолитической природы, но и другие компоненты желчи – желчные кислоты, холестерин, экскреторные ферменты (ЩФ, лейцинаминопептидаза – ЛАП, гамма-глютаминотранспептидаза – гамма-ГТ), а при длительном холестазе и медь (рисунок 1).
В зависимости от степени выраженности, цитолиз гепатоцитов может протекать с желтухой и без желтухи. Необходимо дифференцировать внутри- и внепеченочный холестаз. Внепеченочный холестаз обусловлен обтурацией желчных внепеченочных путей. Более сложен и вариабелен патогенез внутрипеченочного холестаза, лежащего в основе холестатического гепатита. При вирусных гепатитах холестаз возникает в результате нарушения секреторной функции печеночных клеток (гепатоцеллюлярный холестаз), причем всегда в сочетании с цитолизом. Появление желтухи само по себе еще не свидетельствует о развитии холестаза. Существенно реже признаки холестаза выявляются при безжелтушных формах печеночной недостаточности. Критерием холестаза в этом случае служат данные УЗИ печени, подтверждающие наличие расширенных желчных протоков. Уточнение преобладающего патологического механизма (цитолиза или холестаза) весьма важно для обоснования плана лечения больного, выбора наиболее рациональных терапевтических средств. Если эти процессы нарушения метаболизма печени не корригировать, то развивается некробиотический процесс, срыв репаративных процессов, что приводит к нарушению функции органа и организма в целом.
Исследования функции печени. При обширных повреждениях паренхимы печени (например, при фульминантной печеночной недостаточности) в патологический процесс вовлекаются и такие структуры, как шероховатый эндоплазматический ретикулум. Вследствие этого снижается синтез почти всех белков плазмы. Снижение уровня альбумина, холинэстеразы (ХЭ) и факторов свертывания в плазме имеет большое диагностическое значение. Гипоальбуминемия и увеличение активности ХЭ могут сопутствовать хроническим заболеваниям печени. Это также является отражением степени изменения клеток печени.
Исследование мезенхимальной активности проводится с помощью определения уровней гамма-глобулинов, иммуноглобулинов и проколлаген-III-пептида. Хронические заболевания печени обычно сопровождаются повышением уровней как гамма-глобулинов, так и иммуноглобулинов А, G, М. Кроме того, иммуноглобулинемия указывает на аутоиммунные процессы в печени.
Оценка иммунной реакции используется для дифференциального диагноза и оценки течения нарушений функции печени.
С целью подтверждения результатов различных клинических и биохимических исследований может быть использован целый ряд технических диагностических методов, таких как компьютерная томография (КТ), сцинтиграфия печени, ультразвуковая эхография. Для оценки поверхности и структуры печени особое значение имеют лапароскопия и биопсия печени.
В большинстве случаев острых лекарственных поражений печени отмена «причинного» препарата – достаточное условие для обратного развития патологических изменений, что обусловливает особую важность точного дифференциального диагноза. Хронические поражения печени при отмене вызвавшего их препарата также нередко редуцируют или, по крайней мере, останавливаются в развитии, в связи с чем их прогрессирование диктует необходимость проведения тщательного дополнительного обследования с целью исключения других этиологических факторов. Задача врача существенно осложняется при развитии ФПН.
Своевременное распознавание и устранение провоцирующих факторов печеночно-клеточной недостаточности уменьшает риск развития печеночной энцефалопатии (ПЭ), которая определяет потенциально обратимое нарушение функции головного мозга, возникающее как у больных с хроническими заболеваниями печени, так и у пациентов с фульминантным острым гепатитом. Предложены многочисленные гипотезы, объясняющие патогенез печеночной энцефалопатии. В числе факторов, способствующих ее развитию, называют:
- эндогенные нейротоксины (аммиак, жирные кислоты, фенол, меркаптан);
- неправильные нейротрансмиттеры (октопамин);
- изменение нормальных нейротрансмиттеров и их рецепторов (GABA, серотонин) – повышенная чувствительность рецепторов GABA-бензодиазепина.
Аммониегенная теория ПЭ является в настоящее время наиболее обоснованной. Диагноз ПЭ устанавливают на основании клинических симптомов и клинико-лабораторных нарушений функции печени. Степень выраженности нейропсихических симптомов ПЭ колеблется от I – легкая до IV – глубокая кома. Эти симптомы определяются клинически и включают изменения сознания, интеллекта, поведения и нейромышечные нарушения.
Необходимо подчеркнуть особую важность своевременного распознавания и лечения латентной печеночной энцефалопатии (ЛПЭ). Клиническая значимость ЛПЭ объясняется двумя причинами. Во-первых, ЛПЭ может быть стадией, которая является предвестником последующего развития клинически выраженной печеночной энцефалопатии. Во-вторых, психомоторные нарушения, обнаруживаемые при ЛПЭ, оказывают отрицательное влияние на качество жизни пациентов. Согласно результатам последних исследований, распространенность ЛПЭ варьирует от 30% до 84% (6, 14, 19).
Таким образом, патогенетические механизмы повреждения печени весьма многообразны, однако все они характеризуются клеточным повреждением, сопровождающимся воспалительной реакцией, цитолизом и развитием фиброза. Подобный сценарий развития патологического процесса, правда, с разным инициирующим механизмом на старте, может развиваться при вирусных гепатитах, токсическом повреждении печени, аутоиммунном гепатите, метаболическом синдроме и других формах острого и хронического повреждения печени. При этом очевидно, что во всех упомянутых случаях центром органопатологии остается гепатоцит – основная клетка печеночной паренхимы. Для вирусных гепатитов на данный момент разработана этиотропная терапия, способная оказывать и патогенетическое воздействие. В большинстве других случаев повреждения печеночной паренхимы доказательной базы в отношении эффективности применения различных групп лекарственных средств, претендующих на роль «спасителя гепатоцита», пока не сложилось.
Успех лечения лекарственных поражений печени определяется возможностью распознавания этиологического фактора и ведущего патогенетического механизма его развития, а также адекватно подобранной терапии.
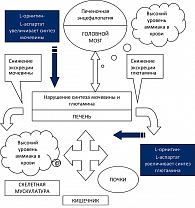
Как отмечалось выше, врач нередко сталкивается с ситуацией, когда отмена гепатотоксичного препарата невозможна без создания непосредственной или отсроченной угрозы для жизни пациента. В данных случаях целесообразным представляется назначение лекарственных средств, обладающих защитным действием на клетки печени. С этой точки зрения к числу эффективных препаратов относится Гепа-Мерц® (L-орнитин-L-аспартат) (рисунок 2).
Медикаментозное лечение с применением только одного лекарственного препарата не представляется возможным, поскольку нарушения метаболических функций печени чрезвычайно сложны.
Лечение ПЭ осуществляется по ступенчатой схеме (20):
- установление и устранение факторов, способствующих развитию печеночной энцефалопатии;
- диетические мероприятия у больных с ПЭ, которые ограничивают поступление белка с пищей, тем самым уменьшая образование аммиака в толстой кишке. Это снижает степень выраженности гипераммониемии. Энергетическая ценность пищи должна обеспечивать не менее 1500 ккал/день, что способствует подавлению процессов катаболизма и также снижает выраженность гипераммониемии. Уменьшению образования аммиака в мышцах способствует и назначение пациенту постельного режима;
- медикаментозная терапия. Это препараты, уменьшающие образование и абсорбцию аммиака и других токсинов, образующихся в толстой кишке:
- лактулоза (Дюфалак) 10-30 мл 3 раза в сутки или Лактитол 0,3-0,5 г/кг в сутки. Дозу подбирают индивидуально. Оптимальной считают дозу, при назначении которой достигается мягкий стул 2-3 раза в сутки (25, 27, 28);
- антибиотики (Рифаксимин, Ципрофлоксацин, Метронидазол). Эффективность антибиотиков сходна с таковой лактулозы. Кроме того, антибиотики быстрее купируют симптомы ПЭ и лучше переносятся, чем лактулоза. Существенным недостатком лечения антибиотиками является ограниченная продолжительность их применения (5-7 дней);
- препараты, улучшающие образование аммиака в печени – Гепа-Мерц® (L-орнитин-L-аспартат) (19, 23, 24). В таблице 2 представлена схема применения препарата Гепа-Мерц®.
Гепа-Мерц® (L-орнитин-L-аспартат) является препаратом, воздействующим на определенные звенья нарушенного печеночного метаболизма и патогенеза печеночной энцефалопатии (рисунок 2). Установлено несколько механизмов гипоаммониемического действия L-орнитин-L-аспартата:
- орнитин стимулирует в перипортальных гепатоцитах карбамилфосфатсинтетазу – основной фермент синтеза мочевины;
- аспартат стимулирует в перивенозных гепатоцитах, мышцах и головном мозге глутаминсинтетазу;
- орнитин и аспартат сами являются субстратами цикла синтеза мочевины. (2, 23, 25, 26, 27).
В отделении химиотерапии гемобластозов РОНЦ им. Н.Н. Блохина РАМН проведены исследования биохимических процессов, происходящих в организме не только при опухолевом росте, но и при противоопухолевых воздействиях (при полихимиотерапии). В схемы интенсивной терапии при развившейся печеночно-клеточной недостаточности был включен препарат Гепа-Мерц® (L-орнитин-L-аспартат).
Результаты собственных исследований и их обсуждение
Изучена эффективность действия препарата Гепа-Мерц®. Лечение проведено 44 больным гемобластозами с печеночно-клеточной недостаточностью и печеночной энцефалопатией. Внутривенно капельно препарат назначался в дозе 10-20 г однократно в сутки в течение 8-14 дней (в дни кондиционирования и в период после химиотерапии) при ПЭ. Применялся следующий режим. При ПЭ первой и второй стадий: 1 этап – 7 дней по 20 г в день, 2 этап – семь дней по 10 г в день. Затем больному рекомендовался пероральный прием препарата в дозе 9-18 г/сут. дважды или трижды в день на протяжении 2-4 недель и более.
Были изучены и проанализированы биохимические показатели, связанные с метаболизмом клетки: процессы перекисного окисления липидов (ПОЛ), содержание оксида азота (NO), нарушение детоксикационной способности печени по содержанию глютатиона и активности глютатион-S-трансферазы. Все исследования проведены также в контрольной группе, которую составили 60 практически здоровых людей. Их показатели приняты за норму. Биохимические методы исследования представлены в таблице 3. Проводился мониторинг уровня трансаминаз, ГГТП, ЩФ, содержания билирубина в сыворотке крови.
Для объективизации психоневрологических изменений ПЭ применялся тест связи чисел (33, 34).
Этапы исследования:
- функциональные нарушения печени до лечения препаратом Гепа-Мерц®;
- период восстановления функциональной способности печени.
Статистический анализ результатов исследования выполнен при помощи программы «Statistica 6» непараметрическим методом с использованием в зависимых группах критерия Вилкоксона, в независимых группах – U-критерия Манна-Уитни.
В результате проведенных исследований у 75% больных по выполнению теста связи чисел определена клинически выраженная ПЭ (I-III ст.), у 25% пациентов – латентная ПЭ (ЛПЭ). Выявлена прямая корреляционная зависимость между степенью тяжести проявлений печеночной недостаточности и глубиной нарушений системы глутатиона (снижением содержания Г и возрастанием активности ГТ).
Эффективность лечения зависела от исходной степени тяжести ПЭ. Нормализация показателей психометрических тестов отмечена у 50% больных. У остальных пациентов время выполнения психометрических тестов сократилось на 50-80% по сравнению с исходными параметрами.
При анализе изученных показателей у всех больных при развившейся печеночной недостаточности обнаружены нарушения метаболических процессов (таблица 4).
Исследования ферментативной системы антиоксидантной защиты показали повышение содержания СОД в 3 раза (р < 0,01) по сравнению с нормой. Изменения, связанные с процессами пероксидации, сопровождались накоплением токсических продуктов. В частности, исследование содержания МДА свидетельствует, что у большинства больных (75%) уровень этого метаболита в 1,5-1,8 раза выше, чем в норме (р < 0,01). Имеются многочисленные публикации, указывающие на повышение содержания МДА как промежуточного продукта свободнорадикального окисления при интенсификации окислительного стресса, что способствует развитию эндогенной интоксикации организма. Выявленные корреляции между повышением содержания МДА и степенью интоксикации организма позволили ученым предложить такой термин, как индекс присутствия реактивных разновидностей кислорода, а МДА назвать маркером липидной пероксидации и маркером повреждения тканей (35).
При исследовании содержания оксида азота оказалось, что в сыворотке крови большинства обследованных больных (68,1%) при лекарственной гепатотоксичности его содержание достоверно повышено. Установлено, что NО, продуцируемый NO – синтазой (NOS), функционирует в биосистемах как высокоэффективный регулятор метаболизма. При ряде физиологических и патофизиологических воздействий, влияющих на печень, в гепатоцитах экспрессируется ген индуцибильной NO-синтазы. Индуцированный в печени синтез NO существенным образом влияет на функции гепатоцитов. Кроме того, NO играет важную роль в регуляции патофизиологических механизмов развития эндотоксикоза, инициируя образование активированных кислородных метаболитов при окислительном стрессе (36) Это сопровождается накоплением токсических продуктов пероксидации и повышением уровня МДА в организме. Вместе с тем при сравнительном анализе изучаемых показателей оказалось, что одновременно с высоким уровнем NO в сыворотке крови этих больных значительно повышено содержание СОД, что указывает на существенные расстройства регуляторных процессов свободно-радикального окисления. Эти изменения отражаются на состоянии детоксикационной системы организма онкологического больного.
Исследования показателей системы глутатиона для оценки степени эндотоксикоза вызывают особый интерес. Участвуя в обезвреживании перекисей и гидроксильных радикалов, глутатион оказывает непосредственное влияние на развитие окислительного стресса, выступая эффективной ловушкой свободных радикалов (35), играя существенную роль в детоксикационных процессах. Кроме того, имеются сведения о важной роли глутатиона при взаимодействии с глутатион-S-трансферазой в детоксикации ксенобиотиков (37). В эритроцитах обследованных онкологических больных при развитии лекарственной гепатотоксичности уровень глутатиона был на 30% ниже нормы, а активность глютатион-S-трансферазы (ГSТ) была снижена в среднем на 20%.
Полученные результаты свидетельствуют о несомненном участии ПОЛ и системы глютатиона в реализации компенсаторных возможностей организма при развитии лекарственной гепатотоксичности. Расстройство регуляции окислительно-восстановительных процессов закономерно ведут к повреждению гепатоцитов продуктами перекисного окисления липидов, нарушению их функции и гибели. В связи с этим логичным представляется применение препарата, регенерирующего антиоксидантную систему глутатиона и восстанавливающего структуру клеточных мембран.
Применение препарата Гепа-Мерц® при лекарственной гепатотоксичности продемонстрировало значимые результаты. Показатели оксида азота и СОД у большинства пациентов значительно снижались и практически соответствовали норме. Наблюдалась также нормализация показателей системы глутатиона. Одним из механизмов защитного действия препарата Гепа-Мерц® является повышение синтеза глутатиона. Возможно, в этом и состоит важный механизм, посредством которого Гепа-Мерц® оказывает защитное воздействие на клетку и снижает окислительный стресс в биологических системах.
Полученные данные указывают на эффективность применения препарата Гепа-Мерц® для восстановления функциональных свойств гепатоцитов. Кроме того, существенно снижались концентрация сывороточного билирубина и активность (хотя и в меньшей степени) аланиновой и аспарагиновой трансаминаз. Клинический и биохимический эффекты достигались и сохранялись при длительном приеме препарата Гепа-Мерц® (как правило, на протяжении нескольких месяцев, а также после завершения курса химиотерапии).
Клиническое состояние начинало улучшаться к 8-14 дню лечения препаратом Гепа-Мерц® и характеризовалось: нормализацией ритма сна или значительным уменьшением дневной сонливости, улучшением памяти, общего самочувствия, уменьшением астенического синдрома. Одновременно отмечалась тенденция к снижению биохимических показателей, характеризующих синдром холестаза и цитолиза (положительная динамика показателей АЛТ, АСТ, ЩФ, ГГТП, билирубина и протромбинового времени) и детоксикационной функции печени (положительная динамика показателей системы глутатиона).
Если необходимость лечения больных с клинически выраженной ПЭ не вызывает сомнений, то вопрос об обязательном лечении ЛПЭ является предметом дискуссии. Наиболее перспективным в лечении ЛПЭ являются препараты, усиливающие обезвреживание аммиака в печени и улучшающие функциональную способность гепатоцитов (Гепа-Мерц®).
Полученные результаты явились основой разработки программ сопроводительной терапии для предупреждения и уменьшения печеночной токсичности при химиотерапии. Опыт работы клиники показал, что защитное действие Гепа-Мерц® позволило сократить количество вынужденных изменений протоколов ПХТ, связанных с поражением печени, у большинства больных. Был разработан алгоритм лечения и профилактики функциональных нарушений печени при химиотерапии.
Стандартная схема применения препарата Гепа-Мерц® предусматривает двухэтапный курс лечения. На первом этапе препарат вводят внутривенно капельно в дозе 20-10 г в день однократно в течение 2-3 недель. Затем больного переводят на пероральный прием препарата в дозе 9-18 г/сут. дважды или трижды в день на протяжении 2-4 недель и более. Следует отметить, что назначение препарата Гепа-Мерц® патогенетически обосновано при затяжном течении лекарственного гепатита. Максимальный курс приема не ограничен. Больным с хронической печеночной недостаточностью в период клинико-гематологической ремиссии необходимо принимать курсовые дозы препарата Гепа-Мерц® – 9-18 г/сут (продолжительность курса лечения определяется врачом индивидуально). Рациональные подходы к коррекции нарушений метаболизма клеток печени – это реальный путь к повышению эффективности лечения.
Есть основания полагать, что Гепа-Мерц® (L-орнитин-L-аспартат) в настоящее время может быть показан и эффективен не только в онкогематологии, но и в программах сопроводительной терапии отделений реанимации и интенсивной терапии. Несмотря на многолетний клинический опыт и многочисленные научные исследования, границы его применения до сих пор не очерчены. Возможности препарата Гепа-Мерц® заслуживают глубокого экспериментального и клинического изучения, а разработка и внедрение методов профилактики и лечения лекарственной печеночной токсичности представляют собой важную медико-социальную проблему не только онкологии, но и реаниматологии, решение которой позволит повысить качество жизни пациентов в период лечения и реабилитации.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.