Влияние Канглайта на иммунологические показатели онкологических больных
- Аннотация
- Статья
- Ссылки




Канглайт (КЛТ) изучен экспериментально и клинически в Китае, где разрешен для практического применения как противоопухолевый препарат с 1997 года. Опыт клинического применения в Китае наглядно показывает, что КЛТ обладает существенной эффективностью при лечении различных видов опухолей, таких как карциномы легких, печени, желудка и молочной железы. В то же время он стимулирует иммунный ответ и улучшает качество жизни: в комбинации с лучевой, химиотерапией и вспомогательной терапией КЛТ демонстрирует значительное увеличение терапевтического эффекта и уменьшение его токсического действия и вреда для организма.
Исследования, проведенные в Шанхайском институте фармацевтической промышленности, показали, что КЛТ стимулирует пролиферацию лимфоцитов селезенки у мышей с лейкемией L1210 in vivo, при этом эффект возрастает с увеличением дозы. В экспериментах по определению действия КЛТ на активность естественных киллеров (NK-клеток) in vivo у мышей с лейкемией L1210 также показано увеличение функциональной активности этих клеток. Активация интерлейкина-2 (IL-2) у мышей с перевитыми опухолями при введении КЛТ (10 мг/кг) оказалась почти в 2,5 раза выше, чем под действием лентинана. В дозах 6,25 мг/кг и 12,5 мг/кг КЛТ сильно активирует фагоцитоз у макрофагов. В то же время КЛТ способен стимулировать у макрофагов секрецию интерлейкина-1 (IL-1).
В эксперименте по определению воздействия КЛТ на терапевтический эффект лимфокинактивированных киллеров (ЛАК-клетки) исследователи обнаружили, что активность ЛАК-клеток по отношению к опухолевым клеткам денди, обработанным КЛТ, была намного выше, чем у необработанных. Одновременно возрастала активность NK-клеток.
При изучении механизма действия выяснилось, что КЛТ задерживает клеточный цикл в фазе G2, индуцирует апоптоз опухолевых клеток, усиливая генетическую экспрессию гена FAS-APO-1, стимулирующего апоптоз и уменьшая экспрессию гена Bcl-2 тормозящего клеточный апоптоз (1). КЛТ активно тормозит ангиогенез опухолей, реверсирует ген множественной лекарственной устойчивости, оказывает выраженное иммуномодулирующее действие (2, 3).
Эти данные послужили основанием для проведения исследования по изучению иммуномодулирующего действия КЛТ при применении у больных распространенным раком легкого и раком желудка. С этой целью в ГУ РОНЦ им. Н.Н.Блохина РАМН проводились клинические исследования второй фазы препарата Канглайт: КЛТ применялся в монорежиме, последовательной комбинации КЛТ с химиотерапией, одновременной комплексной терапией КЛТ и химиотерапией.
Материалы и методы
Иммунологическое обследование проведено у 11 больных немелкоклеточным раком легкого (НМРЛ) на фоне монотерапии канглайтом (2 курса с интервалом 7 дней по 200 мл ежедневно в течение 21 дня); у 5 больных НМРЛ, получавших последовательную терапию КЛТ и химиотерапию; у 6 больных НМРЛ и у 18 больных раком желудка, получавших одновременную комплексную терапию КЛТ и химиотерапию. Состояние клеточного иммунитета оценивали по экспрессии поверхностных антигенов на лимфоцитах периферической крови методом проточной цитофлюориметрии с использованием моноклональных антител к антигенам CD3, CD5, CD7, CD4, CD8, CD20, CD16, HLA-DR, CD38, CD11b, CD25, CD71, CD95, CD50. Кровь для иммунологических анализов брали из локтевой вены утром натощак до и после лечения. Для оценки цитотоксического действия NK-клеток применяли колориметрический метод с использованием МТТ (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолиум бромид). В качестве клеток-мишеней использовали клетки эритромиелоидной лейкемической линии человека К-562, чувствительной к воздействию NK-клеток. Продукцию сывороточных иммуноглобулинов G,A,M определяли методом радиальной иммунодиффузии по Манчини.
Результаты исследования
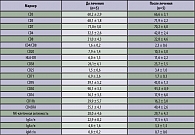
До лечения изменения в основных показателях клеточного иммунитета у больных с НМРЛ выявлялись в 54% случаев и выражались в снижении относительного количества зрелых Т-лимфоцитов (CD3+ клетки) и их субпопуляций СD4+ и CD8+. Кроме того, у 5 из 11 больных было снижено количество HLA-DR+ лимфоцитов, у 3 пациентов снижено число В-лимфоцитов, и у 4 из 11 пациентов было понижено содержание лимфоцитов, экспрессирующих молекулы адгезии СD50. Функциональная активность NK-клеток была подавлена у 6 из 11 больных. После проведения монотерапии КЛТ отмечено повышение количества CD3+ клеток у больных до 63,7± 4,55%; СD4+ – до 39,78 ± 2,27%; CD8+ – до 26,63 ± 3,18% (таблица 1). Увеличение маркеров CD3, CD5, CD4 наблюдалось у 7 из 11 больных (63,6%), CD7 – у 6 из 11 больных (54,5%), CD8 – у 4 из 11 больных (36,3%). Однако показатели субпопуляционного состава лимфоцитов неоднозначны. Так, у 3-х больных обнаружено уменьшение содержания СD3+, CD4+ и CD20+ лимфоцитов. Особо следует подчеркнуть, что увеличение активационных маркеров СD38 наблюдалось у 9 из 11 больных (81,8%), HLA-Dr – у 10 из 11 больных (90,0%), CD25, CD71, CD95- у 6 из 11 больных (54,5%) (таблица 2). Относительное количество NK-клеток увеличилось у 5 из 11 больных и составило 20,3 ± 2,8%, а у 4 человек имело место падение числа СD16+ клеток. Повышение функциональной активности NK-клеток наблюдалось у 6 из 11 больных (54,5%) (таблица 3). Увеличение маркера CD50 с 85,8 ± 3,2 % до 95,4 ± 2,3 % отмечено у 8 из 11 больных (72,7 %). По окончании лечения для 72 % больных характерно значительное увеличение синтеза IgG, IgA, IgM.
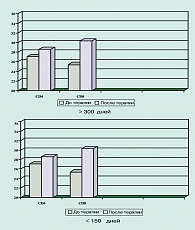
Для оценки значимости иммунологических показателей больные были разделены на 2 группы: прожившие менее 150 дней и прожившие более 300 дней. Следует подчеркнуть, что у больных с НМРЛ, проживших менее 150 дней, возрастала экспрессия CD8 антигена, и уменьшалось число CD4+ лимфоцитов, в то время как у больных, проживших более 300 дней, возрастало число CD4+ лимфоцитов, а количество CD8+ клеток оставалось на исходном низком уровне (рисунок 1).
Следующее иммунологическое обследование проведено у 5 больных НМРЛ, получивших 2 курса КЛТ по 200 мл ежедневно с 1 по 21 день с интервалом 7 дней и химиотерапию. Химиотерапия начиналась на 9-10 неделе. В качестве последовательно назначаемой химиотерапии был избран режим: этопозид 100 мг/м2 в/в 1-3 дни, цисплатин 75 мг/м2 в/в, день1. Химиотерапия осуществлялась в виде 2 трехнедельных циклов до прогрессирования. Динамика показателей иммунного статуса представлена в таблице 4.
Несмотря на проводимое агрессивное лечение у данной категории пациентов не отмечено ухудшение показателей Т-клеточного звена иммунитета. К наиболее характерным изменениям в показателях иммунного статуса после терапии КЛТ следует отнести повышение содержания лимфоцитов, экспрессирующих Т-клеточные маркеры CD3, CD4, CD8, а как следствие нормализацию соотношения CD4+ и CD8+ лимфоцитов, то есть иммунорегуляторного индекса.
В другую группу были включены 6 больных НМРЛ, получившие одновременную терапию КЛТ, гемцитабином и цисплатином. Гемцитабин и цисплатин вводились на 8-й день после начала инъекций канглайта (гемцитабин назначали еще в 15 день). Доза канглайта была увеличена до 300 мл (инфузия 2,5 часа выполнялась 5 раз в неделю в течение 3 недель). Доза гемцитабина составляла 1250 мг/м2 в 8 и 15 дни, а цисплатина 75 мг/м2 в 8 день.
Хотя при химиотерапии на фоне лечения КЛТ динамика иммунологических показателей не так выражена, как при последовательном употреблении КЛТ и химиотерапии, все же более чем у 66% больных отмечена стимуляция Т-лимфоцитов (CD3, CD5, CD7), HLA-DR, NK-клеток (СD-16). Число лимфоцитов, экспрессирующих антигены CD50 и CD95 были в пределах нормы после лечения. Применение КЛТ способствовало возрастанию функциональной активности NK-клеток (рисунок 2).
Таким образом, применение канглайта и комбинации гемцитабина с цисплатином по непосредственным результатам приводило к стимуляции большинства параметров, характеризующих иммунологический статус.
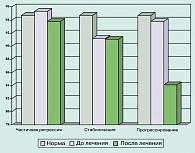
В следующем исследовании представлены данные по изучению иммунологического статуса 18 больных раком желудка, получивших 2 курса КЛТ в режиме ELF (5-фторурацил 500 мг/м2 19-21 день, этопозид 120 мг/м2 19-21 день, лейковорин 20 мг/м2 19-21 день) с интервалом 7 дней, показано, что у больных с частичной регрессией опухоли или стабилизацией процесса по окончании лечения возрастало до нормальных значений или оставалось на нормальном уровне число Т-лимфоцитов (CD3, CD5, CD7, CD4), в то время как у больных с прогрессированием заболевания их количество значительно снижалось. Следует подчеркнуть, что экспрессия антигена CD50 у больных с частичной регрессией опухоли или стабилизацией оставалась в пределах нормы, а у больных с прогрессированием резко снижалась (рисунок 3).
Таким образом, Канглайт при монотерапии способствует стимуляции Т-клеточного звена иммунитета, функциональной активности NK-клеток, активационных антигенов. У больных НМРЛ, переживших 300 дней, при монотерапии Канглайтом отмечалось повышение CD4+ клеток, в то время как у больных, проживших менее 150 дней, количество CD4+ клеток снижалось и резко повышалось количество CD8+ клеток. Последовательное и/или одновременное применение Канглайта и химиотерапии предотвращает иммуносупрессию и стимулирует активность NK-клеток.
Применение Канглайта препятствует развитию иммунодепрессии на фоне агрессивной химиотерапии.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.